Vielversprechende neue Targets – aufstrebende Forschungsgebiete
Bericht:
Mag. pharm. Irene Senn, PhD
Die Jahrestagung der American Association for Cancer Research (AACR) zählt zu den weltweit bedeutendsten Kongressen im Bereich der onkologischen Forschung. Nach zwei „virtuellen“ Jahren konnte die Veranstaltung in diesem Jahr erstmals wieder internationale Teilnehmer vor Ort in New Orleans (USA) zusammenbringen. Zusätzlich wurden alle Präsentationen auf einer Online-Plattform live übertragen. Hier eine Auswahl von herausragenden Forschungsarbeiten.
Polyaneuploide Tumorzellen als Schlüssel für Resistenzen
Bei den meisten humanen Krebserkrankungen zeigt das Genom der Tumorzelle Veränderungen im Vergleich zu nicht neoplastischen Zellen. Diese genetische Instabilität wird heute als eine der Hauptursachen für die Tumorentstehung, aber auch für Metastasierung und Entwicklung von Therapieresistenzen gesehen. Dass die Krebsforschung hier von anderen ökologischen Systemen lernen könnte, demonstrierte Prof. Dr. Kenneth Pienta von der Johns Hopkins School of Medicine in Baltimore (USA) in seinem Vortrag über polyaneuploide Tumorzellen („poly-aneuploid cancer cells“, PACC).
Untypisch große Tumorzellen mit abnormalem Kern wurden in der Fachliteratur bereits in den 1850er-Jahren erstmals beschrieben. Allerdings wurden diese Zellen über 100 Jahre lang als irreversibel seneszente Zellen angesehen, die ihre Funktionalität aufgrund von morphologischen Deformationen und Chromatin-Desorganisation verloren hatten.
Pienta beschäftigt sich in seiner Forschung intensiv mit diesem speziellen Zelltyp und postuliert, „dass diese PACC der zentrale gemeinsame Schlüssel für die Bildung von Metastasen und die Entwicklung von Therapieresistenzen sein könnten“. Damit stellen sie ein vielversprechendes Target für neue Therapien dar.
„PACC sind eine Zellspezies, die sich für ein besseres Überleben adaptiert hat, und nicht einfach nur eine mutierte Tumorzelle“, zeigte sich Pienta überzeugt. Über die Charakteristika von PACC ist mittlerweile einiges bekannt. Typisch sind eine Vergrößerung des Zellvolumens sowie eine Verdoppelung des gesamten Genoms. Der Zellzyklus wird verlassen und die Proliferation pausiert. Eine weitere auffallende Beobachtung ist, dass diese Zellen sehr beweglich sind. Aufgrund ihrer Fähigkeit zur Invasion und ihrer hohen Motilität wird angenommen, dass PACC auch bei der Metastasenbildung eine zentrale Rolle spielen.
PACC sind ein tief konserviertes Überlebensprogramm, das in zahlreichen Organismen als Reaktion auf exogene Stressfaktoren (z.B. Veränderung der Umweltbedingungen, Nährstoffmangel) gefunden werden konnte.1 Tumorzellen haben diesen Mechanismus offenbar für sich adaptiert. „Wir finden Zellen im PACC-Stadium in allen Tumorentitäten in der Histopathologie, außerdem stellen sie eine kleine Teilpopulation in allen bekannten Tumorzelllinien dar.“
Gezielte Eradikation von PACC
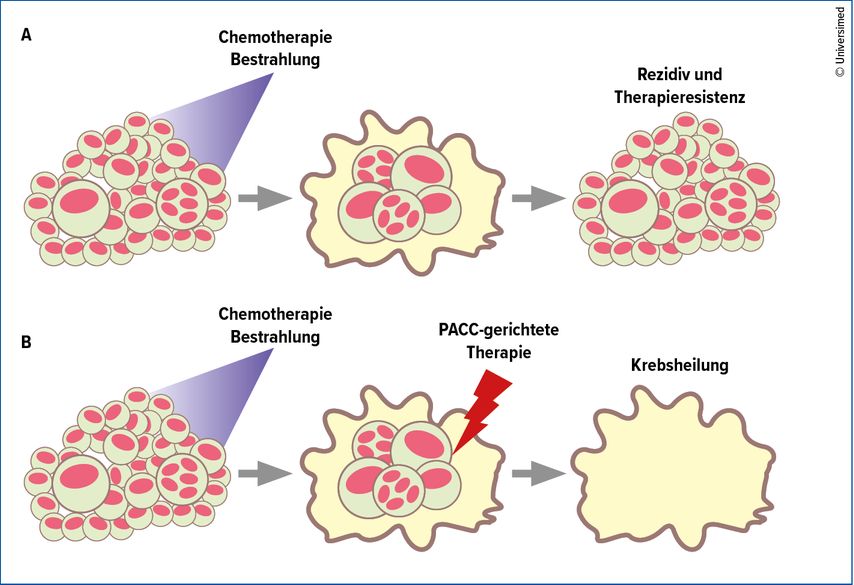
Wird ein Tumor zunächst mit einer klassischen Chemo- bzw. Strahlentherapie therapiert, so kann zwar ein Großteil der Tumorzellen zerstört werden, zurück bleibt aber eine kleine Population von PACC (Abb. 1a). Wenn sich die Umgebungsbedingungen wieder verbessern, verlassen die PACC ihren Ruhezustand und es kommt zum Rezidiv sowie zur Entwicklung von Therapieresistenzen.
Erst die gezielte Eradikation von resilienten PACC könnte es uns zukünftig erlauben, Patienten effizient zu behandeln und Rezidive zu vermeiden (Abb. 1b). Eine ganze Reihe von Ansätzen werden hierfür aktuell untersucht.
Abb. 1: PACC können nach einer Chemotherapie und Bestrahlung für die Entstehung von Resistenzen verantwortlich sein (A). Eine spezielle PACC-gerichtete Therapie könnte der Entstehung von Rezidiven vorbeugen (B). Modifiziert nach Pienta et al.12
Androgene beschränken Erfolg einer Immuntherapie
Geschlechtsspezifische Faktoren werden in der Onkologie häufig noch nicht ausreichend berücksichtigt – allerdings zu Unrecht. Denn Tumorerkrankungen weisen signifikante Geschlechtsunterschiede auf. Und zwar sowohl in Hinblick auf ihre Inzidenz als auch auf das Therapieansprechen und die Prognose.2
Prof. Amy Moran, PhD, von der Oregon Health & Science University in Portland (USA) beschäftigte sich in ihrem Vortrag mit dem unterschiedlichen Ansprechen von Männern und Frauen auf eine Krebsimmuntherapie. Die Immuncheckpoint-Inhibitoren (ICI) haben die Behandlungskonzepte vieler Tumorentitäten revolutioniert. Beim fortgeschrittenen Prostatakarzinom ist das Therapieansprechen bislang jedoch bescheiden. Die Forschungsarbeiten von Moran liefern eine mögliche Erklärung hierfür.
Testosteron blockiert T-Zellen
„Geschlechtshormone wirken sich negativ auf eine Therapie mit ICI aus“, berichtete Moran „und zwar insbesondere Testosteron.“ In Untersuchungen an Patienten mit Prostatakarzinom fand Moran, dass jene Patienten von einer ICI-Therapie am meisten profitierten, bei denen eine niedrige Aktivität des Androgen(AR)-Rezeptors auf den T-Zellen im Tumor nachweisbar war. „Werden die AR-Rezeptoren an T-Zellen aktiviert, so wird die Aktivität der T-Zellen gehemmt“, so Moran. Wurden die AR-Rezeptoren hingegen blockiert, so konnte das Ansprechen auf eine PD-1(„programmed cell death protein 1“)-gerichtete Therapie im Tierversuch verbessert werden.3
Androgen-inhibierende Wirkstoffe wären demnach ein vielversprechender Therapieansatz. Außerdem arbeitet das Team um Moran an einem Assay, mit dessen Hilfe sich zukünftig die Androgenaktivität bereits vor Therapiebeginn bestimmen lassen soll.
Darmmikrobiom und Krebs-Immuntherapie
Auch das Mikrobiom rückt zunehmend in den Fokus der onkologischen Forschung und wurde vor Kurzem als „Hallmark of Cancer“ definiert (s. Artikel auf S.54).4 Erste Erkenntnisse, wie sich die Zusammensetzung der Darmflora auf Immuntherapien auswirkt, präsentierte Prof. Dr. Bertrand Routy, PhD, von der Universität in Montreal (Kanada).
Das anaerobe Bakterium Akkermansia muciniphila (Akk.) hat sich als zuverlässiger Prädiktor für das Ansprechen auf eine Therapie mit ICI erwiesen: Die vollkommene Abwesenheit von Akkermansia im Mikrobiom korrelierte mit einer primären Therapieresistenz gegenüber ICI.5
Außerdem wurde in mehreren Untersuchungen an Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) nachgewiesen, dass eine Breitbandantibiotikagabe vor Therapiebeginn das Gesamtüberleben nach einer anti-PD-1-gerichteten Therapie signifikant reduzierte.6, 7 Als ursächlich hierfür werden ein Diversitätsverlust bzw. ein Shift in der Zusammensetzung des Mikrobioms gesehen. Entscheidend scheint demnach nicht allein das Vorhandsein von Akk. zu sein, sondern das Vorkommen im Verhältnis zu anderen Stämmen.
Routy verfolgt verschiedene Strategien, um diese Antibiotika-assoziierte Dysbiose zu managen. „Ein Ansatzpunkt ist die prophylaktische Gabe eines kohlebasierten Absorbens (DAV132), welches lokal im Darm das Antibiotikum absorbieren und so die schädlichen Effekte auf das Darmmikrobiom unterbinden soll“, erläuterte Routy die laufenden Forschungsarbeiten. Die Ergebnisse einer ersten kleinen klinischen Studie (n=12) waren vielversprechend: Die Dysbiose im Kolon konnte verhindert werden, während die Plasmaspiegel des Antibiotikums nicht negativ beeinflusst wurden.
Fäkale Mikrobiota-Transplantation vielversprechend
Weitere aussichtsreiche Mikrobiom-basierte Therapieansätze betreffen die gezielte Applikation bestimmter Pro- und Präbiotika8 sowie den Einsatz einer fäkalen Mikrobiota-Transplantation (FMT). So verbesserte die Transplantation der fäkalen Mikrobiota von ICI-Respondern in keimfreie Mäuse das Ansprechen der Tiere auf eine nachfolgende PD-1-gerichtete Therapie, wohingegen dieser Effekt ausblieb, wenn der Stuhl von Non-Respondern in die Mäuse transplantiert wurde.6
Basierend auf diesen Ergebnissen wird in einer laufenden klinischen Studie (MIMic-Studie, NCT03772899) der Einfluss einer FMT auf das Ansprechen auf Pembrolizumab bzw. Nivolumab bei Patienten mit fortgeschrittenem Melanom evaluiert. Die ersten Zwischenergebnisse waren vielversprechend, aktuelle Daten werden beim diesjährigen Meeting der American Society of Clinical Oncology (ASCO) präsentiert werden.
Tumormikroumgebung: neuronale Aktivität im Fokus
Ein weiteres aufstrebendes Forschungsgebiet in der Onkologie sind die Neurowissenschaften. „Das Nervensystem ist eine wesentliche Komponente der Tumormikroumgebung, die bislang jedoch zu wenig Beachtung findet“, eröffnete Prof. Humsa Venkatesh, PhD, von der Harvard Medical School und vom Brigham and Women’s Hospital in Boston (USA) ihren Vortrag. Insbesondere bei Gehirntumoren und sekundären Gehirnmetastasen spielen Neuronen eine entscheidende Rolle.
„Wir konnten nachweisen, dass neuronale Impulse in der Tumormikroumgebung das Tumorwachstum von Gliomen fundamental beeinflussen“, unterstrich Venkatesh die Bedeutung dieses vulnerablen Angriffspunktes. Untersuchungen an Gliomen zeigten, dass Neuronen und Tumorgewebe eine Feedback-Schleife bilden. „Die Tumorzellen integrieren sich offensichtlich physisch und funktionell in die normalen neuronalen Strukturen des Gehirns und missbrauchen die physiologischen Mechanismen der neuronalen Signalübertragung für ihre Zwecke“, so Venkatesh. Interessant ist die bidirektionale Art der Interaktion: Die neuronale Aktivität stimuliert das Gliomwachstum und das Gliom stimuliert umgekehrt die neuronale Übererregbarkeit.
Neuroligin-3 stimuliert Tumorwachstum
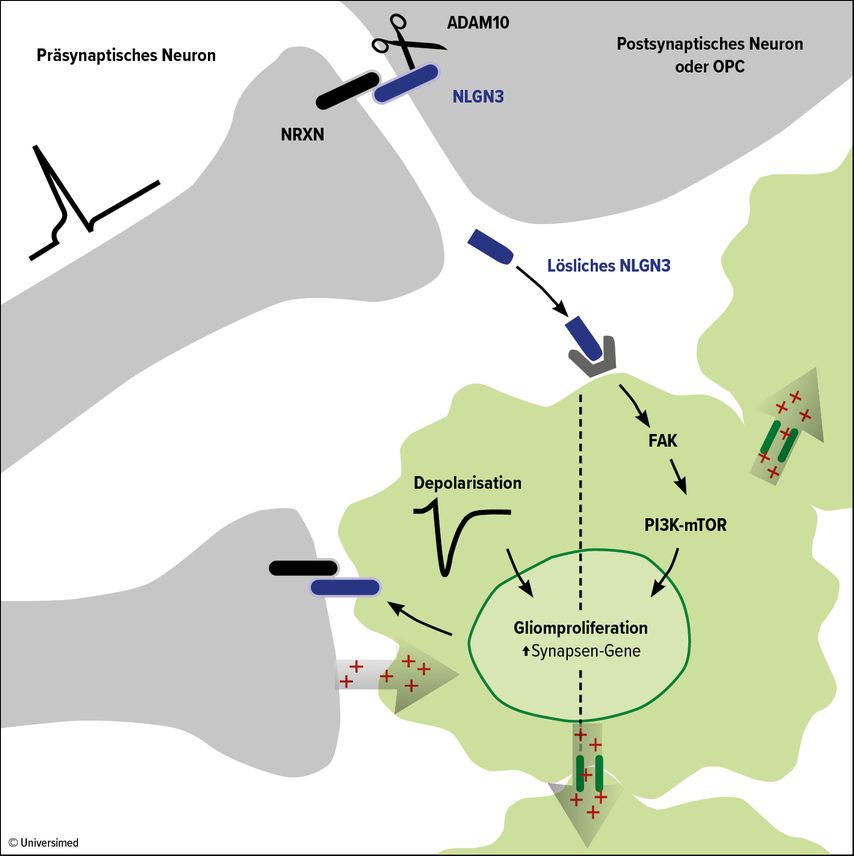
In früheren Untersuchungen konnte Venkatesh bereits einen spezifischen Mechanismus identifizieren, der für diesen Effekt verantwortlich ist: Aktivitätsabhängig kommt es zur Sekretion des Adhäsionsmoleküls Neuroligin-3 (NLGN3), welches die Proliferation der Gliomzellen u.a. über den PI3K-mTOR-Pathway stimuliert.9, 10 In NLGN3-Knock-out-Mäusen wurde die Tumorprogression vollständig verhindert – und zwar bei verschiedensten Arten von Hirntumoren. Und auch die Analyse von Hunderten Gliomproben bestätigte, dass hohe Expressionslevel von NLGN3 mit einer substanziell schlechteren Prognose korrelierten.
In einem nächsten Schritt identifizierte die Arbeitsgruppe das Enzym ADAM10 (Abb. 2). Diese Protease katalysiert die Abspaltung von NLGN3 an Neuronen und Oligodendrozyten-Präkursorzellen (OPC). ADAM10-Inhibitoren wie Aderbasib verhindern die Freisetzung von NLGN3 in die Tumormikroumgebung und könnten eine robuste Blockade des Tumorwachstums bieten. Klinische Studien beim pädiatrischen Glioblastoma multiforme sind bereits im Gange, bei der adulten Form starten sie demnächst.
Abb. 2: Das Enzym ADAM10 führt zur Abspaltung von NLGN3 von Nervenzellen und Gliazellen, was das Wachstum von Gliomzellen stimuliert. ADAM10-Inhibitoren wie Aderbasib könnten diesen Prozess blockieren. Modifiziert nach Venkatesh et al.10
„Wir wissen mittlerweile mit Sicherheit, dass die neuronale Aktivität das maligne Wachstum von Gehirntumoren sowie von sekundären Gehirnmetastasen fördert. Nun gilt es, das maligne Gewebe in seiner Gesamtheit zu verstehen“, so Venkatesh. In ihrer aktuellsten Arbeit konnten sie und ihr Team zeigen, dass ein höherer Grad von Quervernetzungen zwischen Gliomen und dem umgebenden neuronalen Gewebe die kognitiven Fähigkeiten verschlechterte und mit einer reduzierten Überlebenszeit korrelierte.11
Neuer Covid-19-Impfstoff für immunsupprimierte Personen
Die gegenwärtig verfügbaren Covid-19-Impfstoffe zeigen bei onkologischen Patienten teilweise keine ausreichende Wirksamkeit. Der Grund hierfür ist, dass sie überwiegend die humorale Immunantwort stimulieren.
Einer Forschergruppe aus Tübingen (DE) ist es gelungen, einen Impfstoff gezielt für immunsupprimierte Personen zu entwickeln. Die ersten Ergebnisse einer kleinen klinischen Phase-I/II-Studie (NCT04954469) wurden im Rahmen eines Mini-Symposiums vorgestellt.
Das neu entwickelte Präparat CoVac-1 wurde an 14 B-Zell-depletierten Personen geprüft, darunter 12 Patienten mit einer Leukämie- oder Lymphomerkrankung. Die Probanden wurden einmalig mit CoVac-1 geimpft und die Sicherheit und Immunogenität über 6 Monate verfolgt. Bereits 14 Tage nach der Impfung konnte bei 71% der Probanden eine robuste T-Zell-Antwort registriert werden, nach 28 Tagen stieg der Anteil auf 93%.
„Die T-Zell-vermittelte Immunität ist für die Entwicklung einer schützenden antiviralen Reaktion unverzichtbar, und frühere Untersuchungen haben gezeigt, dass T-Zellen Covid-19 auch in Abwesenheit von neutralisierenden Antikörpern bekämpfen können“, erläuterte Claudia Tandler, Doktorandin an der Universität Tübingen.
Bei dem neuen Präparat handelt es sich um einen Protein-basierten Impfstoff mit 6 verschiedenen SARS-CoV-2-Antigenen, darunter auch Teile des Spike-Proteins. Die Kombination von mehreren Virusantigenen soll eine möglichst breite T-Zell-vermittelte Immunreaktion auslösen, sodass die Schutzwirkung auch bei zukünftigen Varianten erhalten bleibt.
Inwieweit die Impfung vor einer Infektion bzw. einem schweren Krankheitsverlauf schützt, wurde nicht untersucht. Eine Phase-III-Studie wird derzeit vorbereitet.
Quelle:
Annual Meeting der American Association for Cancer Research (AACR), 8.–13. April 2022, New Orleans & virtuell
Literatur:
1 Pienta KJ et al.: Semin Cancer Biol 2022; 81: 145-59 2 Haupt S et al.: Nat Rev Cancer 2021; 21(6): 393-407 3 Guan X et al.: Nature 2022 4 Hanahan D: Cancer Discov 2022; 12(1): 31-46 5 Derosa L et al.: Nat Med 2022; 28(2): 315-24 6 Routy B et al.: Science 2018; 359(6371): 91-7 7 Derosa L et al.: Cancer Discov 2021; 11(10): 2396-412 8 Messaoudene M et al.: Cancer Discov 2022; 12(4): 1070-87 9 Venkatesh HS et al.: Cell 2015; 161(4): 803-16 10 Venkatesh HS et al.: Nature 2017; 549(7673): 533-7 11 Krishna S et al.: bioRxiv 2021; 2021.02.18.431915 12 Pienta KJ et al.: Evolutionary Applications 2020; 13(7): 1626-34
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...