Vielversprechende Daten – von Lunge bis Niere
Bericht:
Mag. Dr. Anita Schreiberhuber
Ein Highlight im Rahmen der diesjährigen Frühjahrstagung der Österreichischen Gesellschaft für Hämatologie und Medizinische Onkologie (OeGHO) war wieder die Presidental Session, die unter dem Vorsitz von Prim. Univ.-Prof. Dr. Wolfang Eisterer, Klinikum Klagenfurt am Wörthersee, und Univ.-Prof. Dr. Philipp Jost, Medizinische Universität Graz, stattfand und sich diesmal unter anderem dadurch auszeichnete, dass die Vorträge ausschließlich von Ärztinnengehalten wurden.
Thorakale Tumoren – NSCLC
Priv.-Doz. Dr. Gudrun Absenger, Medizinische Universität Graz, fokussierte sich in ihrem Vortrag auf Neuigkeiten beim nichtkleinzelligen Bronchuskarzinom (NSCLC).
NSCLC im kurativen Setting
In der Phase-III-Studie LUNG ART wurde die Rolle einer postoperativen mediastinalen Radiatio vs. keine Therapie (Kontrollgruppe) im Hinblick auf das krankheitsfreie Überleben (DFS) bei N2-Karzinomen untersucht. Dabei stellte sich heraus, dass die Radiatio keinen Benefit erbrachte: Die 3-Jahres-DFS-Rate vs. Kontrollgruppe war mit 47,1 vs. 43,8% vergleichbar (HR: 0,85; p=0,16), gleichzeitig war die Therapie mit einer Zunahme an kardiopulmonalen Toxizitäten verbunden, deren Ratebei 10,8 vs. 4,9% im Kontrollarm lag. Aus diesem Grund wird eine Radiatio in diesem Setting nicht mehr empfohlen.1
Der schon seit 2016 für das lokal fortgeschrittene/metastasierte NSCLC zugelassene EGFR(epidermaler Wachstumsfaktorrezeptor)-gerichtete Tyrosinkinase(TKI)-Inhibitor Osimertinib2,3 wird nun – basierend auf den Ergebnissen der Phase-III-Studie ADAURA4 – in absehbarer Zeit auch ins adjuvante Setting Einzug finden: Im Studiendesign war die 3-jährige Gabe vs. Placebo (PBO) bei Patienten mitreseziertemEGFR-mutiertem (m)NSCLC im Stadium IB–IIIA vorgesehen. Die Studie wurde vorzeitig entblindet, weil der primäre Endpunkt – die signifikante Überlegenheit im DFS bei Patienten in den Stadien IIB bis IIIA – offensichtlich war: Osimertinib führte zu einer 24-Monats-DFS-Rate von 90% vs. 44%; die Chance, nach dieser Zeitspanne am Leben und progressionsfrei zu sein, betrug 83% (HR: 0,17; p<0,001). In der gesamten Studienpopulation betrug die 24-Monats-DFS-Rate 89% vs. 52% (HR: 0,20; p<0,001). Beeindruckend waren auch die Ergebnisse zum 24-Monats-DFS im ZNS: 98% der Patienten unter Osimertinib vs. 85% in der PBO-Gruppe wiesen zu diesem Zeitpunkt noch keine ZNS-Metastasen auf. Die Nebenwirkungen (AE) waren mit jenendes Verträglichkeitsprofilsvon Osimertinib und den von Anti-EGFR-TKI bekannten vergleichbar und umfassten Diarrhö, Hauttrockenheit und Paronychien. Die Ergebnisse bzgl. des Geamtüberlebens (OS) waren zum Zeitpunkt dieser ersten Auswertung noch nicht reif.4
NSCLC – palliatives Setting
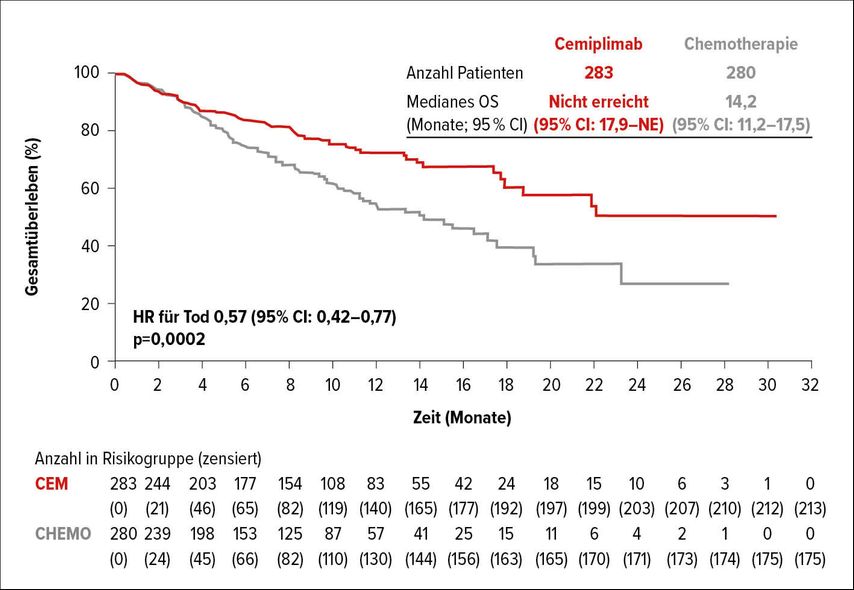
Im palliativen Setting ist davon auszugehen, dass Pembrolizumab (Pembro) als Erstlinientherapie bei Patienten mit einer hohen PD-L1(„Programmed cell death 1 ligand 1“)-Expression (≥50%) bald Konkurrenz bekommen könnte: In der offenen Phase-III-Studie EMPOWER-Lung 15 wurde der für das metastasierte oder lokal fortgeschrittene kutane Plattenepithelkarzinom bereits zugelassene CheckpointInhibitor Cemiplimab6 vs. eine platinbasierte Chemotherapie (CTx) untersucht. Als primärer Endpunkt wurden das progressionsfreie (PFS) und das OS in der ITT(„Intent-to-treat“)-Population bei Patienten mit einer PD-L1-Expression ≥50% definiert. Nach einem medianen Follow-up (FU) von knapp 11 Monaten war das mediane OS (mOS) im Kollektiv der Patienten mit einer PD-L1-Expression ≥50% noch nicht erreicht und wurde für die CTx-Gruppe mit 14,2 Monaten berechnet (HR: 0,57; p=0,0002; Abb. 1) Cemiplimab führte auch zu einer signifikanten Verlängerung des PFS im Ausmaß von 8,2 Monaten (vs. 5,7; HR: 0,54; p<0,0001).5 Als Vorbehalt führte Absenger an, dass die Patientencharakteristika unausgewogen waren – 85% der Studienteilnehmer waren Männer und alle waren Raucher oder Ex-Raucher.5
Abb. 1: Gesamtüberlebensrate von NSCLC-Patienten mit einer PD-L1-Expression ≥ 50% unter Cemiplimab vs. Chemotherapie. Modifiziert nach Sezer A et al.5
Palliative Therapien im onkogenmutierten Setting
Beim EGFRm-NSCLC mit Nachweis einer Insertion am Exon 20 (Exon20Ins) werden mit Mobocertinib und Amivantamab zwei neue Präparate zugelassen werden, die im Rahmen ihrer Zulassungsstudien überzeugende Ergebnisse geliefert haben. „Beide Substanzen sind bereits im Rahmen eines Compassionate-Use-Programms verfügbar“, informierte Absenger. In der Studie EXCLAIM wurde Mobocertinib an NSCLC-Patienten untersucht, die mindestens eine Vortherapie erhalten hatten. In der Kohorte mit einer platinbasierten CTx als Vortherapie betrug die Rate an objektiver Response (ORR) 26%; die „duration of response“ (DOR) lag bei 17,5 Monaten; das mPFS betrug 7,3 Monate und die Krankeitskontrollrate (DCR) belief sich auf 78%, sodass insgesamt klinisch bedeutungsvolle Benefits unter dieser oral einzunehmenden Substanz konstatiert werden können.7
Amivantamab ist ein gegen EGFR und MET gerichteter monoklonaler Antikörper, von welchem bei der „World Conference on Lung Cancer“ (WCLC) 2020 aktualisierte Ergebnisse aus der CHRYSALIS-Studie berichtet worden sind. Auch hier wurden Patienten mit einer platinbasierten Vortherapie eingeschlossen: Mit 40% und 88% warenORR und DCR noch höher als unter Mobocertinib, die DOR lag bei 11,1 Monaten, das mPFS betrug 8,3 Monate. Damit wird eine weitere vielversprechende Substanz verfügbar sein, die imstande ist, den dringenden Bedarf für das Kollektiv der EGFRm-Patienten mit Exon20Ins abzudecken.8
Lorlatinib (Lorla), ein ALK(Anaplastische Lymphomkinase)-gerichteter TKI der dritten Generation, konnte im Head-to-Head-Vergleich mit Crizotinib, dem ALK-Inhibitor der ersten Generation, in der Erstlinie seine signifikante Überlegenheit demonstrieren: Das mPFS wurde unter Lorla nicht erreicht und betrug unter Crizotinib 9,3 Monate (p<0,001). Lorla führte zu einer Reduktion des Risikos für Progression oder Tod um 72% (HR: 0,28).9 „Aktuell sind Brigatinib und Alectinib in der Erstlinientherapie etabliert. Es bleibt abzuwarten, ob es Lorla mit weiteren Daten auch in die Erstlinientherapie schafft“, merkte Absenger an.
Uroonkologie – RCC und Urothelkarzinom
Nierenzellkarzinom (RCC)
Beim fortgeschrittenen/metastasierten Nierenzellkarzinom (RCC) finden zunehmend Kombinationsstrategien Anwendung. So wurde in der Studie CheckMate 9ER die duale Therapie des PD-L1-Inhibitors Avelumab mit dem TKI Cabozantinib vs. Sunitinib bei RCC mit Klarzellkomponente bis zum Progress bzw. zum Auftreten von inakzeptablen Toxizitäten in der Erstlinie untersucht. Aus den ersten Ergebnissen (medianes FU: 18,1 Monate) geht hervor, dass die Kombination vs. Sunitinib mit 16,6 Monatenvs. 8,3 (HR: 0,51; p<0,0001) sogar zu einer Verdoppelung des mPFS (primärer Endpunkt) führt, wobei sich die Kurven des Kaplan-Meier-Plots bereits nach drei Monaten zu separieren begonnen haben. Alle Subgruppen haben von der Doublet-Therapie profitiert. Auch die ORR ist mit 55,7 vs. 27,1% doppelt so hoch wie im Kontrollarm (p<0,0001) und ebenso sprechen die Ergebnisse der Untersuchung der gesundheitsbezogenen Lebensqualität (HRQoL) für die Kombination.10 In einem Update zu den aktuellen ESMO(„European Society of Medical Oncology“)-Guidelines wurden diese Ergebnisse bereits berücksichtigt und die Kombination Nivolumab + Cabozantinib wird mit einer IA-Empfehlung für alle Risikogruppen für die Erstlinie angeführt.11
Urothelkarzinom (UC)
Beim Urothelkarzinom (UC) konnte in den drei von OÄ Dr. Dora Niedersüß-Beke, Klinik Ottakring, Wien, präsentierten Studien zur Immuntherapie weder im adjuvanten noch im palliativen Setting ein OS-Benefit erzielt werden.
Jedoch ist eine Studie zur Maintenancetherapie bei Patienten mit metastasiertem UC erwähnenswert: Und zwar wurde in JAVELIN 100 nach Gabe von vier Zyklen einer platinbasierten Erstlinien-CTx der Switch auf eine Immuntherapie mit Avelumab + Best Supportive Care (BSC) (vs. BSC alleine) als Erhaltungstherapie untersucht. Dabei wurde in einer ersten Interimsanalyse unter Avelumab + BSC vs. BSC eine signifikante Überlegenheit im primären Endpunkt, dem OS, nachgewiesen: Dieses betrug 21,4 vs. 14,3 Monate (HR: 0,69; p<0,001). In der PD-L1+-Subgruppe war das mOS noch nicht erreicht; im BSC-Arm lag es bei 17,1 Monaten (HR: 0,56; p<0,001).12 „Diese Interimsergebnisse haben es in die Plenary Session des Kongresses der American Society of Clinical Oncology [ASCO] 2020 geschafft, was für Daten zum UC durchaus revolutionär ist. Es wurden keine nachteiligen Effekte auf die QoL festgestellt. Diese Therapie ist als neuer Standard of Care nach einer platinhaltigen CTx in diesem Setting zu erachten“, unterstrich Niedersüß-Beke die Relevanz dieser überzeugenden Daten.
Gastrointestinale (GI) Tumoren
Gleich zu Beginn ihres Vortrags betonte Prim. Priv.-Doz. Dr. Birgit Grünberger, Landesklinikum Wiener Neustadt, dass besonders im Bereich der GI-Tumoren innerhalb des vergangenen Jahres sehr viele Fortschritte, und zwar bei fast allen Tumorentitäten, erzielt worden seien.
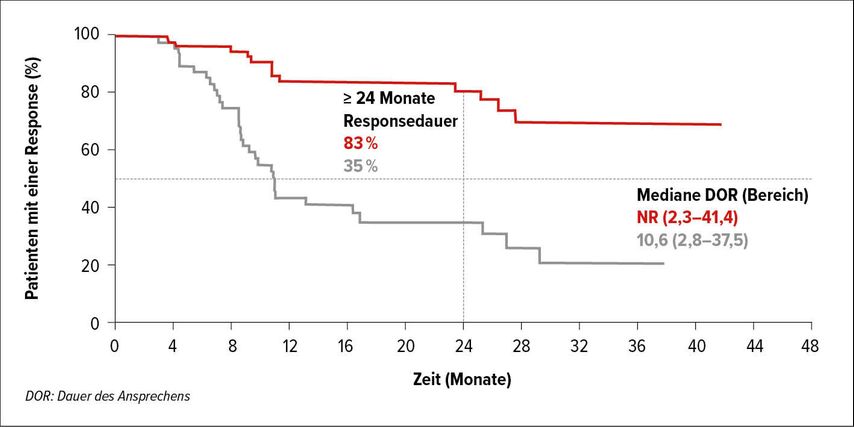
So hat sich basierend auf den Ergebnissen der Phase-III-Studie KEYNOTE-177 mit Pembro die Immuntherapie beim MSI(Mikrosatelliteninstabilität)-high/MMR(Mismatch Repair)-defizienten metastasierten Kolorektalkarzinom (mCRC) als neuer Standard of Care (SOC) für die Erstlinie etabliert. Die Patienten wurden im 1:1-Design zu Pembro bzw. CTx nach Wahl des Prüfarztes randomisiert. Patienten, die unter der CTx progredient wurden, konnten in den Pembro-Arm wechseln. Als koprimärer Endpunkt waren das PFS und das OS definiert. Tatsächlich führte Pembro mit 16,5 Monatenvs. 8,2 Monate unter CTxzu einer Verdoppelung des PFS (HR: 0,60; p=0,0002). Die DOR wurde unter Pembro noch nicht erreicht und betrug unter der CTx 10,6 Monate. Die Rate der 24-Monats-DOR wurde für Pembro mit 83% vs. 35% unter CTx berechnet (Abb. 2). Auch hinsichtlich mCRC-assoziierter Symptome wie Fatigue war Pembro der CTx signifikant überlegen (p<0,0001).13
Abb. 2: Dauer des Ansprechens unter Pembrolizumab vs. Chemotherapie bei Immuntherapie beim MSI-high/MMR-defizienten mCRC in KEYNOTE-177. Modifiziert nach André T et al.13
Auch in die Therapie des Ösophaguskarzinoms hat die Immuntherapie Einzug gefunden: In der Studie KEYNOTE-590 konnte bei therapienaiven Patienten mit Pembro + CTx vs. PBO + CTx die signifikante OS-Überlegenheit mit 13,9 Monaten vs. 5,5 (HR: 0,57; p<0,0001) nicht nur bei PD-L1+-Patienten (definiert als CP [„combined positive] Score“ ≥10) nachgewiesen werden; auch im Gesamtkollektiv war die Überlegenheit signifikant und lag bei 12,6Monaten vs. 9,5 Monate (HR: 0,72; p=0,0006).14
Erfreulicherweise gibt es auch ermutigende neue Daten zum hepatozellulären Karzinom (HCC): In der offenen Studie IMbrave 150 wurde Atezolizumab (Atezo) + Bevacizumab (BEV) vs. Sorafenib im randomisierten Design (2:1) bei Patienten mit unresektablen HCC untersucht. Dabei wurde im Immuntherapie-haltigen Arm eine signifikante OS-Überlegenheit im Ausmaß von 19,2 Monaten vs. 13,4 Monateim Sorafenib-Arm erzielt (HR: 0,66; p=0,0009). Die ORR belief sich auf 35% vs. 14% unter Sorafenib.15 „Nach vielen Jahren, in denen sich bei der Therapie des HCC nichts getan hat, sind das beeindruckende Daten. So gute Ansprechraten sind wir beim HCC nicht gewöhnt“, beurteilte Grünberger die Fortschritte in der Therapie dieser Tumorentität.
Auch beim cholangiozellulären Karzinom (CCC) wurden bedeutsame Fortschritte erzielt. Mutationen der Isozitrat-Dehydrogenase (IDHm) treten bei ca. 13% der CCC-Patienten auf. Ivosidenib (Ivo), ein oraler Inhibitor von IDHm, wurde in der Phase-III-Studie ClarlDY an Patienten mit ≥zwei Vortherapien vs. PBO untersucht. Sowohl das mOS (10,3 vs. 7,5 Monate; HR: 0,79; p=0,093) als auch das mPFS (2,7 vs. 1,4 Monate; HR: 0,37; p<0,001) waren unter Ivo signifikant länger als im PBO-Arm.Die 1-Jahres-PFS-Rate betrug unter Ivo 22% und war für die PBO-Gruppe nicht auswertbar. Bei immerhin der Hälfte der Patienten (51 vs. 28%) konnte eine stabile Erkrankung erzielt werden.16 Angesichts dieser Ergebnisse ist davon auszugehen, dass Ivo die Zulassung in dieser Indikation erhalten wird.
Quelle:
OeGHO-Frühjahrstagung, 8.–10. April 2021 (virtuell)
Literatur:
1 Le Péchoux C et al.: ESMO-Kongress 2020; Abstr. #LBA3_PR 2 EMA: 2020. Online unter https://www.ema.europa.eu/en/medicines/human/EPAR/tagrisso. Abgerufen am 27. April 2021 3 Fachinformation Osimertinib, Stand: Oktober 2020 4 WU Y-L et al.: N Engl J Med 2020; 383: 1711-235 Sezer A et al.: Lancet 2021; 397: 592-604 6Fachinformation Cemiplimab, Stand: April 2021 7 Zhou C et al.: WCLC 2020; Abstr. #OA04.03 8 Sbari J et al.: WCLC 2020; Abstr. #3399 9 Shaw AT et al.: N Engl J Med 2020; 393: 2018-29 10 Choueiri KT et al.: ESMO-Kongress 2020; Abstr. #696O_PR 11 ESMO Guidelines Committee: 2020. Online unter https://www.esmo.org/guidelines/genitourinary-cancers/renal-cell-carcinoma/eupdate-renal-cell-carcinoma-treatment-recommendations-3 . Abgerufen am 28. April 2021 12 Powles T et al.: ASCO-Kongress 2020; Abstr. #LBA1 13 André T et al.: ASCO 2020; Abstr. #LBA4 14 Kato K et al.: ESMO-Kongress 2020; Abstr. #LBA8 15 Finn RS et al.: ASCO GI 2021; Abstr. #267 16 Abou-Alfa GK et al.: Lancet Oncol 2020; 21: 796-807
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...