Urothelkarzinom: neue Wirkstoffe und Targets verändern die Therapielandschaft
Autorin:
OÄ Dr. Dora Niedersüß-Beke, MBA
Zentrum für Onkologie, Hämatologie und Palliativmedizin
I. Medizinische Abteilung, Klinik Ottakring, Wien
Gleich zwei neue Kombinationen haben seit 2023 die Therapielandschaft in der Erstlinie beim fortgeschrittenen Urothelkarzinom neu definiert. Und auch bei höheren Therapielinien gibt es vielversprechende Entwicklungen.
Neue Standards in der Erstlinientherapie
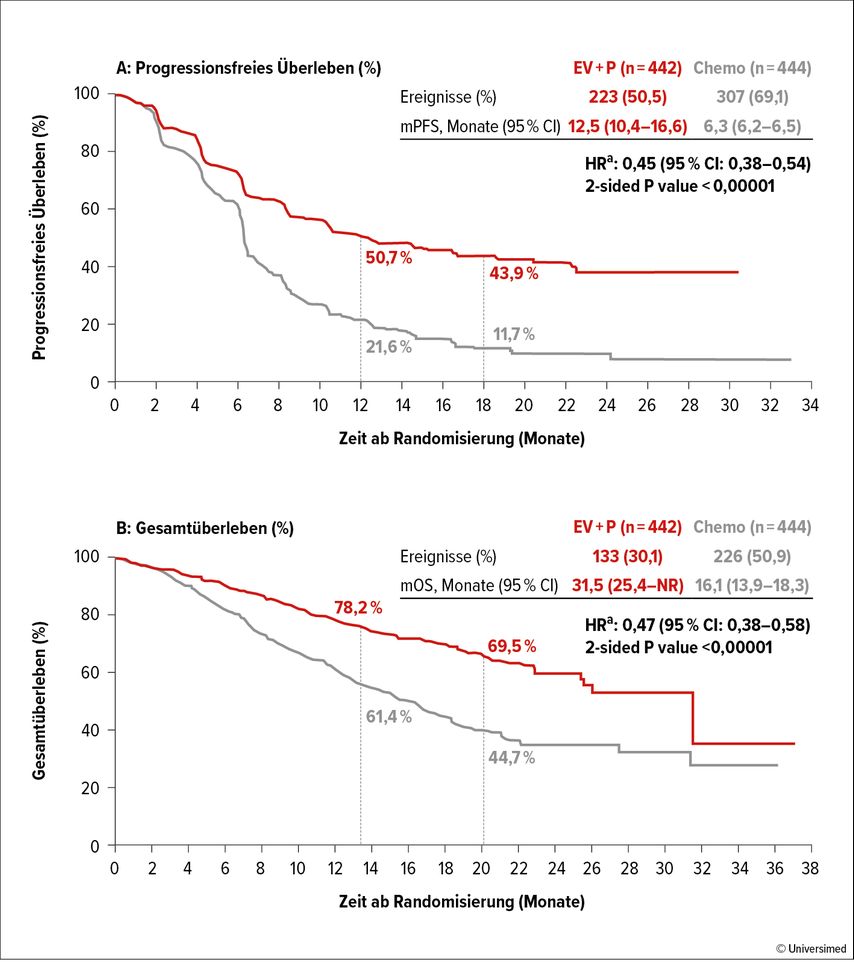
Mit der Präsentation der EV-302-Studie wurde mit einem Schlag die jahrzehntelange Platinära beendet: Untersucht wurde Enfortumab Vedotin (EV), ein gegen Nectin 4 gerichtetes Antibody-Drug Conjugate (ADC), in Kombination mit Pembrolizumab (P). In der Studie erhielten die Patient:innen EV (Tag 1,8)+P (Tag 1) alle drei Wochen versus Platin+Gemcitabin, gefolgt von einer Erhaltungstherapie mit Avelumab. Die dualen primären Endpunkte progressionsfreies Überleben (PFS) und Gesamtüberleben (OS) wurden statistisch hochsignifikant erreicht: PFS wie auch OS wurden beinahe verdoppelt (Abb. 1). In den vordefinierten Subgruppenanalysen überzeugt die Kombination unabhängig von Platintauglichkeit, PD-L1-Status oder Metastasierungsmuster (viszerale Metastasen vs. Lymphknoten alleine). Die Gesamtansprechrate mit 67,7 vs. 44,4% und eine komplette Remissionsrate von 29,1% überzeugen ebenfalls. Das Nebenwirkungsprofil, mit 55,9% ≥-Grad-3-Toxizität, darf jedoch nicht unterschätzt werden. Besonders die Hauttoxizität sowie eine periphere Neuropathie im späteren Therapieverlauf können herausfordernd werden und müssen vom betreuenden Ärzt:innenteam regelmäßig evaluiert werden. Eine Zulassung dieser Kombination wird für Herbst 2024 erwartet.
Zeitgleich wurde die Checkmate-901-Studie präsentiert, in der erstmalig ein Vorteil für die Upfront-Kombination eines Checkpoint-Inhibitors mit einer Cisplatin-haltigen Chemotherapie gezeigt werden konnte. Cisplatin+Gemcitabin+Nivolumab gefolgt von einer Nivolumab-Erhaltungstherapie zeigte sowohl beim OS als auch beim PFS eine statistische Signifikanz, wobei der Benefit im OS mit drei Monaten und eine Erhöhung der Grad-3+-Toxizität von 10% kritisch diskutiert werden sollten. Die Gesamtansprechrate mit 57,6% vs. 43,1% und eine komplette Remissionsrate von beinahe 22% überzeugen wiederum nachhaltig.
Nach der kompletten Neugestaltung der Erstlinientherapie beim la/m Urothelkarzinom bleiben einige spannende Fragen offen, etwa wer für EV+Pembro nicht infrage kommt, jedoch für eine Cisplatin-haltige Therapie in Kombination mit Nivolumab geeignet ist, was nach EV+Pembro in höheren Therapielinien folgt u.v.m.
Höhere Therapielinien und neue Targets beim Urothelkarzinom
FGFR3/2alt, HER2 und TROP-2 sind nach Nectin 4 und PD-L1 die neuen Targets, welche in höheren Therapielinien als Therapieziel dienen.
Als wichtigster neuer molekularer Marker präsentiert sich die FGFR3-Alteration, die beim lokal fortgeschrittenen/metastasierten Urothelkarzinom (la/m UC) in ungefähr 20% detektiert werden kann. In der Phase-III-THOR-Studie erhielten die Patient:innen mit einer FGFR2/3-Fusion oder -Mutation nach ein bis zwei Systemtherapien inkl. eines PD(L1)-Inhibitors den Pan-FGFR-Inhibitor Erdafitinib 8mg, 1x tgl. p.o., oder Chemotherapie (Docetaxel oder Vinflunin). Der primäre Endpunkt, das OS, wurde mit 12,1 vs. 7,8 Monate (HR: 0,64) signifikant erreicht, die Ansprechrate von 11,5 auf 45,6% erhöht. Somit stellt Erdafitinib den neuen Standard bei entsprechendem molekularem Profil für diese Population dar.
In der Kohorte 2 dieser Studie, in der Patient:innen bereits nach einer Systemtherapie ohne PD(L1)-Inhibitor inkludiert wurden, konnte der Benefit im OS, trotz höherer Ansprechraten für Erdafitinib, nicht bestätigt werden. Daher wird Erdafitinib erst nach zwei Vortherapien inkl. eines PD(L1)-Hemmers von den Guidelines empfohlen. Darüber hinaus ist das Toxizitätsprofil dieser Substanz, bestehend aus dem Hand-Fuß-Syndrom, Stomatitis, Nagelveränderungen, Sehstörungen und Hyperphosphatämien, durchaus fordernd und bedarf eines entsprechenden Therapiemanagements. Eine Zulassung in Europa wird ebenfalls für Herbst 2024 erwartet.
Falls keine FGFR2/3-Alteration vorliegt, kann Sacituzumab Govitecan (SG), ein ADC gegen TROP-2, in höheren Therapielinien eingesetzt werden. Mit Ansprechraten von beinahe 30%, einem PFS von 5,4 Monaten und einem OS von 10,9 Monaten ist es eine potente Option für schwer vortherapierte Patient:innen.
In naher Zukunft werden HER2-gerichtete ADCs wie Disitamab Vedotin oder Trastuzumab Deruxtecan für Patient:innen mit einer HER2/neu-Überexpression die Therapielandschaft erweitern.
Ob in weiterer Zukunft Triplet-Kombinationen mehrerer ADCs, sogenannter DADs (doppelte ADCs), mit Immuntherapien der aktuellen Duplette mit EV+Pembro überlegen sind, bleibt abzuwarten. Inzwischen werden diese hochpotenten Substanzen bereits in früheren Therapielinien (neoadjuvant, adjuvant) untersucht und sie werden beim muskelinvasiven Stadium (MIBC) den Einzug schaffen.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...