Urothel- & Prostatakarzinom: große und kleine Sprünge in der Therapie
Autor:innen:
Ass. Dr. Heidemarie Ofner
Dr. Johanna Krauter
OA Dr. Kilian M. Gust
Univ.-Prof. Dr. Shahrokh F. Shariat
Universitätsklinik für Urologie
Comprehensive Cancer Center (CCC) Medizinische Universität Wien
Korrespondenz:
E-Mail: kilian.gust@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine neue Erstlinientherapie beim metastasierten Urothelkarzinom der Blase, neue Therapieoptionen im nichtmuskelinvasiven Setting des Blasenkarzinoms, ein erweitertes Therapiearmamentarium beim metastasierten Prostatakarzinom und die zunehmende Relevanz der personalisierten Medizin – diese Themen und viele weitere erwarten Sie im folgenden Highlightbericht vom ESMO-Kongress 2023 zum Urothel- und Prostatakarzinom.
Urothelkarzinom
Lokal fortgeschrittenes und metastasiertes Urothelkarzinom
EV-302-Studie
Platinbasierte Chemotherapie galt seit Jahrzehnten als die Erstlinientherapie für das metastasierte und lokal fortgeschrittene Urothelkarzinom. Beim diesjährigen ESMO-Kongress in Madrid wurden Daten präsentiert, die die Therapielandschaft von Grund auf verändern: Prof. Dr. Thomas Powles stellte die Ergebnisse der EV-302-Studie vor, einer randomisierten Phase-III-Studie, in der Patient:innen entweder das Antikörper-Wirkstoff-Konjugat (ADC) Enfortumab Vedotin (EV) mit dem PD-L1-Inhibitor Pembrolizumab oder eine platinbasierte Chemotherapie erhielten.
Grundlegend wirken ADCs über einen Antikörper gegen ein Protein gerichtet, welches möglichst spezifisch in Karzinomen exprimiert wird, und einen daran gekoppelten zytotoxischen Wirkstoff. Im Falle von EV handelt es sich hierbei um den Antikörper gegen Nectin-4, das von Urothelkarzinomen überexprimiert wird, gekoppelt an MMAE, das als Mikrotubulihemmer den Zellzyklus stoppt. Somit ist eine zwar systemische, jedoch molekular zielgerichtete Therapie möglich.
Die Daten aus der EV-302-Studie zeigten eine deutliche Verlängerung des progressionsfreien Überlebens (PFS) mit der Kombination von EV+Pembrolizumab und eine bisher noch nie erreichte Verlängerung des Gesamtüberlebens (OS) von 31,5 Monaten im Vergleich zur bisherigen Standardtherapie mit 16,1 Monaten – somit nahezu eine Verdoppelung der Überlebenszeit von Patient:innen mit metastasiertem Urothelkarzinom (HR: 0,47; 95% CI: 0,38–0,58; p<0,00001). Die Wirksamkeit war hierbei unabhängig davon, ob die Patient:innen für eine cisplatinhaltige Chemotherapie geeignet waren oder ein carboplatinbasiertes Regime erhielten.
Das Nebenwirkungsprofil der Kombinationstherapie aus EV+Pembrolizumab bezieht sich vor allem auf dermatologische Nebenwirkungen, periphere Neuropathie, Erkrankungen der Augen sowie Hyperglykämie.
Diese sensationellen Zahlen führen einen neuen Standard der Erstlinientherapie des metastasierten und lokal fortgeschrittenen Urothelkarzinoms in die klinische Praxis ein; dennoch folgt diesem neuen Wissensgewinn ein Vakuum an Evidenz für die Behandlung von Patient:innen in darauffolgenden Linien.
Für unsere klinische Praxis ist somit bis dato unklar, wie Patient:innen nach einem Progress auf EV+Pembrolizumab weiterbehandelt werden sollen: Wie viele Patient:innen können nach EV/Pembrolizumab noch eine platinhaltige Chemotherapie erhalten? Wie ist das therapeutische Ansprechen auf platinbasierte Chemotherapie nach EV+Pembrolizumab? Gibt es hier Platz für eine weitere Immuntherapie im Sinne einer Rechallenge nach PD-L1-Inhibition, die sich bisher als nicht erfolgreich erwies? Ist eine FGFR-Inhibition eine Möglichkeit in der Drittlinie?1
CheckMate-901-Studie
Die Kombination von cisplatinbasierter Chemo- und Immuntherapie in der Erstlinie wurde von der Studie CheckMate 901 untersucht. Patient:innen wurden ebenfalls im Sinne einer 1:1-Randomisierung zwei Therapiearmen zugeordnet, zum einen der Standardtherapie Gemcitabin mit Cisplatin, zum anderen der Kombination aus Gemcitabin und Cisplatin für 6 Zyklen gemeinsam mit Nivolumab, welches bis zu einem Progress der Erkrankung weiter verabreicht wurde. Beide koprimären Endpunkte der Studie wurden erreicht: Das OS konnte um 3 Monate verlängert werden (21,7 vs. 18,9 Monate; HR: 0,78; 95% CI: 0,63–0,96; p=0,017) und das PFS wurde ebenfalls verlängert (7,6 vs. 7,9 Monate; HR: 0,72; 95% CI: 0,59–0,88; p=0,0012). Die Studie CheckMate 901 ist als positiv zu bewerten, wenn auch die Ergebnisse nicht zu vergleichen sind mit der zuvor genannten EV-302-Studie.
Die Daten aus den beiden Studien EV-302/KEYNOTE-A39 und CheckMate 901 stellen die seit Jahrzehnten etablierte Chemotherapie als monotherapeutische Erstlinie in den Schatten. Der ehemalige Standard verliert seinen Stellenwert für Immuntherapie-geeignete Patient:innen. Des Weiteren bewegen sich unsere Therapieschemata weg von einem starren Einhalten von Therapiezyklen hin in die Richtung einer Behandlungsdauer abhängig vom klinischen Verlauf der Erkrankung: behandeln, solange die Therapie wirksam ist und toleriert wird, bis hin zum Progress.2
THOR-Studie
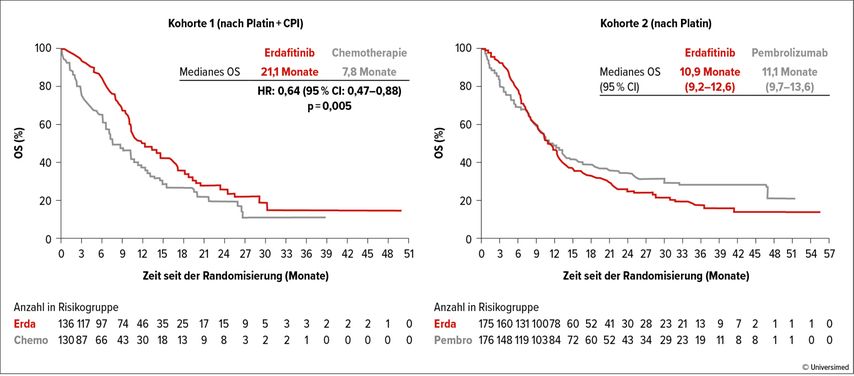
Zudem wurden die bis dato noch ausstehenden Daten der Kohorte 2 der randomisierten Phase-III-Studie THOR präsentiert. Patient:innen mit FGFR2/3-Alterationen erhielten entweder den oralen FGFR-Inhibitor Erdafitinib oder Pembrolizumab. Jedoch zeigte sich unter Erdafitinib keine Verlängerung des Gesamtüberlebens,3 wie sie in der Kohorte 14 im Vergleich zu konventioneller Chemotherapie (Taxan oder Vinflunin) zuvor beobachtet wurde, sodass Erdafitinib zukünftig seinen Stellenwert nach Chemo- und Immuntherapie finden wird (Abb. 1).
Nichtmuskelinvasives Blasenkarzinom
Im Setting des nichtmuskelinvasiven Blasenkarzinoms (NMIBC) drehten sich diverse Präsentationen und Diskussionen am ESMO-Kongress um die Verbesserung der intravesikalen Therapie und die Evaluierung zielgerichteter systemischer Therapie.
SunRISe-1-Studie
In der Studie SunRISe-1 erfolgte eine Monotherapie mit intravesikal verabreichtem Gemcitabin (TAR-200), abgesondert durch die Anlage einer „Brezel“ in die Blase, mit kontinuierlicher Absonderung des Arzneimittels über mehrere Wochen. Die Ergebnisse der Phase-IIb-Studie zeigten, dass bei 77% der Patient:innen mit Hochrisiko und nicht-BCG(Bacillus Calmette-Guérin)-responsivem NMIBC ein vollständiges Ansprechen festgestellt werden konnte, wobei die mediane Ansprechdauer noch nicht erreicht wurde.5
THOR-2-Studie
Mit einer ähnlichen Patient:innen-Klientel beschäftigte sich die Studie THOR-2: Patient:innen, die nicht fit genug für eine Zystektomie mit Hochrisiko-NMIBC und einem Rezidiv nach BCG waren, wurden entweder mit Erdafitinib oder mit intravesikaler Chemotherapie behandelt.
Es wurden ausschließlich Patient:innen mit einer festgestellten FGFR2/3-Alteration eingeschlossen. Die Therapie mit oralem Erdafitinib verlängerte das rezidivfreie Überleben (RFS) signifikant nach zwölf Monaten (73% vs. 41%). Dennoch ist erwähnenswert, dass Patient:innen im investigativen Therapiearm an deutlich mehr schwerwiegenden Nebenwirkungen litten als jene im Kontrollarm. Die Studie wurde deswegen vorzeitig beendet.
Um diese systemische Toxizität zu verringern, warten wir auf die Ergebnisse weiterer Studien, die die Therapie mit Erdafitinib, ebenfalls mittels intravesikaler TAR-210-Applikation lokal in der Blase abgegeben, untersuchen.6
Fazit
Beim ESMO-Kongress 2023 wurde eine neue Erstlinientherapie beim metastasierten Urothelkarzinom der Blase vorgestellt, durch welche das Überleben von Patient:innen in diesem Setting deutlich verlängert werden konnte.
Auch im nichtmuskelinvasiven Setting des Blasenkarzinoms wurden neue Therapieoptionen vorgestellt, die zukünftig die Therapie verändern könnten.
Video-STATEMENT OA Dr. Kilian Gust, FEBU
Neue Anwendungstechniken beim nichtmuskelinvasiven Urothelkarzinom
Rolle von Erdafitinib intravesikal? – Weiteres Thema: natürlich der Durchbruch im metastasierten Setting in gleich zwei Studien
Literatur:
1 Powles TB et al.: EV-302/KEYNOTE-A39: open-label, randomized phase 3 study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). ESMO 2023; Abstr. #LBA6 2 Van der Heijden MS et al.: Nivolumab plus gemcitabine-cisplatin vs. gemcitabine-cisplatin alone for previously untreated unresectable or metastatic urothelial carcinoma: results from the phase 3 CheckMate 901 trial. ESMO 2023 3 Stockem CF: Long-term survival upon anti-PD-(L)1 monotherapy in metastatic urothelial cancer (mUC): a multicenter retrospective study. Ann Oncol 2023; 34(Suppl 2): S1202-28 4 Loriot Y et al.: Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023; doi: 10.1056/NEJMoa2308849 5 Necchi A et al.: Results from SunRISe-1 in patients (Pts) with bacillus Calmette–Guérin (BCG)-unresponsive high-risk non–muscle-invasive bladder cancer (HR NMIBC) receiving TAR-200 monotherapy. Ann Oncol 2023; 34(Suppl 2): S1254-335 6 Catto JWF et al.: THOR-2 Cohort 1: results of erdafitinib (erda) vs intravesical chemotherapy (chemo) in patients (pts) with high-risk non-muscle-invasive bladder cancer (HR NMIBC) with select fibroblast growth factor receptor alterations (FGFRalt) who received prior bacillus calmette-guérin (BCG) treatment. ESMO 2023; Abstr. #LBA102
Prostatakarzinom
PSMAfore-Studie
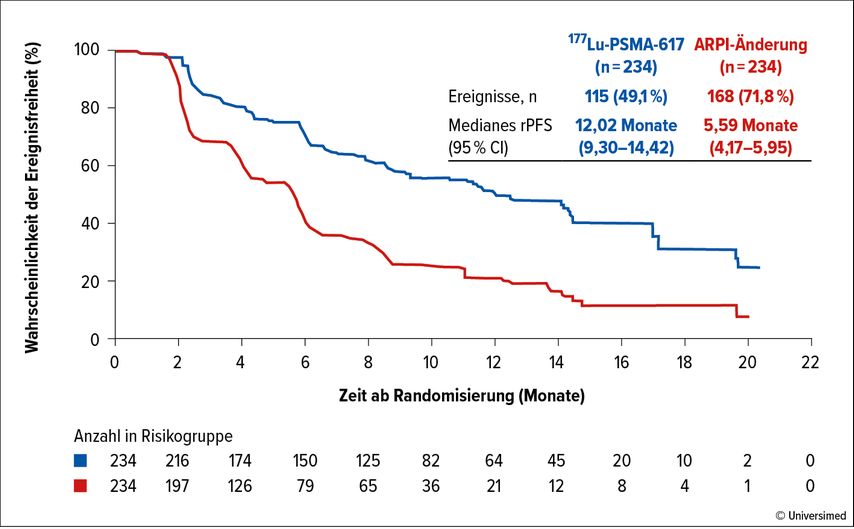
Mit Spannung erwartet wurden unter anderem die Daten der PSMAfore-Studie, präsentiert von Prof. Dr. Oliver Sartor. Die Phase-III-Studie, für die auch die Medizinische Universität Wien als rekrutierendes Zentrum fungierte, befasst sich mit dem metastasierten, kastrationsresistenten Prostatakarzinom (mCRPC). Patienten, die einen Progress nach einer Androgenrezeptor-gerichteten Therapie (ARTA) entwickelten, wurden nach einem 1:1-Schema in zwei Therapiearme randomisiert: 177Lutetium-PSMA-617 oder der Wechsel zu einem zuvor noch nicht verabreichten ARTA. Die Radioligandentherapie mit 177Lutetium-PSMA-617 ermöglicht eine präzise zytostatische Therapie über den β-Strahler Lutetium, welcher über Endozytose in PSMA-exprimierende Prostatakarzinomzellen eindringt.
Als primärer Endpunkt der Studie wurde das radiografische progressionsfreie Überleben (rPFS) gewählt, sekundäre Endpunkte bestanden aus dem Gesamtüberleben und aus Ergebnissen bestimmter Fragebögen, die die Lebensqualität der Patienten abbilden. Wichtig zu erwähnen ist, dass in der Studie ein Cross-over zwischen den Therapiearmen ermöglicht wurde: Patienten im Kontrolltherapiearm konnten in den investigativen Arm mit 177Lutetium-PSMA-617 wechseln, sofern sie während des Beobachtungszeitraums einen radiografischen Progress der Erkrankung erlebten. Die Daten zum Gesamtüberleben wurden statistisch an dieses Cross-over angepasst.
Die Ergebnisse zeigten, dass sich das rPFS im 177Lutetium-PSMA-617-Arm signifikant verlängerte (12,0 Monate vs. 5,5 Monate im Kontrollarm). Die Analyse des Gesamtüberlebens zeigte einen positiven Trend für die Therapie mit 177Lutetium-PSMA-617, dies jedoch ohne statistische Signifikanz, wobei 84,2% der inkludierten Patienten den Therapiearm im Rahmen des Cross-overs wechselten (Abb. 2).
Zur Interpretation dieser Ergebnisse gilt es somit festzuhalten: Die Studie erreichte ihren primären Endpunkt und ist als positiv zu bewerten. Das Gesamtüberleben ist lediglich ein sekundärer Endpunkt und der Aufbau der Studie ist nicht für die statistische Interpretation dieses Endpunktes ausgelegt. Bei einem Cross-over von >80% der Patienten beantwortet dieser sekundäre Endpunkt außerdem möglicherweise eher die Frage des Zeitpunktes einer 177Lutetium-PSMA-617-Therapie und nicht die Fragestellung „177Lutetium-PSMA-617: ja oder nein?“.1
ENZA-p-Studie
Der Vorteil von einer Therapie mit 177Lutetium-PSMA-617 wurde in der Präsentation der Phase-II-Studie ENZA-p am ESMO-Kongress 2023 weiter bekräftigt. Patienten mit mCRPC erhielten die Radioligandentherapie mit der Kombination von Enzalutamid vs. Enzalutamid-Monotherapie.
Der primäre Endpunkt, das PSA-progressionsfreie Überleben, wurde statistisch signifikant erreicht. Die Studie war so konzipiert, dass initial zwei Zyklen des Radioliganden verabreicht wurden und eine weitere Verabreichung von 177Lutetium-PSMA-617 von Bildgebung und PSMA-Expression abhängig gemacht wurde. Dieses Therapieschema hält sich somit an den Grundsatz der Radioligandentherapie – zu therapieren, was gesehen wird – und bewegt unsere Therapiekonzepte weiter weg von einem starren Vorgehen nach bestimmten Zyklen.2 Seit 2023 findet sich die Therapie mit 177Lutetium-PSMA-617 auch in den EAU-Guidelines wieder und wird für PSMA-exprimierende Patienten mit mCRPC empfohlen.3
Studien KEYNOTE-641 & KEYNOTE-991
Ebenso wurden beim ESMO-Kongress Daten bezüglich Immuntherapie beim metastasierten Prostatakarzinom vorgestellt. Die Studien KEYNOTE-641 und KEYNOTE-991 untersuchten Pembrolizumab in der Kombination mit Enzalutamid in zwei verschiedenen Therapiesettings: einerseits im hormonsensitiven und andererseits im kastrationsresistenten Stadium der Erkrankung.
In beiden Studien wurde der primäre Endpunkt zum Zeitpunkt der ersten Zwischenanalyse nicht erreicht und die Studien wurden gestoppt. Somit gibt es bis dato keinen Anhalt auf eine Verlängerung des OS oder des rPFS durch eine Therapie mit dem PD-L1-Inhibitor Pembrolizumab beim metastasierten Prostatakarzinom basierend auf Ergebnissen einer Phase-III-Studie.4,5
ProBio-Studie
Auch beim Prostatakarzinom entwickeln sich unsere Therapiekonzepte immer mehr in die Richtung einer personalisierten Medizin. Die Studie ProBio untersuchte verschiedene Biomarker, anhand welcher Patienten randomisiert wurden: Androgenrezeptor(AR)-Wildtyp, TP53-Wildtyp und -Mutationen, DNA-Reparatur-Defizienzen und die sogenannte TMPRSS2:ERG-Fusion.
Je nach Biomarker wurden Patienten entweder mit ARTA, taxan- oder platinbasierter Chemotherapie oder mit dem PARP-Inhibitor Niraparib in Kombination mit Abirateron behandelt. Die Ergebnisse zeigten, dass Patienten mit frei zirkulierender Tumor-DNA favorisiert mit ARTA behandelt werden sollten und dass Patienten mit einer TP53-Alteration prinzipiell ein schlechteres Outcome erreichten. Es wird eine neue Therapie für diese spezifische Patientenkohorte benötigt.6
AMG-509-Studie
Weitere Ergebnisse, die in Richtung einer personalisierten Therapie beim mCRPC gehen, wurden im Rahmen der Phase-I-Studie AMG 509 präsentiert.
Das Medikament Xaluritamig bindet an das Enzym STEAP1, das von Prostatazellen exprimiert wird, und ermöglicht einen T-Zell-mediierten Untergang der Karzinomzellen. Das PSA-Ansprechen auf diese Therapie erwies sich als vielversprechend, dennoch erlebten alle der 97 inkludierten Patienten Nebenwirkungen, >50% davon mitCTCAE(allgemeine Terminologiekriterien für unerwünschte Ereignisse)-≥3-Nebenwirkungen.
Um das Therapiekonzept weiter zu interpretieren, wird auf die Ergebnisse von Phase-II- und Phase-III-Studien gewartet, potenziell auch in Kombination mit anderen bereits etablierten Therapieoptionen.7
RADICALS-RT-Studie
Auch die Sicherheit und Effizienz einer adjuvanten Strahlentherapie wurde beim ESMO-Kongress thematisiert: Die randomisierte Phase-III-Studie RADICALS-RT schloss Patienten mit einem biochemischen Progress nach radikaler Prostatektomie und zumindest einem Risikofaktor (pathologisches T-Stadium 3 oder 4, Gleason-Score 7–10, positiver R-Status oder präoperatives PSA ≥10ng/ml) ein.
Es erfolgte eine 1:1-Randomisierung zwischen sofortiger adjuvanter Radiotherapie oder Observanz und folgend Salvage-Radiatio bei PSA-Progress. Insgesamt wurden 1396 Patienten zwischen 2007 und 2016 randomisiert. Eine adjuvante Radiotherapie erhöhte das Risiko für Morbidität im Bereich der Harnwege und des Darms und die primären und sekundären Endpunkte der Studie wurden nicht erreicht. Somit wurden die Position und die Sicherheit der Early-Salvage-Bestrahlung untermauert.8
Fazit
Auch beim metastasierten Prostatakarzinom erweitert sich unser Therapiearmamentarium immer weiter, 177Lu-PSMA-617 zieht mit der PSMAfore-Studie in die Therapieoptionen für vortherapierte, PSMA-exprimierende mCRPC-Patienten ein.
Die zunehmende Relevanz der personalisierten Medizin wurde von der ProBio-Studie bis zu den vielen Diskussionen zu PARP-Inhibitoren erneut betont.
Video-STATEMENT Dr. Johanna Krauter
Prostatakarzinom: neue Therapieoption – ja oder nein?
PSMAfore: 177Lu-PSMA-617 bei Taxan-naivem metastasiertem CRPC – KEYNOTE-991 und KEYNOTE-641: Pembrolizumab als zusätzliches Tool zu Enzalutamid?
Literatur:
1 Sartor O et al.: Phase 3 trial of [177Lu]Lu-PSMA-617 in taxane-naive patients with metastatic castration-resistant prostate cancer (PSMAfore). ESMO Congress 2023; Abstr. #LBA13 2 Emmett L et al.: Enzalutamide and 177Lu-PSMA-617 in poor-risk, metastatic, castration-resistant prostate cancer (mCRPC): a randomised, phase II trial: ENZA-p (ANZUP 1901). Ann Oncol 2023; 34(Suppl 2): S1254-335 3 EAU Guidelines. Edn. presented at the EAU Annual Congress, Milan 2023. ISBN 978-94-92671-19-6 4 Graff JN et al.: KEYNOTE-641: phase III study of pembrolizumab (pembro) plus enzalutamide for metastatic castration-resistant prostate cancer. Future Oncol 2021; 17(23): 3017-26 5 Gratzke C et al.: KEYNOTE-991: pembrolizumab plus enzalutamide and androgen deprivation for metastatic hormone-sensitive prostate cancer. Future Oncol 2023; doi: 10.2217/fon-2022-0776 6 Grönberg H et al.: Androgen receptor pathway inhibitors or taxanes for patients with metastatic castration-resistant prostate cancer: a direct comparison in ProBio, a randomized, outcome-adaptive, biomarker-driven platform. ESMO 2023; Abstr. #LBA86 7 Kelly W, Danila D: Interim results from a phase 1 study of AMG 509 (xaluritamig), a STEAP1 x CD3 XmAb® 2+1 immune therapy, in patients with metastatic castration-resistant prostate cancer (mCRPC). ESMO 2023; Abstr. #1765O 8 Parker C et al.: Timing of radiotherapy (RT) after radical prostatectomy (RP): final results of RADICALS RT randomised controlled trial. ESMO 2023; Abstr. #1764O
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...