Update: Wie Transfusionen vermeiden?
Autor:
OA Univ.-Prof. Dr. Michael Pfeilstöcker, MBA
3. Medizinische Abteilung
Hanusch-Krankenhaus, Wien
E-Mail: michael.pfeilstoecker@oegk.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Für Niedrigrisiko-Patient:innen mit myelodysplastischen Syndromen (MDS) ist die transfusionsbedürftige Anämie oft das zentrale lebensqualitätseinschränkende Problem. Neue Therapieansätze auf diesem Gebiet bringen bereits jetzt deutliche Fortschritte und lassen für die Zukunft weitere Verbesserungen erhoffen.
Keypoints
-
Die transfusionsbedürftige Anämie ist das führende Charakteristikum bei Niedrigrisiko-MDS mit Folgen für Lebensqualität, Morbidität und Mortalität.
-
Epo, Transfusionen, Eisenchelation, in spezifischen Konstellationen Lenalidomid und Immunsuppressive Therapie sind langbewährte Therapieoptionen.
-
Luspatercept zeigt im randomisierten Vergleich in der ersten Therapielinie Vorteile gegenüber Epo in den Ansprechraten, der Ansprechdauer sowie im Gesamtüberleben.
-
Imetelstat wurde bisher im Epo-refraktären/-inadäquaten Setting untersucht und hat gutes Ansprechen unter anderem auch bei hoher Transfusionslast gezeigt.
Niedrigrisiko-MDS
Myelodysplastische Syndrome (MDS) sind erworbene klonale Erkrankungen der hämatopoetischen Stammzellen im Knochenmark. Ineffektive Hämatopoese führt zu persistierenden Zytopenien verbunden mit einem erhöhten Risiko der Progression in eine akute myeloische Leukämie.1
Niedrigrisiko-MDS weisen einen geringeren Blastenanteil im Knochenmark, nur milde bis moderate Zytopenien und günstigere zytogenetische Aberrationen auf, verbunden mit längerer mittlerer Überlebensdauer und niedrigerem Progressionsrisiko.
Verschiedene Prognosescores wurden zur Definition von Risikogruppen entwickelt. Lange etabliert und gut verwendbar ist der IPSS-R.2 Der molekulare Daten integrierende IPSS-M stuft viele Patient:innen in höhere Risikokategorien, was weiterer Validierung bedarf.3 Zur Dichotomisierung in Niedrigrisiko vs. Hochrisiko werden oft Score-Kategorien zusammengefasst (z.B. low+int1 vs. int2+high im IPSS bzw. very low/low/moderate low vs. moderate high/high/very high im IPSS-M). Für den IPSS-R kann ein Cut-off bei ≥3,5 Scorepunkten gelegt werden.4
Zur Abschätzung des tatsächlichen Risikos ist die individuelle Verlaufsbeobachtung hilfreich. Bei Niedrigrisiko-MDS ist dies gut möglich, da hier oft initial ein „watchful waiting“ vertretbar ist.5
Wie Niedrigrisiko-MDS behandeln?
Die Therapie bei Niedrigrisiko-MDS zielt primär auf die Erhaltung oder Verbesserung der Lebensqualität und auf die Vermeidung von Komplikationen ab. Wichtig ist ein individuell abgestuftes Vorgehen, das vom abwartenden Beobachten bis hin zu gezielten Medikamenten reicht. Viele Elemente der Therapie sind gut etabliert,5 Neuerungen und Fortschritte gibt es insbesondere auf dem Gebiet der transfusionspflichtigen Anämie.
Bei stabilen Blutbildveränderungen ohne akute Komplikationen ist wie erwähnt „watchful waiting“ gerechtfertigt. „Best supportive care“ ist für viele Patient:innen weiterhin Realität. Ziel moderner Therapieansätze ist es, Abhängigkeit von Supportmassnahmen zu verringern oder diese nicht notwendig werden zu lassen.
Selten steht bei Niedrigrisiko-MDS eine isolierte Thrombozytopenie im Vordergrund: Hier besteht die Option zur „Off-label“-Therapie mit TPO(Thrombopoietin-Rezeptor)-Agonisten.6 Für das hypoplastische MDS ist eine Behandlung mit Antithymozytenglobulin kombiniert mit Ciclosporin möglich – wegen Toxizität allerdings nur für jüngere und fitte Patient:innen.7
Als kurative Option ebenfalls nur für ausgewählte, jüngere Patient:innen steht die allogene Stammzelltransplantation zur Verfügung. Bei Niedrigrisiko-MDS ist die Indikation sehr streng zu stellen:8 Ungünstiger, rascher Verlauf und Verdacht auf Progression sind mögliche Trigger.
Transfusionsbedürftige Anämie bei Niedrigrisiko-MDS
Eine Anämie, die eine regelmäßige Gabe von Erythrozytenkonzentraten erforderlich machen kann, tritt bei Patient:innen mit Niedrigrisiko-MDS häufig auf – bereits zum Zeitpunkt der Diagnose sind etwa 60–66% transfusionsbedürftig. Die Indikation für Transfusionen und deren Häufigkeit von hängen von der individuellen Krankheitsaktivität, von Komorbiditäten und von der klinischen Symptomatik ab.
Transfusionen haben einige potenzielle Nachteile. Bei jeder Einzelgabe besteht das Risiko immunologischer Komplikationen, durch mögliche Alloimmunisierung können sich zukünftige Transfusionen komplizierter gestalten.9 Trotz hoher Sicherheitsstandards bleibt ein minimales Risiko für die Übertragung von Infektionen bestehen.
Die häufigste Komplikation chronischer Transfusion ist die Eisenüberladung: Jede Transfusion bringt zusätzliches Eisen in den Körper, das sich mangels effizienter Ausscheidungsmechanismen in Organen wie Leber, Herz und Bauchspeicheldrüse anreichert. Dies führt langfristig zu Organschäden und erfordert eine begleitende Eisenchelationstherapie.10
Seit Längerem ist bekannt, dass eine hohe Transfusionslast mit einer verkürzten Gesamtüberlebenszeit verbunden sein kann.11 Trotz vieler Analysen ist ungeklärt, welchen Anteil daran Transfusionen per se oder eine mögliche aggressivere Biologie transfusionspflichtiger MDS-Erkrankungen haben. Unabhängig davon können transfusionsvermeidende Therapien einen positiven Effekt zeigen.
Letztendlich ist evident, dass ein Vermeiden von Transfusionen bei gleichzeitigem Erreichen ausreichender (im Gegensatz zur Transfusion auch gleichmäßiger) Hämoglobinwerte die Lebensqualität verbessern kann, sofern dem keine neue Toxizität durch die alternative medikamentöse Therapie entgegensteht.
Wie Transfusionen verhindern?
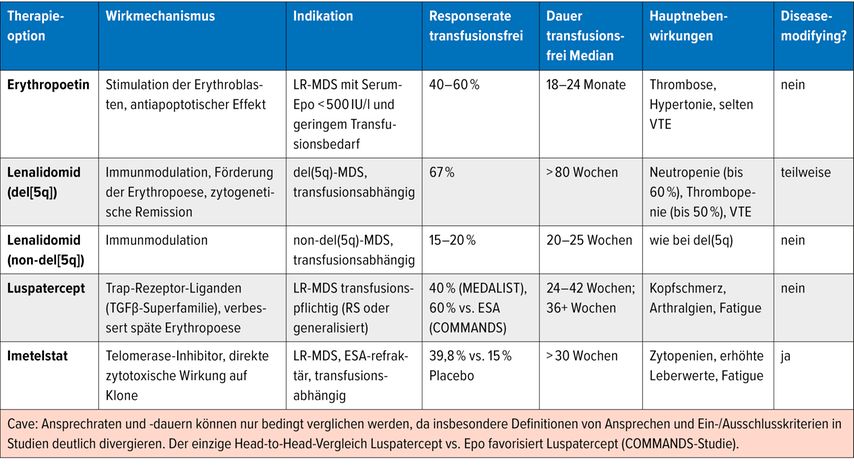
Erythropoetin
Erythropoetin (Epo) ist bei Patient:innen mit Niedrigrisiko-MDS und symptomatischer Anämie eine seit Langem bewährte Therapie, insbesondere wenn die endogenen Epo-Spiegel vor Therapiebeginn unter 500IU/l (optimal unter 200IU/l) liegen und noch kein oder nur geringer Transfusionsbedarf besteht („Nordic Score“).12 Die empfohlene Anfangsdosierung beträgt 30000–40000 IU pro Woche subkutan, eine Dosissteigerung bei unzureichender Hämoglobinantwort ist möglich.
Unter Epo können je nach Stringenz der Anwendung des Nordic Scores bis zu 60% der Patient:innen eine deutliche Hämoglobinsteigerung und Transfusionsfreiheit erreichen, zusätzliche G-CSF-Gabe kann die Ansprechraten noch steigern. Ein erstes Ansprechen ist meist nach 8–12 Wochen zu beobachten, die mediane Dauer des Ansprechens liegt zwischen 18 und 24 Monaten – bei anhaltend gutem Ansprechen ist auch eine mehrjährige Ansprechdauer möglich. Eine engmaschige Kontrolle des Ansprechens sollte zur individuellen Dosisanpassung sowie mittlerweile bei der Verfügbarkeit von Alternativen zu einem frühzeitigen Therapiewechsel führen.
Lenalidomid
Lenalidomid ist für erwachsene Patient:innen mit Niedrigrisiko-MDS, transfusionsabhängiger Anämie und isolierter del(5q)-Zytogenetik zugelassen. In klinischen Studien erzielten etwa 67% der Patient:innen komplette Transfusionsfreiheit, 76% reduzierten den Transfusionsbedarf um mindestens 50% und rund 73% zeigten ein zytogenetisches Ansprechen.13 Letzteres geht mit einer medianen Dauer der Transfusionsunabhängigkeit von über 80 Wochen einher. Lenalidomid-Responder profitieren zusätzlich von einer deutlich verlängerten Gesamtüberlebenszeit (mediane OS-Zeiten von etwa 60–80 Monaten).
Die häufigsten dosislimitierenden Toxizitäten sind Grad-3/4-Neutropenien (bis zu 60%) und Thrombozytopenien (bis zu 50%), nichthämatologische Nebenwirkungen sind Hautausschläge, Fatigue, Diarrhö sowie ein erhöhtes Risiko für venöse Thromboembolien; in der Regel lassen sie sich durch vorübergehende Dosisunterbrechungen oder -reduktionen kontrollieren.
Bei Patient:innen ohne del(5q) erzielt Lenalidomid erythroide Ansprechraten von etwa 40–45%, mit vollständiger Transfusionsfreiheit in rund 15–20% und einer medianen Ansprechdauer von etwa 20–25 Wochen.14 Bei Abwägung von Nutzen gegenüber möglicher Toxizität wurde keine Zulassung in dieser Indikation erreicht.
Luspatercept
Luspatercept steigert die Erythropoese durch Hemmung des TGfβ-vermittelten Signalings und wurde 2023 in Europa für Patient:innen mit transfusionsabhängiger Anämie bei Niedrigrisiko-MDS mit Ringsideroblasten (RS) zugelassen, die auf eine Erythropoetin-basierte Therapie nicht ausreichend angesprochen haben oder für diese nicht geeignet sind. 2024 erfolgte die Zulassungserweiterung unabhängig von RS und Epo-Status als Erstlinientherapie. Grundlage der Zulassung waren zwei wesentliche Studien: MEDALIST und COMMANDS.
MEDALIST
In der placebokontrollierten Phase-III-Studie MEDALIST erreichten etwa 40% der mit Luspatercept behandelten Patient:innen (ausschließlich mit SF3B1-Mutation oder Ringsideroblasten, eporefraktär oder nicht eligibel) eine ≥8 Wochen andauernde Transfusionsfreiheit, die mediane Dauer der Transfusionsfreiheit betrug zwischen 24 und 42 Wochen. Zu den häufigsten Nebenwirkungen zählen Kopfschmerzen, Arthralgien, Knochenschmerzen, Fatigue, Husten, Bauchschmerzen, Diarrhö und Schwindel (überwiegend Grad 1/2).15
COMMANDS
In der folgenden randomisierten Phase-III-Studie COMMANDS wurden 363 ESA(Erythropoese-stimulierende Substanzen)-naive Patient:innen (Allcomers) mit transfusionspflichtiger Anämie und einem Serum-Erythropoetinspiegel <500U/l über mindestens 24 Wochen mit Luspatercept vs. Epoetin alfa behandelt. Nach einem medianen Follow-up von rund 17 Monaten erreichten 60% der mit Luspatercept behandelten Patient:innen den kombinierten primären Endpunkt aus Transfusionsunabhängigkeit und Hämoglobinanstieg, gegenüber 35% unter Epoetin alfa. Zudem erreichten 64% in der Luspatercept-Gruppe (42% unter Epo) eine Transfusionfreiheit von mindestens 24 Wochen.16
In Post-hoc-Analysen der COMMANDS-Studie war der Vorteil von Luspatercept in allen untersuchten Subgruppen (IPSS-R, Epo-Spiegel, Transfusionsbedarf, Ringsideroblasten/SF3B1-Mutationsstatus) konsistent und über einen Beobachtungszeitraum von bis zu 24 Monaten erhalten. Die mediane Dauer der Transfusionsunabhängigkeit lag in allen Subgruppen bei mehr als 36 Wochen, das Sicherheitsprofil zeigte keine neuen Langzeitsignale.17 Mit Luspatercept können mehr Patient:innen die Vorteile einer Langzeittransfusionsunabhängigkeit erreichen (1,5 Jahre transfusionsfrei: 30,2% vs. 13,8%), die kumulative Dauer aller Responseepisoden war signifikant länger (154,7 Wochen vs. 91,1 Wochen).18
Luspatercept wird alle drei Wochen subkutan injiziert, üblicherweise mit einer Anfangsdosis von 1mg/kg, die bei unzureichender Hämoglobinantwort schrittweise auf bis zu 1,75mg/kg erhöht werden kann. Die Responsedauer ist bei Erreichen eines Hb ≥10g/dl deutlich länger (199 vs. 27 Wochen), was für die Rolle der Dosiseskalation spricht.19 Studien untersuchen bereits initial höhere Luspatercept-Dosen.20
Luspatercept-Responder profitieren auch von einem Vorteil im Gesamtüberleben. Im Vergleich mit Epoetin alfa ist neben der statistisch signifikant längeren Ansprechdauer ein positiver OS-Trend über alle Untergruppen hinweg konsistent zu sehen (4,5 Jahre OS mit Luspatercept: 58,9% vs. 41,8%).21
Imetelstat
Imetelstat ist ein Telomerase-Inhibitor, der kompetitiv an die RNA-Komponente (hTR) der Telomerase bindet und so die Telomerverlängerung in malignen Vorläuferzellen hemmt. Als erstes Medikament seiner Klasse erhielt Imetelstat 2024 die FDA-Zulassung und 2025 eine bedingte EMA-Zulassung für erwachsene Patient:innen mit transfusionspflichtiger Anämie infolge von Nicht-del(5q)-Niedrigrisiko-MDS, die auf eine ESA-basierte Therapie nicht ausreichend ansprechen oder für diese nicht infrage kommen.
IMerge
In der randomisierten Phase-III-Studie IMerge erreichten 39,8% der Imetelstat-Behandelten eine ≥8-wöchige Transfusionsunabhängigkeit gegenüber 15% in der Placebo-Gruppe, die mediane Dauer der Transfusionsfreiheit lag bei über 30 Wochen.22
Verabreicht wird Imetelstat als intravenöse Infusion alle vier Wochen; eine Prämedikation und regelmäßige Blutbild- sowie Leberfunktionstests sind notwendig. Sehr häufig beobachtete Nebenwirkungen sind Grad-3–4-Zytopenien (transient), erhöhte Leberwerte, Fatigue und Kopfschmerzen, die sich meist durch Dosisanpassungen kontrollieren lassen.
Ein möglicher Vorteil von Imetelstat gegenüber Luspatercept könnte stark transfusionsabhängige Patient:innen betreffen. Diesbezüglich sind weitere Studien abzuwarten. Es muss abschließend vermerkt werden, dass trotz Zulassung in Europa derzeit der Zugang zur Substanz eingeschränkt ist.
Mögliche Algorithmen zur Therapieentscheidung
Bei der Wahl des therapeutischen Agens ist zunächst die Zulassung zu bedenken: Abgesehen von Epo (für symptomatische Anämie mit Hb ≤10g/dl) ist in allen Fällen ein Transfusionsbedarf für den Therapiebeginn erforderlich. Zur weiteren Auswahl sollte aufgrund der herausragenden Ergebnisse bei MDS mit isolierter del(5q)-Deletion Lenalidomid zur Anwendung kommen. Für alle anderen Entitäten bietet sich Epo (falls Response erwartbar nach Nordic Score) oder belegt durch die Daten der COMMANDS-Studie Luspatercept als Erstlinientherapie an.
Die Ergebnisse der COMMANDS-Studie favorisieren Luspatercept in allen Subgruppen, eine mögliche Differenzierung könnte nach Epo-Spiegel und Transfusionsbedarf erfolgen. Allerdings haben viele noch nicht transfusionbedürftige Patient:innen bereits Epo erhalten, sodass Luspatercept ohnehin in Zweitlinientherapie eingesetzt wird. Imetelstat wäre demnach eine vielversprechende Zweit- bzw Drittlinienoption.
In den aktuellen Onkopedia-Leitlinien23 von 2/2024 sind die aktuellen Studiendaten noch nicht abgebildet, das Update ist für 2026 geplant. Eine mögliche Vorgangsweise modifiziert nach einem italienischen Vorschlagzeigt Abbildung 1.24
Abb. 1: Vorschlag für einen therapeutischen Algorithmus bei Anämie bei Nicht-del(5q)-Niedrigrisiko-MDS (modfiziert nach Santini V & Consagra A)24
Ausblick
Die bisher erreichten Erfolge beflügeln weitere Studien: Neue Substanzen mit völlig anderen Ansatzpunkten sind derzeit in klinischer Erprobung, Kombinationstherapien werden untersucht, um Synergien auszuloten. Nicht zuletzt wird untersucht, ob eine frühzeitige Behandlung der MDS-assoziierten Anämie bereits vor Beginn einer Transfusionsabhängigkeit bessere (Langzeit-)Ergebnisse erbringen kann.
Fazit
Die Vermeidung von Bluttransfusionen bei Niedrigrisiko-MDS ist möglich – durch gezielte Therapien, moderne Strategien und eine enge Zusammenarbeit zwischen Ärzt:innen und Patient:innen. Eine Verbesserung der Lebensqualität ist ein definitiver Vorteil, eine Verlängerung des Gesamtüberlebens scheint möglich. Patient:innen, die für etablierte Therapien nicht infrage kommen oder deren Erkrankung trotz Therapie voranschreitet, sollten möglichst in klinische Studien eingeschlossen werden, um Zugang zu innovativen Substanzen zu erhalten.
Literatur:
1 Cazzola M: Myelodysplastic syndromes. N Engl J Med 2020; 383(14): 1358-74 2 Greenberg PL et al.: Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120(12): 2454-65 3 Bernard E et al.: Molecular international prognostic scoring system for myelodysplastic syndromes. NEJM Evidence 2022; 1(7): EVIDoa2200008 4 Pfeilstöcker M et al.: Time-dependent changes in mortality and transformation risk in MDS. Blood 2016; 128(7): 902-10 5 Fenaux P, Adès L: How we treat lower-risk myelodysplastic syndromes. Blood 2013; 121(21): 4280-6 6 Oliva EN et al.: Eltrombopag vs. placebo for low-risk myelodysplastic syndromes with thrombocytopenia (EQoL-MDS): phase 1 results of a single-blind, randomised, controlled, phase 2 superiority trial. Lancet Haematol 2017; 4: e127-36 7 Passweg JR et al.: Immunosuppressive therapy for patients with myelodysplastic syndrome: a prospective randomized multicenter phase III trial comparing antithymocyte globulin plus cyclosporine with best supportive care – SAKK 33/99. J Clin Oncol 2011; 29: 303-9 8 Rathje K, Kröger N: Optimal timing of allogeneic hematopoietic stem cell transplant in MDS. Leuk Lymphoma 2025; 66(10): 1788-800 9 Bryant BJ et al.: Ascertainment of iron deficiency and depletion in blood donors through screening questions for pica and restless legs syndrome. Transfusion 2013; 53(11): 2683-91 10 Gattermann N: Iron overload in myelodysplastic syndromes (MDS). Int J Hematol 2018; 107(1): 55-63 11 Malcovati L et al.: Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based prognostic scoring system (WPSS). Haematologica 2011; 96: 1433-40 12 Hellström-Lindberg E et al.: A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony-stimulating factor: significant effects on quality of life. Br J Haematol 2003; 120: 1037-46 13 List AF et al.: Efficacy of lenalidomide in myelodysplastic syndromes. N Engl J Med 2005; 352(6): 549-57 14 Park S et al.: Outcome of lower-risk patients with myelodysplastic syndromes without 5q deletion after failure of erythropoiesis-stimulating agents. Clin Oncol 2017; 35(14): 1591-7 15 Fenaux P et al.: Luspatercept in patients with lower-risk myelodysplastic syndromes. NEngl J Med 2020; 382(2): 140-51 16 Della Porta MG et al.: Luspatercept vs. epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): primary analysis of a phase 3, open-label, randomised, controlled trial. Lancet Haematol 2024; 11(9): e646-58 17 Garcia-Manero G et al.: Efficacy and safety of luspatercept vs. epoetin alfa in erythropoiesis-stimulating agent (ESA)-naive patients with transfusion-dependent lower-risk myelodysplastic syndromes (LR-MDS): full analysis of the COMMANDS trial. ASH 2023; Abstr. #193 18 Garcia-Manero G et al.: Long-term response analysis of transfusion independence in erythropoiesis stimulating agent–naive patients with very low-, low-, or intermediate-risk myelodysplastic syndromes treated with luspatercept vs epoetin alfa in the COMMANDS trial. ASH 2024; Abstr. #350 19 Santini V et al.: Clinical benefits of achieving hemoglobin (Hb) levels ≥10 g/dL in transfusion-dependent (TD) erythropoiesis-stimulating agent (ESA)-naive patients (pts) with lower-risk (LR) myelodysplastic syndromes (MDS) treated with luspatercept in the COMMANDS trial. ASH 2024; Abstr. #1818 20 DellaPorta G et al.: EHA 2025, Abstr. #PF634 21 Santini V et al.: Overall survival and duration of transfusion independence for first-line esa-naive patients with lower-risk myelodysplastic syndromes treated with luspatercept vs epoetin alfa in the COMMANDS trial. EHA 2025; Abstr. #S177 22 Platzbecker U et al.: Imetelstat in patients with lower risk myelodysplastic syndrome who have relapsed or are refractory to erythropoiesis-stimulating agents (IMerge): a multinational, randomised, double blind, placebo controlled, phase 3 trial. Lancet 2024; 403: 249-60 23 Hofmann WK et al.: Myelodysplastische Neoplasien (Myelodysplastische Syndrome, MDS). Onkopedia-Leitlinie 2024. Online unter www.onkopedia.com 24 Santini V, Consagra A: How to use luspatercept and erythropoiesis-stimulating agents in low-risk myelodysplastic syndrome. Br J Haematol 2025; 207(1): 15-26
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...
-Niedrigrisiko-MDS.jpg)


