Update zum Magenkarzinom
Autoren:
Prim. Univ.-Prof. Dr. Ewald Wöll
a.ö. Krankenhaus St. Vinzenz Betriebs GmbH
Abteilung für Innere Medizin, Zams
OÄ Dr. Bettina Sonnweber
E-Mail: bettina.sonnweber@krankenhaus-zams.at
Korrespondenz:
E-Mail: e.woell@krankenhaus-zams.at
Die therapeutischen Optionen beim Magenkarzinom haben sich in den letzten Jahren deutlich gebessert. Zahlreiche Studien, sowohl für die kurative als auch die palliative Situation, zu Therapien mit mitunter neuen molekularen Angriffspunkten zeigen vielversprechende Ergebnisse und werden den bisherigen Standard teilweise ändern.
Keypoints
-
Beim operablen Magenkarzinom ist die perioperative Chemotherapie Standard.
-
Für Adenokarzinome des distalen Ösophagus und GEJ zeigt Nivolumab als adjuvante Therapie nach kombinierter Radio-/Chemotherapie und Operation bei fehlender pCR eine Verlängerung des DFS.
-
Bei lokal fortgeschrittenem inoperablem oder metastasiertem Magenkarzinom/Adenokarzinom des GEJ ist eine HER2-Testung obligat.
-
HER2+ Patienten mit lokal fortgeschrittenem inoperablem oder metastasiertem Magenkarzinom/Adenokarzinom des GEJ erhalten zusätzlich zur Chemotherapie Trastuzumab.
-
In späterer Therapielinie zeigt Trastuzumab-Deruxtecan bei HER2-positiven Patienten erste vielversprechende Ergebnisse.
-
In der Erstlinie bei HER2-negativen Patienten mit einem CPS ≥5 erreicht Nivolumab plus Chemotherapie einen OS-Vorteil.
-
Ramucirumab zeigte in der Zweitlinie eine Verbesserung des Gesamtüberlebens. Ramucirumab und Paclitaxel ergaben bisher die besten Daten in dieser Therapielinie.
-
In der Drittlinie ist Trifluridin/Tipiracil bei Patienten mit gutem Allgemeinzustand Standard. Immuncheckpoint-Inhibitoren sind noch nicht zugelassen, aber in späteren Linien bei selektionierten Patienten zu erwägen.
Kurative Therapie
Aufgrund der hohen Rezidiv-Wahrscheinlichkeit von bis zu 75% nach einer Operation reicht eine alleinige operative Therapie für die kurative Behandlung bei den meisten Patienten nicht aus. Die perioperative Chemotherapie ist seit der MAGIC-Studie das Standardvorgehen bei Kaukasiern.1 In der Phase-III-Studie FLOT 4 konnte gezeigt werden, dass vier Gaben FLOT (5-Fluorouracil/Leucovorin/Oxaliplatin/Docetaxel) im Abstand von 14 Tagen, gefolgt von Operation, gefolgt von vier weiteren Gaben von FLOT postoperativ dem bisherigen Standard ECF bzw. ECX (Epirubicin, Cisplatin, Fluorouracil bzw. Capecitabin) deutlich überlegen ist.2 FLOT ist daher der neue Standard in der perioperativen Chemotherapie des Magenkarzinoms und der Karzinome des gastroösophagealen Übergangs (GEJ).
Für Patienten mit GEJ-Tumoren und Karzinomen des Ösophagus steht darüber hinaus das Konzept einer präoperativen Radiochemotherapie nach der CROSS-Studie zur Verfügung.3 Der Stellenwert der Strahlen-/Chemotherapie beim Magenkarzinom wird jedoch erst durch die laufenden Studien (TOPGEAR, ARTIST 2 und CRITICS 2) geklärt werden.4–6
Bezüglich des Einsatzes von Biologika in der perioperativen Therapie gibt es derzeit keine positive Datenlage. In der MAGIC-B-Studie konnte durch Zugabe von Bevacizumab zu ECX kein Vorteil erreicht werden.7 Bezüglich Ramucirumab als Zugabe zu FLOT liegen derzeit lediglich Phase-II-Ergebnisse der RAMSES-Studie mit einer höheren R0-Resektionsrate vor.8 Auch bei HER2-positiven Patienten haben wir im kurativen Setting nur Phase-II-Daten. Trastuzumab in Kombination mit Pertuzumab wurde in der PETRARCA-Studie untersucht und konnte eine Verdreifachung der pathologischen Komplettremissionsrate (pCR) zeigen.9 Die Ergebnisse der INNOVATION-Studie müssen noch abgewartet werden, um mehr Klarheit bezüglich einer HER2-gerichteten, kurativen Therapie zu erhalten.10
Zur Immuntherapie im kurativen Setting des Magenkarzinoms gibt es laufende Studien. Die KEYNOTE-585-Studie (Phase III) vergleicht perioperative Chemotherapie plus Placebo versus perioperative Chemotherapie plus Pembrolizumab. Erste Ergebnisse werden 2023 erwartet. Im ICONIC Trial (Phase II) wird FLOT in Kombination mit Avelumab untersucht. Mit Spannung erwartet werden auch die Ergebnisse der VESTIGE-Studie (Phase II, European Organisation for Research and Treatment of Cancer), welche die alleinige Immuntherapie mit Nivolumab plus Ipilimumab nach präoperativer Chemotherapie und Operation versus postoperative Chemotherapie vergleicht.
Auch für den perioperativen Einsatz von Atezolizumab ist eine interessante Phase-II-Studie (DANTE) im Gang, welche die alleinige Therapie mit FLOT mit FLOT plus Atezolizumab vergleicht. Vor allem die Analysen von Patienten mit hoher Mikrosatelliteninstabilität (MSI) und niedriger MSI bzw. stabilen Patienten bringen uns hier möglicherweise weitere Daten zur Selektion der Patienten für eine Immuntherapie beim Magenkarzinom. Kleinere Post-hoc-Analysen zeigen konsistent, dass eine hohe MSI beim Magenkarzinom ein prognostisch günstiger Biomarker zu sein scheint. Der Stellenwert der Chemotherapie beiTumoren mit hoher MSI konnte beim Magenkarzinom jedoch noch nicht eindeutig geklärt werden. Möglicherweise kann aufgrund der sehr günstigen Prognose in einer individuellen Tumorboard-Entscheidung bei Patienten mit Tumoren mit hoher MSI und in einem frühen Stadium auf eine perioperative Chemotherapie verzichtet werden. Bisher konnte beim operablen Magenkarzinom jedoch noch für keinen histologischen oder molekulargenetischen Subtyp (Siegelringkarzinom, HER2-positives Magenkarzinom, hohe MSI, „combined positive score“ [CPS]) ein Vorteil für eine vom derzeitigen Standard abweichende Therapie gezeigt werden.
Eine Ausnahme stellen die Plattenepithelkarzinome des Ösophagus und die Adenokarzinome des distalen Ösophagus und oberen GEJ (Siewert I) nach einer kombinierten Radiochemotherapie und Operation dar, wenn keine pCR erreicht wurde. Erste positive Phase-III-Daten bezüglich einer adjuvanten Immuntherapie mit Nivolumab (für ein Jahr) liegen für die CheckMate-577-Studie vor.11 Die derzeit vorliegenden Daten sind beeindruckend mit einem krankheitsfreien Überleben (DFS) von 11 vs. 22,4 Monate im Nivolumab-Arm. Der Beobachtungszeitraum ist jedoch noch sehr kurz und Daten für das Gesamtüberleben (OS) fehlen.
Palliative Therapie
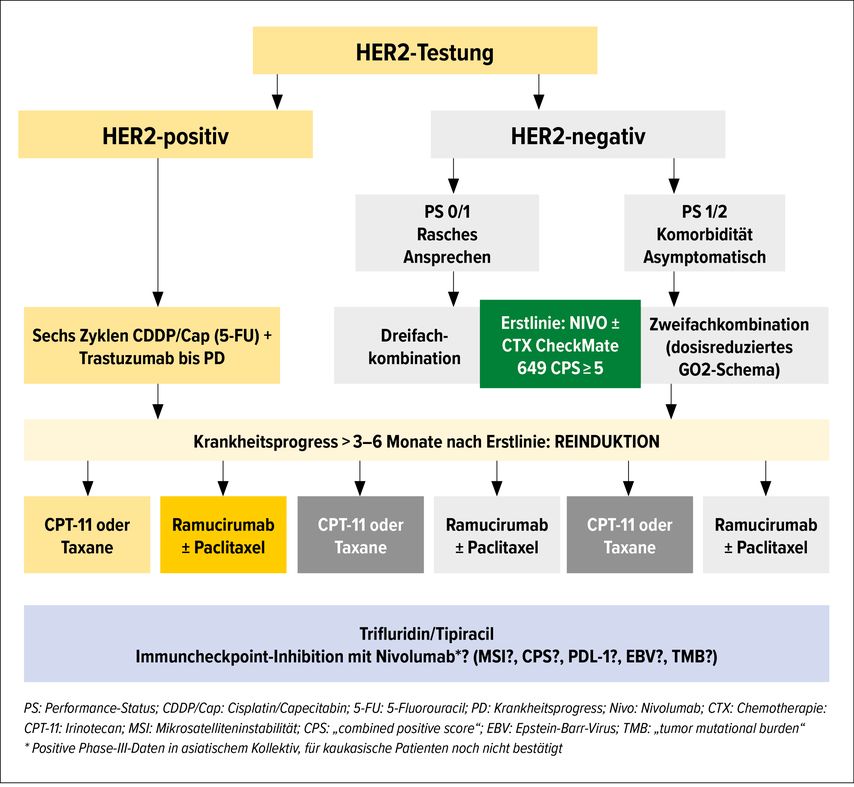
Für Patienten mit einem fortgeschrittenen inoperablen oder metastasierten Magenkarzinom ist vor der Therapieentscheidung eine qualitätszertifizierte HER2-Testung obligat. Die Therapieentscheidung erfolgt nach HER2-Status, Allgemeinzustand der Patienten, Tumorsymptomatik und vorangegangener Therapie sowie in Abhängigkeit vom CPS, vorbehaltlich einer EMA(European Medicines Agency)-Zulassung für Nivolumab (Abb. 1).
HER2-negatives Magenkarzinom
Dieses Kollektiv macht in Europa in etwa 85% der Magenkarzinompatienten aus. In der Erstlinie wird für die meisten Patienten eine Kombinationschemotherapie aus Fluoropyrimidinen (5-Fluorouracil oder orales Prodrug) und Cisplatin oder Oxaliplatin eingesetzt. Für einzelne Patienten, die in einem sehr guten Allgemeinzustand sind und ein sehr rasches Tumoransprechen benötigen, kann hier auch eine Dreifachkombination eingesetzt werden (z.B. FLOT).
Vermutlich wird die Phase-III-Studie CheckMate 649, anhand der bisher vorliegenden Daten zumindest für CPS-≥5-Tumoren, eine neue Standard-Erstlinientherapie festlegen.12 Der Prüfarm mit Nivolumab plus Chemotherapie erreichte gegenüber der alleinigen Chemotherapie (XELOX [Capecitabin, Oxaliplatin] oder FOLFOX [5-Fluorouracil/Leucovorin/Oxaliplatin]) eine Verlängerung des medianen OS von 11,1 auf 14,4 Monate.
In der Phase-III-Studie KEYNOTE 590 konnten bei Adenokarzinomen und Plattenepithelkarzinomen positive Effekte gezeigt werden.13 Besonders deutlich wird der OS-Vorteil bei Plattenepithelkarzinomen des Ösophagus und des gastroösophagealen Übergangs (Siewert I) mit einem CPS ≥10. Hier wurde eine Verbesserung des Gesamtüberlebens durch die Kombination von Pembrolizumab mit Chemotherapie versus Chemotherapie alleine (12,4 versus 9,8 Monate) gezeigt.
Für Patienten, die auf eine Erstlinientherapie ansprechen, anschließend progredient werden und nach wie vor in einem guten Allgemeinzustand sind, ist eine Zweitlinien-Chemotherapie etabliert. In der RAINBOW-Studie konnte gezeigt werden, dass die Zugabe von Ramucirumab, einem monoklonalen Antikörper gegen den Rezeptor des vaskulären endothelialen Wachstumsfaktors (VEGFR), zur Zweitlinientherapie mit Paclitaxel zu einer Verlängerung des OS um weitere 2,3 Monate führte.14 Die Kombination aus Paclitaxel und Ramucirumab zeigt mit einem OS von 9,73 Monaten in der zweiten Therapielinie die besten Ergebnisse und stellt somit derzeit für Patienten ohne Kontraindikation den Standard in der Zweitlinie dar. Auch für eine Zweitlinien-Monochemotherapie mit Irinotecan, Taxanen oder Ramucirumab konnte eine klinisch relevante Verlängerung des OS gezeigt werden.
HER2-positives Magenkarzinom
Etwa 15% der Patienten zeigen eine Überexpression von HER2. Für diese Patienten konnte in der ToGA-Studie gezeigt werden, dass die Zugabe von Trastuzumab zu einer Chemotherapie mit 5-Fluorouracil oder Capecitabin und Cisplatin in der exploratorischen Analyse der HER2-IHC-3+ Patienten oder der HER2-IHC-2+ und FISH-positiven Patienten zu einer Verlängerung des medianen OS von 11,8 Monaten im Kontrollarm auf 16,0 Monate im experimentellen Arm führt.15 Diese Therapie ist daher der Standard für HER2-positive Patienten mit inoperablem oder lokal fortgeschrittenem Magenkarzinom.
Leider konnte sowohl die Zugabe von Pertuzumab in der JACOB-Studie16 als auch der Einsatz von Lapatinib17 keinen Vorteil in der Erstlinientherapie zeigen. Die Zweitlinientherapie HER2-positive Patienten betreffend, sind die Daten bezüglich HER2-gerichteter Therapie bisher ebenfalls negativ. Sowohl der Einsatz des Chemoimmunkonjugats T-DM1 (Trastuzumab-Emtansin) in der GATSBY-Studie18 als auch der Einsatz von Lapatinib in der TyTAN-Studie19 konnten keinen Vorteil zeigen. Ebenfalls wurden für die Gabe von Trastuzumab über den Progress hinaus in der T-ACT-Studie negative Daten publiziert.20 Eine mögliche Erklärung hierfür könnte die Selektion eines HER2-negativen Klons durch die vorangegangene Trastuzumab-Therapie sein. Aus diesem Grund gelten für die Zweitlinientherapie dieselben Empfehlungen für alle Patienten mit HER2-positivem und auch HER2-negativem Magenkarzinom.
Dies könnte jedoch durch die DESTINY-Gastric-01-Studie (Phase II, Japan und Korea) geändert werden. Die Studie vergleicht in späteren Therapielinien nach Vorbehandlung mit Trastuzumab das Chemoimmunkonjugat Trastuzumab-Deruxtecan (humanisierter HER2-IgG1-monoklonaler Antikörper plus Topoisomerase-I-Inhibitor) mit Paclitaxel oder Irinotecan und zeigt eine vielversprechende Verlängerung des medianen OS von 8,4 auf 12,5 Monate.
Auch für das HER2-positive Magenkarzinom laufen derzeit Studien in Kombination mit der Immuntherapie.21,22
Drittlinientherapie
Patienten, die nach der zweiten Therapielinie progredient sind und einen guten Allgemeinzustand haben, steht eine Drittlinientherapie zur Verfügung. In der TAGS-Studie konnte durch Einsatz des oralen Prodrugs Trifluridin/Tipiracil (Lonsurf®) bei 507 Patienten gegenüber Placebo eine Verlängerung des OS von median 3,6 Monaten auf 5,7 Monate gezeigt werden.23 Diese orale Therapie ist Standard für Patienten mit gutem Allgemeinzustand in einer späteren Therapielinie beim Magenkarzinom.
Für asiatische Patienten liegen auch Phase-III-Ergebnisse für den Einsatz des Immuncheckpoint-Inhibitors Nivolumab in der Letztlinie vor. In der ATTRACTION-2-Studie wurde bei Patienten mit gutem Performance-Status, die zum Großteil mehr als drei Vortherapien erhalten hatten, mit Nivolumab eine deutliche Verlängerung des OS erreicht (HR: 0,63; p<0,0001). Die 12-Monats-Überlebensrate konnte von 10,9% auf 26,6% mehr als verdoppelt werden. Dabei zeigte sich, wie bei Immuntherapien häufig, dass jene Patienten, die ansprachen, lange Zeit progressfrei blieben. Für kaukasische Patienten sind diese Ergebnisse bisher noch nicht bestätigt. Von besonderer Bedeutung ist hier jedoch die Patientenselektion. Patienten, die mikrosatelliteninstabile Magenkarzinome haben und jene mit einem EBV(Epstein-Barr-Virus)-assoziierten Magenkarzinom sowie Patienten mit einem hohen CPS scheinen diejenigen Patienten zu sein, die besonders von einer Immuncheckpoint-Inhibitor-Therapie profitieren.24
Literatur:
1 Cunningham D et al.: Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355(1): 11-20 2 Al-Batran SE et al.: Perioperative chemotherapy with docetaxel, oxaliplatin, and fluorouracil/leucovorin (FLOT) versus epirubicin, cisplatin, and fluorouracil or capecitabine (ECF/ECX) for resectable gastric or gastroesophageal junction (GEJ) adenocarcinoma (FLOT4-AIO): a multicenter, randomized phase 3 trial. J Clin Oncol 2017; 35: 15_suppl: 4004 3 Van Hagen P et al.; CROSS Group: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012; 366(22): 2074-84 4 Leong T et al.: TOPGEAR: a randomized, phase III trial of perioperative ECF chemotherapy with or without preoperative chemoradiation for resectable gastric cancer: interim results from an International, Intergroup Trial of the AGITG, TROG, EORTC and CCTG. Ann Surg Oncol 2017; 24(8): 2252-8 5 Park SH et al.: Multicenter phase III trial of adjuvant chemoradiotherapy in stomach tumors 2 (ARTIST 2). J Clin Oncol 2015; 33: 3_suppl, TPS228 6 Slagter AE et al.: CRITICS-II: a multicentre randomised phase II trial of neo-adjuvant chemotherapy followed by surgery versus neo-adjuvant chemotherapy and subsequent chemoradiotherapy followed by surgery versus neo-adjuvant chemoradiotherapy followed by surgery in resectable gastric cancer. BMC Cancer 2018; 18(1): 877 7 Cunningham D et al.: Peri-operative chemotherapy with or without bevacizumab in operable oesophagogastric adenocarcinoma (UK Medical Research Council ST03): primary analysis results of a multicentre, open-label, randomised phase 2-3 trial. Lancet Oncol 2017; 18(3): 357-70 8 Al-Batran SE: FLOT vs. FLOT/ramucirumab for perioperative therapy of gastric or GEJ cancer (RAMSES) (RAMSES/FLOT7). Online unter: https://clinicaltrials.gov/ct2/show/NCT02661971 9 Al-Batran SE: FLOT vs. FLOT/herceptin/pertuzumab for perioperative therapy of HER-2 expressing gastric or GEJ cancer (PETRARCA). Online unter: https://clinicaltrials.gov/ct2/show/NCT02581462 10 Wagner AD: Neoadjuvant study using trastuzumab or trastuzumab with pertuzumab in gastric or gastroesophageal junction adenocarcinoma (INNOVATION). Online unter: https://clinicaltrials.gov/ct2/show/NCT02205047 11 Kelly RJ et al.: CheckMate 577 Investigators. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med 2021; 384(13): 1191-203 12 Moehler M et al.: Nivolumab (nivo) plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer (GC/GEJC)/esophageal adenocarcinoma (EAC): first results of the CheckMate 649 study. Annals of Oncology 2020; 31(suppl_4): S1142-215 13 Kato K et al.: Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: The phase 3 KEYNOTE-590 study. Annals of Oncology 2020; 31(suppl_4): S1192-3 14 Wilke H et al.: Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): adouble-blind, randomised phase 3 trial. Lancet Oncol 2014; 15(11): 1224-35 15 Bang YJ et al.: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastrooesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687-97 16 Tabernero J et al.: Pertuzumab plus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of double-blind, randomised, placebo-controlled phase 3 study. Lancet Oncol 2018; 19(10): 1372-84 17 Hecht JR et al.: Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric, esophageal or gastroesophageal adenocarcinoma: TRIO-013/LOGiC--a randomized phase III trial. J Clin Oncol 2016; 34(5): 443-51 18 Thuss-Patience PC et al.: Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol 2017; 18(5): 640-53 19 Satoh T et al.: Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN--a randomized, phase III study. J Clin Oncol 2014; 32(19): 2039-49 20 Esaki T et al.: T-ACT (WJOG7112G): a randomized phase II study of weekly paclitaxel ± trastuzumab in patients with HER2-positive advanced gastric or gastro-esophageal junction cancer refractory to trastuzumab combined with fluoropyrimidine and platinum. J Clin Oncol 2017; 35: 4_suppl, TPS218 21 Janjigian YY et al.: First-line pembrolizumab and trastuzumab in HER2-positive oesophageal, gastric, or gastro-oesophageal junction cancer: an open-label, single-arm, phase 2 trial. Lancet Oncol 2020; 21(6): 821-31 22 Cantenacci DV et al.: Margetuximab plus pembrolizumab in patients with previously treated, HER2-positive gastro-oesophageal adenocarcinoma (CP-MGAH22–05): a single-arm, phase 1b–2 trial. Lancet Oncol 2020; 21(8): 1066-76 23 Shitara K et al.: Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2018; 19(11): 1437-48 24 Kim ST et al.: Comprehensive molecular characterization of clinical responses to PD-1 inhibition in metastatic gastric cancer. Nat Med 2018; 24(9): 1449-58 25 Wöll E et al.: Treatment algorithm for patients with gastric adenocarcinoma: an Austrian consensus on systemic therapy. Anticancer Res 2019; 39(9): 4589-96.
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...