Genau hingeschaut: Tumoren der Haut
Bericht:
Dr. Corina Ringsell
Bei „Hautkrebs“ denken viele zuerst an das maligne Melanom. Die Referent:innen des CCC Vienna Cancer Updates zeigten neben häufigen Hauttumoren auch seltene Entitäten auf und erläuterten, welche Fortschritte es bei der Diagnostik und Therapie von seltenen und häufigen Hautkrebsformen gibt. Durch die Veranstaltung führten Ao.Univ.-Prof. Christoph Höller und Univ.-Prof. Joachim Widder.
Neue Technologien verbessern die Früherkennung
Wie bei allen anderen Entitäten ist auch bei Hauttumoren die Früherkennung entscheidend für den Krankheitsverlauf. Der Goldstandard ist die Dermatoskopie.1,2
Dr. Christoph Müller, PhD, Universitätsklinik für Dermatologie, MedUni Wien/AKH Wien, stellte neue Technologien vor, die dabei helfen sollen, die Früherkennung von Hauttumoren zu verbessern. Dazu zählt die 3D-Ganzkörperfotografie, bei der 92 Kameras mit der Möglichkeit der Kreuzpolarisierung Aufnahmen von etwa 95% der Körperoberfläche mit Ausnahme der Fußsohlen und der behaarten Haut machen (Abb. 1). Ein Computerprogramm erstellt daraus einen Avatar der Person, auf dem verdächtige Läsionen auch markiert werden können. Wird das Verfahren nach einer gewissen Zeit wiederholt, dann dient der alte Avatar als Vergleich, ob und wie die markierten Läsionen sich verändert haben. Zum Stellen einer Diagnose sei die Ganzkörperfotografie nicht geeignet, sagte Müller. Daher habe sie in der Leitlinie auch nur eine B2b-Empfehlung zur Untersuchung von Risikopatient:innen (z.B. mit genetischem Risiko, Melanomvorgeschichte oder vielen Muttermalen) bekommen.1
Die Fortentwicklung künstlicher Intelligenz (KI) könne Ärzte bei der Auswertung dermatoskopischer oder Ganzkörperbilder unterstützen, sei aber kein Ersatz für die ärztliche Expertise, erklärte Müller. Zwar seien KI-gestützte Systeme in Studien bei der Auswertung dermatoskopischer Aufnahmen den menschlichen Untersucher:innen überlegen gewesen, hätten aber ihre Grenzen, sobald es sich um ungewöhnliche Hautveränderungen handelte.3 Auch die KI-basierten Anwendungen, mit denen Patient:innen Handyfotos mittels spezieller Apps begutachten lassen können, seien kein Ersatz für die ärztliche Untersuchung, betonte Müller.
Auch für die Therapie relevant: genetische Analyse
Eine besondere Rolle in der Diagnostik von Hauttumoren spielt die molekularpathologische und genetische Analyse, da hieraus auch Therapieoptionen abgeleitet werden können. Einen Einblick in die genetische Analyse von Hauttumoren gab Univ.-Prof. Leonhard Müllauer, Klinisches Institut für Pathologie, MedUni Wien/AKH Wien. Der häufigste Hauttumor, der einer genetischen Analyse unterzogen werde, sei das maligne Melanom, gefolgt vom Dermatofibrosarcoma protuberans und vom kutanen Lymphom, sagte er.
Das Melanom habe eine hohe Mutationslast: Es gebe mehr als 270 Mutationen, die zu Sequenzveränderungen in Proteinen führen; im Vergleich dazu seien es beim Mammakarzinom nur 32, erklärte der Referent.4 Klinisch/therapeutisch relevant seien aber nur wenige dieser Veränderungen, darunter KIT, NRAS, BRAF und MEK. MEK selbst sei zwar kaum mutiert, aber MEK-Inhibitoren in Kombination mit BRAF-Inhibitoren könnten deren Wirkung verbessern und Resistenzen hinauszögern, sagte Müllauer. Die Mutationen der genannten Gene seien in „Hotspots“ konzentriert, bei BRAF zum Beispiel zu 90% in V600E.5
Für die Mutationsanalyse von Melanomen wird am Institut für Pathologie eine Genpanel-Sequenzierung mit 50 Genen angewandt, bei therapierefraktären Melanomen ein Panel mit 500 Genen. Beim kutanen Lymphom werden vor allem Klonalitätsanalysen vorgenommen, um ein Lymphom von einem entzündlichen Prozess abzugrenzen. Andere Hauttumoren werden selten molekularpathologisch untersucht, meist bei unklarem histologischem Befund, erklärte Müllauer. Das Next-Generation-Sequencing (NGS) wird vor allem eingesetzt, wenn ein:e Patient:in erneut erkrankt, um festzustellen, ob es sich um eine Neuerkrankung oder um ein Rezidiv handelt. Das Verfahren erlaube eine exakte Quantifizierung, habe eine höhere Sensitivität und liefere eine präzise Gensequenz, so Müllauer.
Neues zum „non-melanoma skin cancer“
Ein Update zu Basaliomen und Plattenepithelkarzinomen gab Univ.-Prof. Rainer Kunstfeld, Universitätsklinik für Dermatologie MedUni Wien/AKH Wien.
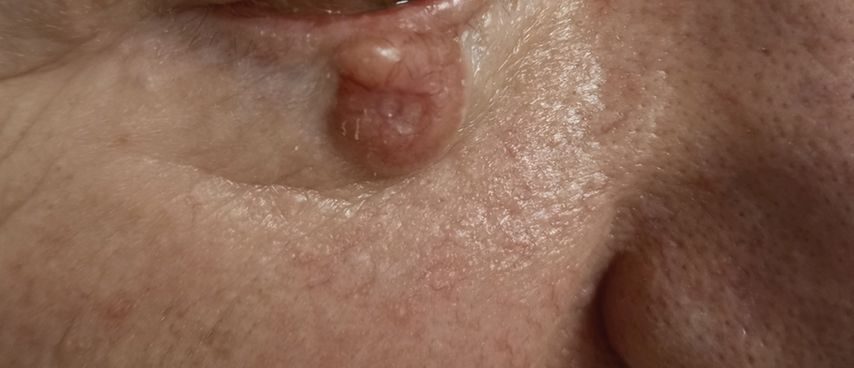
Das Basaliom (Abb. 2) ist mit einem Anteil von 75% der häufigste Hauttumor hellhäutiger Menschen. Das Lebenszeitrisiko, ein Basaliom zu entwickeln, liegt bei etwa 30% und korreliert mit der Sonnenexposition im Lauf des Lebens. Deshalb nimmt die Inzidenz des Basalioms mit dem Alter zu und hat einen Gipfel zwischen dem 60. und 80. Lebensjahr.6–8
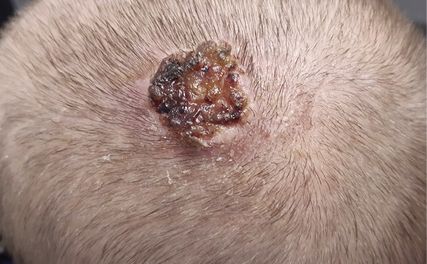
Das Plattenepithelkarzinom (Abb.3) der Haut macht etwa 20% der Hauttumoren aus. Hier liegt das Lebenszeitrisiko hellhäutiger Menschen bei 10% und korreliert ebenfalls mit der UV-Exposition. Daher steigt die Inzidenz mit zunehmendem Alter an. Das mediane Alter bei Erstdiagnose liegt zwischen 70 und 75 Jahren.9
Der Goldstandard der Therapie sei die chirurgische Exzision, erklärte Kunstfeld. So könnten rund 85% aller Basaliome entfernt werden und die 5-Jahres-Rezidivrate liege bei 2–8%. Allerdings bestehe großer Bedarf an wirksamen Therapien bei inoperablen und metastasierten Tumoren, sagte er. So zeige etwa beim Plattenepithelkarzinom die Chemotherapie nur eine geringe Wirkung.10 Bei EGFR-positiven Plattenepithelkarzinomen konnte der EGFR-Inhibitor Cetuximab in einer Phase-II-Studie immerhin eine Krankheitskontrollrate von 69% erzielen, erläuterte Kunstfeld.11
Beim Basaliom können Inhibitoren des Hedgehog-Signalwegs das Tumorwachstum hemmen, da sich nahezu 100% der Mutationen in diesem Signalweg finden, so Kunstfeld.12 Die beiden derzeit zugelassenen Hedgehog-Inhibitoren Sonidegib und Vismodegib erzielen Ansprechraten von 61% bzw. 48%.13
Da Basaliome und Plattenepithelkarzinome der Haut eine hohe Mutationslast aufweisen, bietet sich die Checkpoint-Inhibition als Therapietarget an.14 So wurde der PD-1-Inhibitor Cemiplimib inzwischen von der FDA und der EMA zugelassen.
Rar, aber oft tödlich: seltene Hauttumoren
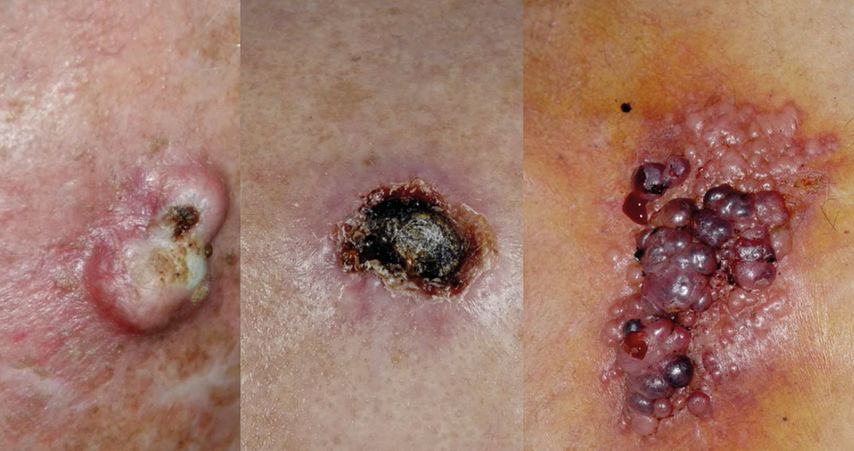
Ebenfalls von der Universitätsklinik für Dermatologie kam Univ.-Prof. Robert Loewe und berichtete über die seltenen Hauttumoren wie Merkelzellkarzinom, Weichteilsarkom und kutanes Adenokarzinom. Sie machten zwar nur etwa 1,2% aller malignen Hauttumoren aus, seien aber für rund ein Viertel der hautkrebsbedingten Todesfälle verantwortlich, betonte er. Anders als bei anderen Hauttumoren sei es wegen der großen Unterschiede des Erscheinungsbildes schwierig, die Diagnose klinisch zu stellen (Abb.4).
Abb. 4:Seltene Tumoren (v.l.): Leiomyosarkom, Talgdrüsenkarzinom, dedifferenziertes Plattenepithelkarzinom
„Der prominenteste dieser Tumoren ist das Merkelzellkarzinom“, sagte Loewe. Es entsteht aus den Merkelzellen der Haut und tritt vor allem bei älteren Menschen (Durchschnittsalter 70 Jahre) und immunsupprimierten Patient:innen auf, hier bereits deutlich früher (50% vor dem 50. Lebensjahr). Die Inzidenz steigt insgesamt an: Wurden 2005 in den USA 1500 Neudiagnosen verzeichnet, werden für 2025 aufgrund der Entwicklung in den vergangenen 20 Jahren 3300 erwartet.15 Therapeutisch werden Checkpoint-Inhibitoren (PD-1- und PD-L1-Inhibitoren) eingesetzt.16–18 Für die adjuvante Therapie steht der PD-1-Inhibitor Nivolumab zu Verfügung.19
Adnexkarzinome haben über alle Entitäten hinweg insgesamt eine Inzidenz von 6/1000000.20 In 10–50% der Fälle kommt es zu einem Lokalrezidiv, in 12% zu einer Metastasierung.21 Sie weisen zahlreiche, zum Teil spezifische genetische Aberrationen auf. Da es sich um eine sehr heterogene Tumorgruppe handele, gebe es keine Standardtherapie, erklärte Loewe. Bei lokalisierten Tumoren sei die chirurgische Entfernung Therapie der Wahl; optional sind die Sentinellymphknotenbiopsie und adjuvante Radiotherapie.22 Handele es sich um eine disseminierte/systemische Form, so gebe es bislang nur experimentelle Therapien mit wenigen Patient:innen und einzelne Fallberichte, sagte Loewe. Wesentlich sei hier eine molekularpathologische und genetische Analyse, da unter bestimmten Voraussetzungen eine Immuntherapie möglich sei, betonte er.
Kutane Sarkome: Das Dermatofibrosarkom ist eine CD34+ Spindelzellproliferation, die Dermis und Subkutis diffus infiltriert. Deshalb sei eine chirurgische Entfernung oft schwierig, so Loewe. Bei lokal nicht operablen Tumoren mit einer nachgewiesenen COL1A1-PDGFB-Fusion sei Imatinib eine Therapieoption oder auch die Radiotherapie, sagte er.
Das Leiomyosarkom ist ebenfalls in der Haut zu finden. Hier sei es wichtig, zu diffezenzieren, ob es sich um einen kutanen Tumor handelt, der die Subkutis infiltiert, oder um einen, der aus der Subkutis stammt. Die kutane Form habe eine sehr gute Prognose, da die einfache Exzision meist ausreiche, während die subkutane Form zu Lokalrezidiven (50–70%) und Metastasierung (30–60%) neige und mit einer Mortalitätsrate von 30–40% einhergehe, sagte Loewe.
Beim Angiosarkom gebe es wenig Neues. Noch immer fehle eine TNM-Klassifikation und als Therapie stünden eine möglichst radikale Operation so früh wie möglich und eine Nachbestrahlung der Resektatränder im Vordergrund.
Malignes Melanom: Modelltumor für Immuntherapien
Univ.-Prof. Christoph Höller, ebenfalls von der Universitätsklinik für Dermatologie, Wien, widmete sich der systemischen Therapie des malignen Melanoms. Zwar sei die chirurgische Exzision die Therapie der Wahl, aber es komme oft zu Rezidiven und häufig bilde das Melanom bereits früh Fernmetastasen, sagte er. Dann spiele die zielgerichtete Therapie mit Immuncheckpoint-Inhibitoren eine entscheidende Rolle. Das maligne Melanom sei der Modelltumor für die Immuntherapie, so Höller. Für die Schlüsselstudien KEYNOTE-006 (Pembrolizumab vs. Ipilimumab)23 und CheckMate 067 (Nivolumab+Ipilimumab)24 seien inzwischen 10-Jahres-Daten für das Gesamtüberleben (OS) bei fortgeschrittenem Melanom veröffentlicht. Das sei früher undenkbar gewesen, betonte Höller. Die 10-Jahres-OS-Raten für Pembro vs. Ipi lagen bei 34% vs. 23,6%;23 für Nivo+Ipi bei 43% vs. Nivo-Mono 37% vs. Ipi-Mono 19%.24 Die Raten des krebsspezifischen OS betrugen 45% (Pembro), 52% (Nivo/Ipi) und 44% (Nivo).23,24
Aktuelle Studien untersuchen unter anderem die Kombination aus Nivo plus dem LAG-3-Antikörper (Relatlimab)25 und die dreifache Checkpoint-Blockade mit Nivo/Ipi/Relatlimab26. Höller zeigte auch, dass die adjuvante Therapie von operablen Melanomen im Stadium III/IV das Risiko einer erneuten Metastasierung um etwa 50% reduzieren kann.27–29 Neu sei das Konzept der neoadjuvanten Therapie bei klinisch sichtbaren lokoregionären Metastasen, sagte er. Hier könne die Immuntherapie gut wirken, da die Immunzellen um die Metastasen herum noch nicht durch eine Operation zerstört seien. So hatten in der Studie SWOG S1801 20% mehr Patient:innen der neoadjuvanten Gruppe im Vergleich zur adjuvanten Gruppe kein Tumorrezidiv.30,31 In der NADINA-Studie wurde die neoadjuvante mit der adjuvanten Immuntherapie bei Patient:innen mit resezierbarem, makroskopischem Melanom im Stadium III verglichen. Patient:innen der neoadjuvanten Gruppe wurden nach der Operation nur dann adjuvant behandelt, wenn sie auf die neoadjuvante Therapie unzureichend angesprochen hatten. Die Rate des rezidivfreien Überlebens lag in der neoadjuvanten Gruppe bei 83,7% (vs. OP+adjuvant 57,2%).32
Strahlentherapie bei Hautkrebs
Ein wichtiger Baustein der Behandlung von Hauttumoren ist die Strahlentherapie, wie Dr. Cora Waldstein, Universitätsklinik für Radioonkologie, MedUni Wien/AKH Wien, erläuterte. Vor allem Basaliome und Plattenepithelkarzinome seien sehr strahlensensitiv und sprächen daher gut auf die Therapie an, sagte sie. Bei kleinen Tumoren (<4cm) liege die lokale Kontrolle nach fünf Jahren bei >90%, nach zehn Jahren bei Basaliomen ebenfalls bei >90%, bei Plattenepithelkarzinomen bei 87%.33 Die Raten seien vergleichbar mit jenen einer Operation, so Waldstein. Dennoch sei die Operation der Goldstandard, da sie am effektivsten und effizientesten sei sowie eine komplette histologische Untersuchung des Resektates erlaube, sagte sie. Die Strahlentherapie biete aufgrund der vergleichbaren Kontrollrate vor allem bei inoperablen Tumoren, älteren/gebrechlichen sowie antikoagulierten Patient:innen Vorteile. Zudem hinterlasse sie keine Narben, betonte die Referentin. Ungünstiger sei das Ergebnis der Bestrahlung bei großen Tumoren (>4cm), perineuraler Invasion (PNI), bereits bestehenden Knochenerosionen und Immunsuppression. In diesen Fällen sinke die lokale 5-Jahres-Kontrollrate auf rund 69% und es komme häufig zu Rezidiven, so Waldstein.
In der Melanombehandlung spiele die Strahlentherapie seit Einführung der Immuntherapie dagegen eine immer kleinere Rolle. Allerdings konnte eine Studie zeigen, dass bei einem Rezidiv nach Operation plus Immuntherapie eine adjuvante Betrahlung nach erneuter Resektion die lokoregionäre Kontrolle verbessern konnte.34
Große Bedeutung hat laut Waldstein die Strahlentherapie bei kutanen B- und T-Zell-Lymphomen: Bei lokalisierten Tumoren wird lokal bestrahlt, während bei ausgedehnten Lymphomen eine Ganzhaut-Radiotherapie (TSEBT) eingesetzt wird. Dieses Verfahren wird in Österreich nur im AKH Wien angeboten.
Medizinischer Fortschritt braucht klinische Forschung
Dr. Julia Ressler, PhD, Universitätsklinik für Dermatologie, MedUni Wien/AKH Wien, schloss die informative Fortbildung mit einem Überblick über die klinische Forschung und aktuelle Studien bei Hauttumoren am CCC Vienna ab.
Sie stellte die Phase-II-Studie NeoBCC vor, in der die Wirksamkeit und Sicherheit des onkolytischen Virus Talimogene Laherparepvec (T-VEC) als neoadjuvante Therapie bei schwierig zu resezierenden Basaliomen untersucht wurden. T-VEC wurde intratumoral injiziert. Primärer Endpunkt war der Anteil an Patient:innen, bei denen der Tumor nach sechs Zyklen ohne weitere plastische Chirurgie resezierbar war. Sekundäre Endpunkte waren die Raten des rezidivfreien Überlebens und des OS: Beide waren 100%. Bei 50% der Patient:innen konnte der Tumor ohne Lappenplastik o.Ä. entfernt werden. Nebenwirkungen waren mild (Grad 1–2); es kam vor allem zu Schmerzen an der Injektionsstelle und Übelkeit.35
Ressler wies auf eine derzeit laufende Studie hin, die Biomarker wie das DNA-Methylierungsprofil auf die Korrelation mit dem Ansprechen auf Immuntherapien untersucht. Derzeit werden außerdem noch Teilnehmer:innen für weitere Studien rekrutiert, unter anderem für die Therapie des lokal fortgeschrittenen oder metastasierten Plattenepithelkarzinoms mit der Kombination aus Nivolumab und Relatlimab sowie für zwei Studien zum malignen Melanom.
Quelle:
Cancer Update CCC Vienna: Hautkrebs, 4. November 2024 (hybrid)
Literatur:
1 Garbe C et al.: Eur J Cancer 2025; 215: 115152 2 S3-Leitlinie Prävention von Hautkrebs, 2021, AWMF Registernummer: 032/052OL 3 Tschandl P et al.: Lancet Oncol 2019; 20(7): 938-47 4 Castle JC et al.: Front Immunol 2019; 10: 1856 5 Cheng L et al.: Mod Pathol 2018; 31(1): 24-38 6 Peris K et al.: Eur J Cancer 2019; 118: 10-34 7 Muzic JG et al.: Mayo Clin Proc 2017; 92(6): 890-8 8 Little MP et al.: Cancer Epidemiol Biomarkers Prev 2021; 30(10): 1932-46 9 Fontanillas P et al.: Nat Commun 2021; 12(1): 160 10 Cowey CL et al.: Cancer Med 2020; 9(20): 7381-7 11 Maubec E et al.: J Clin Oncol 2011; 29(25): 3419-26 12Peris K et al.: Eur J Cancer 2019; 118: 10-34 13 Dummer R et al.: J Eur Acad Dermatol Venereol 2020; 34(9): 1944-56 14 Migden MR et al.: NEJM 2018; 379(4): 341-51 15 Paulson KG et al.: J Am Acad Dermatol 2018; 78(3): 457-63.e2 16 D‘Angelo SP et al.: ESMO Open 2024; 9(5): 103461 17 Kim S et al.: Lancet 2022; 400(10357): 1008-19 18 Mortier L et al.: Am J Clin Dermatol 2024; 25(6): 987-96 19 Becker JC et al.: Lancet 2023; 402(10404): 798-808 20Gibbs DC et al.: J Am Acad Dermatol 2023; 88(1): 226-8 21 Martinez SR et al.: Arch Dermatol 2011; 147(9): 1058-62 22 Utikal J et al.: JDDG 2024; https://doi.org/ 10.1111ddg. 15405_g 23 Long GV et al.: Ann Oncol 2024; 35(12): 1191-9 24 Wolchok JD et al.: NEJM 2025; 392(1): 11-22 25 Tawbi HA et al.: J Clin Oncol 2024; doi: 10.1200/JCO.24. 01124 26Ascierto PA et al.: ASCO-Kongress 2024, Abstr. #9504 27 Dummer R et al.: NEJM 2020; 383(12): 1139-48 28 Eggermont AMM et al.: J Clin Oncol 2020; 38(33): 3925-36 29 Ascierto PA et al.: Lancet Oncol 2020; 21(11): 1465-77 30 Patel SP et al.: NEJM 2023; 388(9): 813-23 31 Patel SP et al.: ESMO-Kongress 2023, Abstr. #LBA48 32 Blank CU et al.: NEJM 2024; 391(18): 1696-708 33 Marconi DG et al.: PLoS ONE 2016; 11(7): e0156544 34 Bhave P et al.: J Immunother Cancer 2023; 11(3): e006629 35 Ressler JM et al.: Nat Cancer 2025; 6(1): 51-66
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...