Neue Herausforderungen: Thoraxchirurgie & multimodale Therapiekonzepte
Autoren:
Priv.-Doz. Dr. Thomas Klikovits, PhD
Univ.-Prof. Dr. Clemens Aigner, MBA
Abteilung Thoraxchirurgie und
Karl-Landsteiner-Institut
für klinische und translationale Thoraxchirurgische Forschung
Klinik Floridsdorf, Wien
E-Mail:
Das Lungenkarzinom ist eine der häufigsten Krebserkrankungen sowie Krebstodesursachen weltweit. Die Chirurgie spielt vor allem im Frühstadium eine wichtige Rolle. Durch enorme Fortschritte in der systemischen Therapie hat die Bedeutung der Chirurgie in lokal fortgeschrittenen Stadien sowie im oligometastasiertem Setting starkzugenommen.
Keypoints
-
Lokal fortgeschrittene Stadien erfordern eine individualisierte, multidisziplinäre Therapie.
-
Moderne systemische Therapie ermöglicht potenziell kurative Chirurgie in lokal fortgeschrittenen Stadien.
-
Neoadjuvante Chemo-Immuntherapie zeigt hohe pathologische Ansprechraten, die vorwiegend im Stadium III in einem verbessertem Langzeitoutcome resultieren.
Noch vor wenigen Jahren waren die stadienadaptierten Therapiekonzepte beim nichtkleinzelligen Lungenkarzinom (NSCLC) vergleichsweise simpel. Bei funktionell operablen Patienten wurde im Stadium I primär operiert. Im Stadium II wurde meist primär operiert und eine adjuvante Chemotherapie verabreicht. Das Stadium III ist generell sehr heterogen und der Stellenwert der Chirurgie im multimodalen Setting wurde lange kontrovers diskutiert, weshalb die meisten Patienten hier keiner Operation zugeführt wurden. Im Stadium IV wurde Chirurgie meist nur im palliativen Setting eingesetzt.
Im Jahr 2023 ist mittlerweile fast alles anders. Moderne zielgerichtete Thyrosinkinaseinhibitoren (TKI) und die Immuntherapie haben sehr erfolgreich Eingang in die Therapie der lokal fortgeschrittenen und frühen Stadien gefunden und im Jahr 2022 wurden auf den großen onkologischen Kongressen (WCLC, ASCO, ESMO)neue vielversprechende Daten gezeigt. Das stellt auch die Thoraxchirurgie vor neue, positive Herausforderungen, im Rahmen eines modernen Biomarker-basierten multimodalen Behandlungskonzepts. Vor allem die onkologische Sinnhaftigkeit als Grundprinzip der Tumorchirurgie wird immer weiter ausgedehnt und erstreckt sich mittlerweile über lokal fortgeschrittene Stadien bis hin zu selektionierten Patienten im oligometastatischen Stadium IV.
Thoraxchirurgie und moderne adjuvante Therapie
Ein Beispiel für die individualisierte adjuvante Therapie ist die ADAURA-Studie. Hier konnte bereits 2020 gezeigt werden, dass die adjuvante Verabreichung von Osimertinib (TKI bei EGFR-Mutation) bei reseziertem NSCLC im Stadium IB–IIIA zu einer signifikanten Verlängerung des rezidivfreien Überlebens (DFS) gegenüber Placebo führt (DFS-Rate nach 24 Monaten 89% vs. 52%).1 Im Rahmen der ESMO(European Society for Medical Oncology)-Konferenz 2022 wurde weiters gezeigt, dass im Stadium II/IIIA die DFS-Rate nach 48 Monaten im Arm mit adjuvantem Osimertinib bei 70% versus 29% im Placebo-Arm lag.
Auch der erfolgreiche adjuvante Einsatz von Immuntherapie wurde bereits im Rahmen von Phase-III-Studien belegt.2,3 Aufgrund der mittlerweile zahlreich zugelassenen Mutations-spezifischen individuellen Therapiemöglichkeiten im Stadium IV wird der adjuvante Einsatz dieser Therapeutika nach Resektion von NSCLC im frühen und lokal fortgeschrittenen Stadium im Rahmen von Studien untersucht. Die kommenden Monate und Jahre werden zeigen, welche Therapieformen dann die klassische adjuvante Chemotherapie zunehmend ablösen werden.
Thoraxchirurgie und moderne neoadjuvante Therapie
Die Rolle der Chirurgie im lokal fortgeschrittenen Stadium, vor allem bei positiven mediastinalen Lymphknoten, wurde lange kontrovers diskutiert. Der Tumor ist jedoch oft technisch resektabel. Daher ist gerade hier eine multidisziplinäre Indikationsstellung zu Therapiebeginn im Rahmen eines interdisziplinären Tumorboards von großer Bedeutung.
Auch die potenzielle Resektabilität sollte jedenfalls vor Beginn einer neoadjuvanten Therapie festgestellt werden. Eine Operabilität sollte nie ohne Beteiligung einer onkologisch spezialisierten Thoraxchirurgie ausgeschlossen werden. Dies wurde auch in den aktuellen ASCO(American Society of Clinical Oncology)-Empfehlungen festgehalten.4
Konsistent in fast allen Guidelines ist anhand der vorliegenden Evidenz jedenfalls die Empfehlung einer neoadjuvanten Therapie bei pathologisch nachgewiesenem Stadium III (N2) NSCLC. Anhand mehrerer Studien konnte bislang gezeigt werden, dass mit neoadjuvanter Chemostrahlentherapie bessere Ansprechraten vorlagen und sehr gute Langzeitergbnisse erzielt werden können.5,6 Ein Überlebensvorteil gegenüber einer alleinigen neoadjuvanten Chemotherapie war jedoch meist nicht gegeben.7–9 Daher wurde von vielen Zentren die alleinige neoadjuvante Chemotherapie gegenüber einer neoadjuvanten kombinierten Chemostrahlentherapie bevorzugt.8
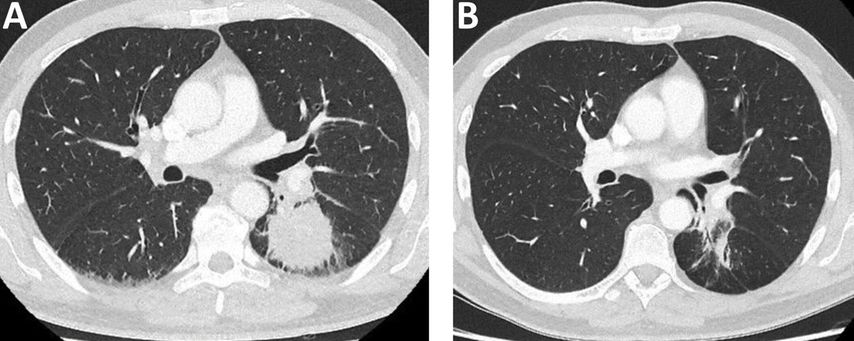
Immuntherapie und kombinierte Chemo-Immuntherapie führen zu hohen klinischen Ansprechraten und stellen mittlerweile eine etablierte Therapieform im Stadium IV dar. In einer der ersten publizierten Fallserien zu neoadjuvanter Immuntherapie bei resektablem NSCLC im Stadium I–IIIA konnte im Jahr 2018 gezeigt werden, dass der Einsatz von Nivolumab mit wenigen Nebenwirkungen, keiner signifikanten Verzögerung der Operation und vor allem hohen pathologischen Ansprechraten vergesellschaftet war.10 Seither lief und läuft eine Vielzahl an prospektiven Phase-II- und Phase-III-Studien mit verschiedenen neoadjuvanten (Chemo-)Immuntherapien bei resektablem NSCLC im Stadium IB-III (Abb. 1).
Abb. 1: Männlicher Patient, 45 Jahre, mit einem Adenokarzinom im linken Unterlappen im klinischen Stadium cT3, cN2, cMO, PD-L1 Expression von 90%, keine therapierelevanten Mutationen. A: CT-Bild zum Zeitpunkt der Erstdiagnose. B: CT-Bild nach neoadjuvanter Chemo-Immuntherapie. Es erfolgte anschließend eine Lobektomie des linken Unterlappens inklusive Lymphadenektomie. Histopathologisch zeigte sich ein „major pathologic response“
Im Rahmen der prospektiv randomisierten Phase-III-Studie CheckMate-816 mit neoadjuvantem Nivolumab + Chemotherapie (Nivo/Chemo) versus Chemotherapie alleine (im Stadium IB–IIIA) konnte unlängst gezeigt werden, dass die Kombination von Nivo/Chemo mit einem signifikant längeren medianen DFS (31,6 versus 20,8 Monate) einherging.11 Weiters betrug der Anteil an Patienten mit komplettem pathologischem Ansprechen [engl. „pathologic complete response“ (pCR)] in der Nivo/Chemo-Gruppe 24% versus 2,2% in der Chemo-Gruppe. Jedoch konnte bei 15,5% der Patienten in der Nivo/Chemo-Gruppe und 20,7% in der Chemo-Gruppe die Operation nicht wie geplant durchgeführt werden. ImRahmen des ASCO-Kongresses 2022 wurde weiters gezeigt, dass die Patienten mit pCR auch ein signifikant längeres DFS aufwiesen. Beim AACR(American Association for Cancer Research)-Kongress 2022 wurde weiters berichtet, dass der Vorteil im DFS für Nivo/Chemo vor allem im Stadium III und weniger in den Stadien IB/II relevant war. Insgesamt war auch das Gesamtüberleben in der Nivo/Chemo-Gruppe signifikant länger.
Die prospektive Phase-II-Studie NADIM-II untersuchte den Einsatz von Nivo/Chemo versus Chemo alleine im resektablen Stadium IIIA/B. Auch hier zeigte sich ein pCR bei 36,8% der Patienten in der Nivo/Chemo-Gruppe versus 6,9% in der Gruppe mit Chemo alleine.12Interessanterweise konnten nur 69% der Patienten in der Chemo-Gruppe auch tatsächlich nach erfolgter neoadjuvanter Therapie operiert werden (versus 93% in der Nivo/Chemo-Gruppe). Die 2-Jahres-Gesamtüberlebensrate betrug in der Nivo/Chemo-Gruppe 84,7% versus 63,4% in der Chemo-Gruppe.13
Eine Biomarker-adaptierte neoadjuvante zielgerichtete Therapie ist derzeit noch nicht in der Routine etabliert, wird jedoch in Phase-II/III-Studien untersucht.
Fazit
Zusammenfassend kann anhand der bislang vorliegenden Daten festgehalten werden, dass kombinierte Chemo-Immuntherapie zu hohen pathologischen Ansprechraten führt, die idealerweise in einem längeren Gesamtüberleben resultieren. Der Vorteil für Chemo-Immuntherapie dürfte vor allem im Stadium III gegeben sein. Da Patienten im Stadium IB und II oft primär operabel sind und eine potenziell kurative Resektion durch eine neoadjuvante Therapie nicht unnötig verzögert oder gar verhindert werden darf, istdas interdisziplinären Management zu Therapiebeginn von großer Bedeutung. Durch diese neuen Therapieformen mit hohen Ansprechraten können aber auch lokal fortgeschrittene Patienten nun oft erfolgreich und parenchymsparend operiert werden.
Chirurgie im oligometastatischen Stadium IV
Die Patientenkohorte mit oligometastatischer Erkrankung ist sehr heterogen und anhand einer Konsensusarbeit wurde vorgeschlagen, dass Krankheitsfälle mit maximal 5 Metastasen in maximal 3 Organen, die einer potenziell radikalen Therapie zugeführt werden können, unter dem Begriff der oligometastatischen Erkrankung zusammengefasst werden können.14 Als Lokaltherapie zusätzlich zur systemischen Therapie kommen vorwiegend Chirurgie und Strahlentherapie zur Anwendung und diese müssen jedenfalls genauestens hinsichtlich Morbidität, Toxizität und Einfluss auf die Lebensqualität abgewogen werden. In einer rezenten prospektiven Phase-II-Studie, die den Einfluss einer Lokaltherapie (Chirurgie und/oder Strahlentherapie) bei Patienten mit bis zu 3 Metastasenlokalisationen ohne Progress nach der initialen systemischen Therapie untersuchte, konnte das mediane Überleben mit Lokaltherapie signifikant verlängert werden (medianes Überleben 41 versus 17 Monate). Die Frage nach der entsprechenden Lokaltherapie neben der systemischen Therapie und der Therapiesequenz muss jedenfalls im interdisziplinären Team und jeweils individuell für selektionierte Patienten festgelegt werden.15,16
Literatur:
1 Wu YL et al.: N Engl J Med 2020; 383: 1711-23 2 Felip E et al.: Lancet 2021; 398: 1344-57 3 O‘Brien M et al.: Lancet Oncol 2022; 23: 1274-86 4 Daly ME et al.: J Clin Oncol 2022; 40: 1356-84 5 Eberhardt WE et al.: J Clin Oncol 2015; 33: 4194-201 6 Guberina N et al.: Eur J Cancer 2020; 138: 156-68 7 Thomas M et al.: Lancet Oncol 2008; 9: 636-48 8 Pless M et al.: Lancet 2015; 386: 1049-56 9 Higgins K et al.: Int J Radiat Oncol Biol Phys 2009; 75: 1462-7 10 Forde PM et al.: N Engl J Med 2018; 378: 1976-86 11 Forde PM et al.: N Engl J Med 2022; 386: 1973-85 12 Provencio M et al.: J Clin Oncol 2022; 40(suppl): Abstr. 8501 13 Provencio M et al.: J Thorac Oncol 2022; 17(suppl): Abstr. PL03.12 14 Dingemans AC et al.: J Thorac Oncol 2019; 14: 2109-19 15 Gomez DR et al.: J Clin Oncol 2019; 37: 1558-65 16 Gomez DR et al.: Lancet Oncol 2016; 17: 1672-82
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...