Die chirurgische Therapie iatrogener Nervenläsionen und Neurome
Autoren:
Dr. Veith L. Moser1,2
PD Dr. Stefan Salminger, PhD1
Dr. Andreas Gohritz3
PD Dr. Gerd Bodner2
PD Prim. Dr. Thomas Hausner1
1 Traumazentrum Wien
Standort Lorenz-Böhler-Unfallkrankenhaus
2 Wiener Nervenschmerz Zentrum
3 Plastische, Wiederherstellungs- und Ästhetische Chirurgie, Handchirurgie
Universitätsspital Basel
Korrespondierender Autor:
Dr. Veith L. Moser
E-Mail: vm@medspa.cc
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Neuropathische Schmerzsyndrome stellen eine große Belastung für die Patienten dar. Die rasche Diagnose und chirurgische Versorgung iatrogener Nervenverletzungen bedürfen eines breiten methodischen Wissens und Erfahrung. Im Folgenden erfahren Sie, was es bei der Behandlung neuropathischer Schmerzsyndrome zu beachten gibt.
Keypoints
-
Neuropathische Schmerzen treten oft infolge von Nervenläsionen auf, die traumatisch oder auch iatrogen bedingt sein können, beispielsweise durch unfallchirurgische oder orthopädische Eingriffe.
-
Die Behandlung neuropathischer Schmerzsyndrome ist ein Spezialgebiet der peripheren Nervenchirurgie, das einen großen diagnostischen und chirurgischen Erfahrungsschatz erfordert, um rasch und effizient die richtige Diagnose und Indikation zur optimalen Therapie zu stellen.
-
Bei der Methodenwahl unterscheidet man traditionelle ablative Methoden (Exzision und Verlagerung, z.B. in Muskel, Vene oder Knochen), die oft eine hohe Rezidivrate aufweisen, von neuartigen rekonstruktiven Techniken. Diese versuchen, den unvermeidlich auswachsenden Nervenfasern ein neues Zielorgan anzubieten, um das Rezidivrisiko zu senken.
-
Chirurgen, die sich nicht routinemäßig, sondern rein komplikationsbedingt plötzlich mit diesen komplexen Problemstellungen konfrontiert sehen, können mit der Situation überfordert sein.
-
Mit interdisziplinärer Zusammenarbeit und einem raschen und gezielten diagnostischen und therapeutischen Vorgehen lassen sich die Ergebnisse nach iatrogenen Nervenverletzungen verbessern sowie Chronifizierungen und eventuelle juristische Konsequenzen verhindern.
Neuropathischen Schmerzen liegen meist traumatische Verletzungen, oft aber auch iatrogene Nervenverletzungen zugrunde, oft als Folge von Operationen. Sie können etwa durch falsche Lagerung, unvorsichtige oder unqualifizierte Platzierung von Haken oder anderem Instrumentarium, durch fehlerhafte Blutsperren, Nähte, Gipsanordnungen, Punktionsnadeln oder thermische Schädigungen (zementierte Hüftprothesen) verursacht werden (Tab. 1 und 2).1
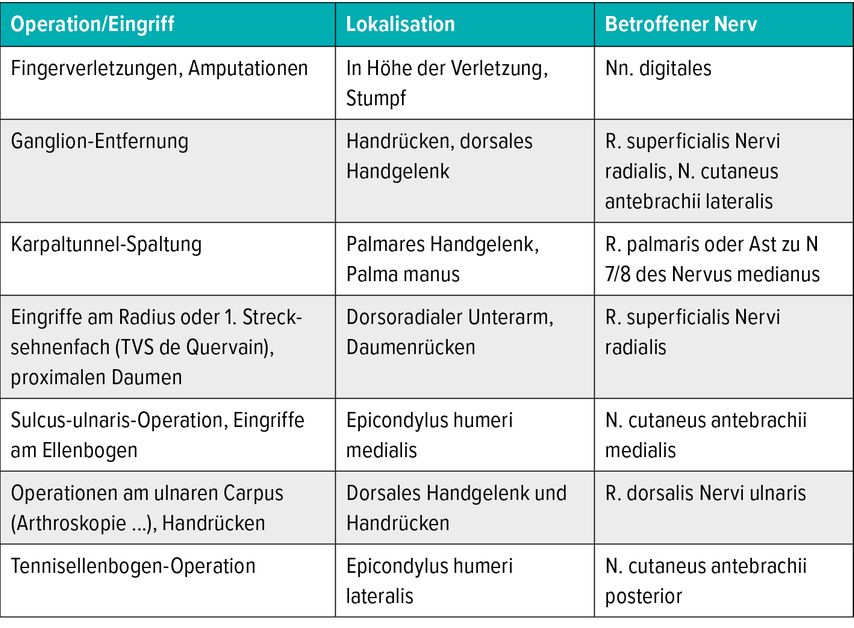
Tab. 1: Typische Ursachen/Lokalisationen von iatrogenen Nervenverletzungen und Neuromen an der oberen Extremität
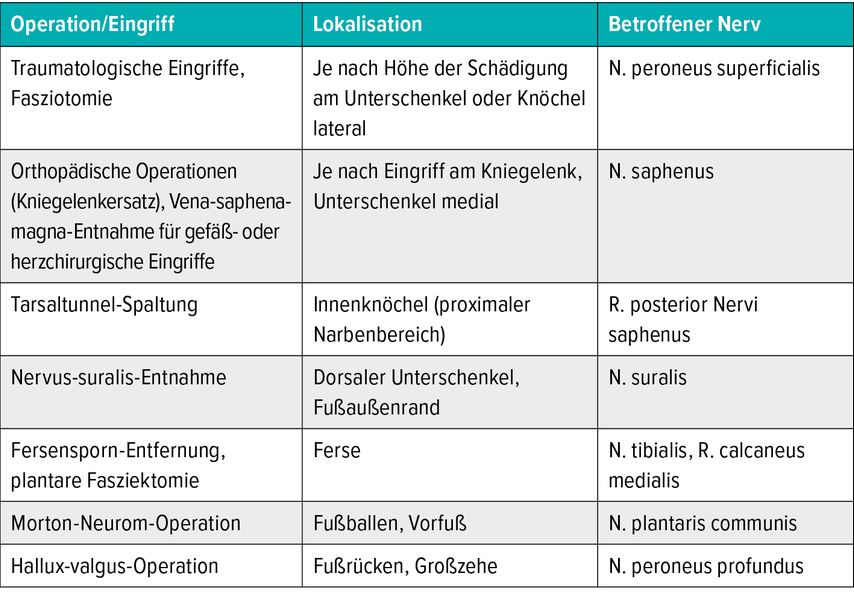
Tab. 2: Typische Ursachen/Lokalisationen von iatrogenen Nervenverletzungen und Neuromen an der unteren Extremität
Das genaue Ausmaß einer Nervenschädigung ist von Art und Dauer der einwirkenden Kräfte abhängig. Wenn die nach einer Nervendurchtrennung unvermeidlich regenerierenden Axone kein Zielorgan erreichen, kommt es zur Ausbildung eines intraneuralen oder endständigen Neuroms. Durch das ungerichtete Wachstum entwickelt sich eine gestörte Erregbarkeit mit typischerweise brennenden, stechenden und elektrisierenden Schmerzen (Hyperalgesie) und ausgeprägtem Hoffmann-Tinel Zeichen.
Ein erhöhtes Risiko für die Ausbildung neuropathischer Schmerzsyndrome besteht zum Beispiel bei erhöhtem Alter, männlichem Geschlecht, vaskulären Erkrankungen, Multipler Sklerose, nutritiv toxischen oder diabetesbedingten Polyneuropathien, Nikotinabusus oder auch Hypertonie. Bestimmte Nerven sind bekanntermaßen besonders „empfindlich“ und neigen zur Ausbildung von Schmerzsyndromen, beispielsweise der Ramus superficialis des Nervus radialis.
Nach einer Nervenschädigung reichen die Symptome, je nach Ausmaß, von leichten Missempfindungen und Taubheit bis hin zu stark brennenden, stechenden oder elektrisierenden Schmerzen und von motorischer Schwäche bis zum vollständigen motorischen Funktionsausfall. Oft sind diese Symptome gerade unmittelbar postoperativ nicht immer eindeutig einzuordnen. Im Idealfall sollte die Rekonstruktion eines iatrogenen Nervenschadens noch während der Erstoperation erfolgen, dies geschieht jedoch nur selten, weil der Schaden meist weder unmittelbar intraoperativ noch früh postoperativ erkannt wird. Oft ist auch der genaue Schädigungsgrad unklar. Ausnahmen davon sind natürlich glatte Durchtrennungen, diese sollten möglichst rasch mittels mikrochirurgischer Nervenkoaptation versorgt werden.
Exakte Diagnosestellung ermöglicht frühzeitige Therapie
Die rasche Diagnose und die richtige Therapie sind essenziell für den Erfolg der Nervenrekonstruktion. Sie basiert auf einer genauen Anamnese (bei Bedarf Rücksprache mit Erstbehandler!) sowie einer eingehenden klinischen Untersuchung der sensiblen Dermatome sowie der motorischen Nervenfunktionen. Die Prüfung der Berührungs-, Schmerz- und Temperaturempfindung schließt Verfahren wie Zweipunktediskrimination und Semmes-Weinstein-Monofilament-Test zur genaueren Quantifizierung ein. Auch Veränderungen der Hauttrophik (Ausprägung der Leisten, Schweißsekretion, Behaarung etc.) können auf eine sensible Nervenschädigung hinweisen. Die Lokalisation der Schädigung wird durch das sogenannte Hoffmann-Tinel-Zeichen bestimmt, das entsteht, wenn der verletzte Nerv in seinem Verlauf beklopft wird und dies unangenehme elektrisierende Missempfindungen auslöst, die in sein Versorgungsareal ausstrahlen. Dieses Zeichen wird allerdings erst einige Wochen nach der Nervendurchtrennung auslösbar. Bei Verdacht auf ein Neurom sollte auch eine Probeblockade der Nervenleitung proximal des Hauptschmerzpunktes durchgeführt werden, die den Effekt einer Operation simuliert.
Hochauflösender Nervenultraschall – ideal zur Nervendiagnostik
In den letzten Jahren hat sich als wichtiges diagnostisches Instrument der hochauflösende Nervenultraschall herauskristallisiert.2 Weitere Untersuchungen wie Magnetresonanztomografie, Nervenleitgeschwindigkeit und Elektromyografie können zusätzliche Hinweise geben. Die Elektrophysiologie spielt vor allen Dingen im spätprimären und sekundären Abschnitt eine sehr wichtige Rolle, in der Akutphase (den ersten Wochen) ist von ihr wenig Information zu erwarten. Initial kann die Elektrodiagnostik eine vorhandene Neurapraxie (spontan und komplett reversibel) nicht verlässlich von einer strukturellen Nervenschädigung wie der Neurotmesis oder Axonotmesis unterscheiden. Im Gegensatz dazu kann der hochauflösende Ultraschall hier meist präzise Aussagen über die Struktur und Pathologie des Nerven treffen. Aufgrund der hohen Auflösung moderner Ultraschallsonden können die Kontinuität und die Qualität einzelner Nervenfaszikel zuverlässig beurteilt werden.
Als besonderer Vorteil kann der betreffende Nerv ultraschallkontrolliert mit minimalen Mengen an Lokalanästhesie und sehr differenziert probeweise blockiert werden. Der genaue Verlauf kann auch auf der Haut markiert werden, was dem Operateur das Auffinden von Läsionen und Neuromen wesentlich erleichtert und die Operationszeit verringert.
Primäre Therapie bei Nervenverletzung – möglichst rasch und präzise
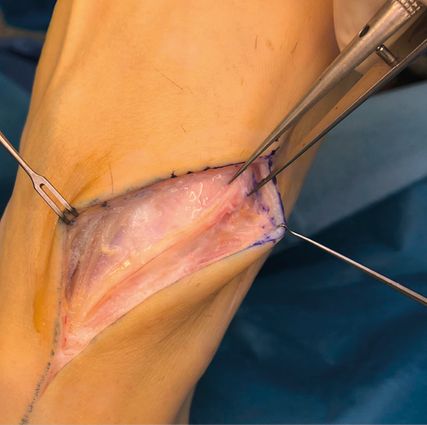
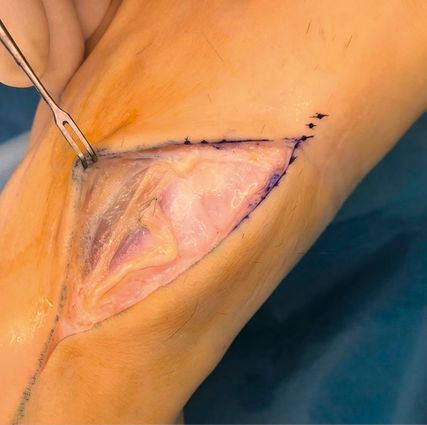
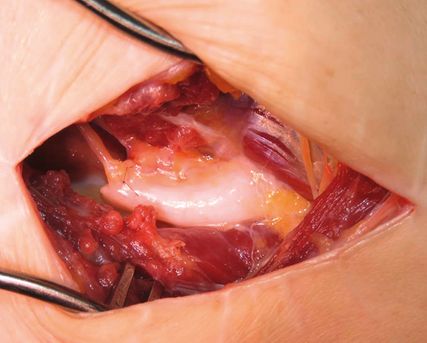
Abb. 1a: Starke Schmerzen (VAS 7–8/10) am Fußrücken bei 18-jährigem Patienten infolge orthopädischer Exostosenabtragung, im hochauflösenden Nervenultraschall Neuroma in continuitatem des Nervus dorsalis intermedius (N. peroneus superficialis), dessen genauer Verlauf ultraschallgestützt auf der Haut markiert wurde
Abb. 1b: Nach Neuromexzision und End-zu-Seit-Neurorrhaphie des N. dorsalis intermedius an N. dorsalis medialis verringerte sich die Schmerzintensität auf VAS 0–1/10, damit auch wieder Arbeit mit Spezialschuhen möglich
Die primäre Rekonstruktion richtet sich nach der Art und dem Ausmaß eines Nervenschadens. Bei sichtbaren morphologischen Schäden am Nerv, aber erhaltener Kontinuität (In-continuitatem-Läsion), ist je nach Ausmaß der Veränderung eine Epineurotomie oder die sparsame, aber suffiziente Anfrischung bis ins sichtbar vitale Nervengewebe indiziert. Kommt es zu einer Durchtrennung einzelner Faszikel oder des gesamten Nervs, ist die spannungsfreie Wiederherstellung der Kontinuität durch mikrochirurgische epineurale Nähte das Ziel. Dies kann entweder im Sinne einer Direktnaht oder bei Substanzverlust mittels Nerventransplantaten erfolgen. Körpereigene Spendernerven stellen weiterhin den Goldstandard zur Rekonstruktion von Nervendefekten dar, sind jedoch ein limitiertes Gut.
Bei kurzstreckigen Defekten am Fingernerv oder an einem sensiblen Hautnerv kann die Rekonstruktion auch mittels autologer Vene erfolgen. Ebenso existiert eine Vielzahl an synthetischen Nervenersatzmaterialien, die eine Rekonstruktion ohne Hebedefekt versprechen. Selbst der Einsatz von allogenen Nerventransplantaten von menschlichen Organspendern ist heute möglich. Diese sind allerdings sehr kostenintensiv und kommen daher nur begrenzt zum Einsatz.
Chirurgische Neuromtherapie – bewährte und neue Ansätze
Abb. 2: Intraoperatives Bild eines Nerventransfers von Nervus medianus auf Muskelast des Musculus pronator teres zur Neuromtherapie bei Z.n. Unterarm-Amputation
Neuromschmerzen lassen sich mittels genauer Anamnese und Untersuchung (inkl. Testblockade mit Lokalanästhesie) vom postoperativen Wundschmerz unterscheiden. Das Auftreten solcher neuropathischen Schmerzen sollte die entsprechende Kaskade der Diagnostik in Gang setzen, um möglichst zeitnah eine Behandlung einzuleiten. Zunächst erfolgen konservative Maßnahmen, angefangen mit ergotherapeutischer Desensibilisierung und Spiegeltherapie bis hin zu professioneller Schmerztherapie durch erfahrene Neurologen oder Schmerztherapeuten bzw. Anästhesisten.
In der Literatur gibt es verschiedenste Möglichkeiten, Neurome chirurgisch zu behandeln. Grundsätzlich unterscheidet man zwischen kritischen Nerven mit unverzichtbarer, z.B. motorischer, Funktion, die erhalten oder rekonstruiert werden sollte, und nicht kritischen Nerven, deren rein sensible Funktion zugunsten einer Schmerzreduktion aufgegeben werden kann.
Bei Neuromen motorischer Nerven ist eine autologe Nervenrekonstruktion gerechtfertigt, in manchen Fällen reicht auch nur ein partieller Ersatz einzelner funktionsloser Faszikel („split repair“) im Anschluss an eine interfaszikuläre Neurolyse. Bei Kontinuitätsneuromen mit aufgehobener Funktion und fehlender Regeneration erfolgen die Resektion des Neuroms und die Kontinuitätswiederherstellung mit autologen Nerveninterponaten.
In Einzelfällen können, wie bei Nervendefekten, alternativ auch allogene Interponate (z.B. dezellularisierte Leichennerven) eingesetzt werden, um eine Spendermorbidität (mit erneutem Neuromrisiko) zu vermeiden – Hauptnachteil sind die hohen finanziellen Kosten.
Bei „nicht kritischen“ (verzichtbaren), also z.B. rein sensiblen Hautnerven wird in der Regel das schmerzhafte Neurom entfernt und der proximale Nervenstumpf entweder direkt in einen Muskel, in eine Vene oder zum Beispiel an der Hand oder am Fuß in einen Knochen verlagert. Jede Nervenrückkürzung führt allerdings immer zu einer neuerlichen Neurombildung (Rezidiv). Je nachdem, wo das neuerliche Neurom zu liegen kommt, möglichst außerhalb von mechanischen Belastungszonen, ist mit einer Besserung der Schmerzsituation zu rechnen. Eine komplette Schmerzfreiheit ist aber aufgrund der erneuten Neurombildung unwahrscheinlich.
Rekonstruktive Techniken – dem Nerv ein neues Zielorgan geben
Aktuelle Untersuchungen haben gezeigt, dass rekonstruktive Operationsverfahren Neurombildung verhindern können und bessere Ergebnisse erzielen können. Dafür ist es allerdings notwendig, dem Nerv wieder ein Zielorgan, also ein „neues Zuhause“, anzubieten, um ihm die Möglichkeit zurückzugeben, wieder seine ursprüngliche Funktion auszuüben. So ist es auch möglich, Deafferenzierungsschmerzen vorzubeugen beziehungsweise sie sinnvoll zu behandeln.
Eine seit Längerem bewährte Möglichkeit ist hier die End-zu-Seit-Neurorraphie, beschrieben von Aszmann und Mitarbeitern.3 Hier regenerieren die Axone aus dem Nervenstumpf in einen Nachbarnerv und finden so wieder ein Zielorgan. Dieses Verfahren bietet sich vor allem an den (distalen) Extremitätenabschnitten an, wo schmerzhafte Neurome – etwa der Digitalnerven nach Fingeramputationen – mittels End-zu-Seit-Naht an den benachbarten Fingernerven koaptiert werden. Die Durchführung des Eingriffes ist relativ einfach und überschaubar, die Inzisionen sind kurz und die Präparation ist einfach und in unmittelbarer Nachbarschaft. Nach Schaffung eines epineuralen Fensters am Empfängernerv erfolgt die mikrochirurgische Koaptation. Postoperativ wird durch eine intensive physikalische Neurorehabilitation die Heilung bzw. Umleitung und Desensibilisierung unterstützt.
Innovative Methoden aus der bionischen Prothesensteuerung
Ein neues vielversprechendes Konzept ist die gezielte Muskelreinnervierung, engl. „Targeted Muscle Reinnervation“ (TMR). Hier erfolgen die Umlagerung und die End-zu-End-Koaptation des proximalen Nervenstumpfes auf einen noch intakten Muskelast.4, 5 Die Technik stammt eigentlich aus der bionischen Prothetik, um die Signalstärke amputierter Nerven mittels Reinnervation eines Muskelstumpfes für die bionische Prothese biologisch zu verbessern. Als Nebeneffekt wurden exzellente Ergebnisse hinsichtlich niedriger Neuromraten und stark reduzierter Stumpf- und Phantomschmerzen beobachtet – sowohl bei primärer (vorbeugender) TMR bei frischen Amputationsverletzungen als auch für die sekundäre TMR bei bereits existenten schmerzhaften Neuromen.4
Ein ebenso ursprünglich zur Steuerung von bionischen Prothesen entwickeltes Verfahren ist die Einlage des proximalen Nervenstumpfes in ein denerviertes Muskelstück, man spricht von „Regenerative Peripheral Nerve Interface“ (RPNI). Auch diese Technik eignet sich zur Neuromprophylaxe und Therapie existierender Neurome.6
Diskussion
Neuropathische Schmerzen haben viele verschiedene Ursachen und sind für die Betroffenen oft sehr behindernd und psychosozial belastend, teilweise sogar invalidisierend. Im Rahmen jedes chirurgischen oder interventionellen Eingriffes kann es zu Nervenschädigungen kommen, etwa durch eine Durchtrennung von Hautnerven beim Zugang, eine intraoperative akzidentielle Nervenschädigung oder eine ungünstige postoperative Vernarbung mit nachfolgenden Traktionsschmerzen. Entsprechend gehören Verletzungen von Nerven als potenzielle Operationskomplikationen natürlich zur routinemäßigen präoperativen Aufklärung.
Der verantwortungsvolle Chirurg zeichnet sich dadurch aus, dass er mit eventuell auftretenden Komplikationen richtig umgehen kann. Er sollte Komplikationen rasch erkennen und die adäquate Therapie einleiten, um dadurch die besten Chancen auf eine baldige und möglichst vollständige Regeneration zu bieten.
Das Problem bei iatrogenen Nervenverletzungen und Neuromen ist jedoch, dass zwischen dem operativen Eingriff und der nachfolgenden Symptomatik der kausale Zusammenhang oft erst nicht erkannt und die Läsion erst erheblich verzögert behandelt wird. Wie schon erwähnt, ist allerdings genau dieser Zeitfaktor oft entscheidend, weil chronische neuropathische Schmerzen als schwer behandelbar gelten und oft nur mäßige Erfolge erreicht werden.7–9 Die Ursache liegt in den komplexen pathophysiologischen Mechanismen nach Nervenverletzung, die auf peripherer, spinaler und zentraler Ebene auftreten und sich im Verlauf mit zunehmender Chronifizierung verändern.10 Dies gilt sowohl für konservative rehabilitative Maßnahmen, medikamentöse Therapien oder nachfolgende Operationen. Das somatosensorische System reagiert nach einer Nervenverletzung auf sinnvolle sensorische Reize mit einer schnelleren Regeneration, wodurch sich das Risiko für ein Schmerzsyndrom erheblich vermindert.11 Lange bestehende Neuropathien gelten auch schmerzmedizinisch als schwierig behandelbar.8 Ein hoher Analgetikabedarf kann bis hin zur Abhängigkeitsstörung führen, obwohl eine Schmerzverbesserung durch medikamentöse Therapie in nur 30–40% erreicht wird.12 Beim Auftreten von Neuromen unterziehen sich viele Betroffene einer chirurgischen Neuromexzision (66%), mit einer Beschwerdebesserung von jedoch nur 77%.13 Die Rezidivrate ist hoch, die Reoperationsrate liegt bei bis zu 27% – mit abnehmender Erfolgsrate, je häufiger operiert wird.6, 14
Um das Zeitintervall zwischen Läsion und Therapie also möglichst kurz zu halten, ist eine rasche und zielgerichtete Diagnosestellung notwendig. Diese hat in den letzten Jahren eine gravierende Veränderung durch die neuesten technologischen Entwicklungen, hier vor allen Dingen den hochauflösenden Ultraschall, erfahren. Mit dieser Bildgebung, die selbst Hautnerven mit 1–2 Millimeter Durchmesser bis in die Faszikelstruktur darstellen kann, gelingen eine sehr frühe differenzierte Beurteilung und Behandlung der Pathologie. Neben der subtilen Kenntnis der Anatomie und der verschiedenen Pathomechanismen und daraus resultierenden Nervenläsionen ist die interdisziplinäre Zusammenarbeit zwischen Chirurgie, Neurologie und Radiologie ein entscheidender Fortschritt.
Schlussfolgerungen
Die chirurgische Behandlung neuropathischer Schmerzsyndrome ist ein Spezialgebiet der peripheren Nervenchirurgie, das stetig an Wichtigkeit gewinnt.
Es erfordert einen großen diagnostischen und chirurgischen Erfahrungsschatz, um schnell und gezielt die richtige Diagnose zu finden und gegebenenfalls die Indikation zur operativen Therapie zu stellen.
Neben herkömmlichen Methoden, wie der Neuromentfernung und Stumpfversenkung, sollten auch neuartige rekonstruktive Ansätze berücksichtigt werden. Diese versuchen, den unvermeidlich auswachsenden Nervenfasern ein neues Zielorgan anzubieten. So kann in vielen Fällen die Ausbildung von schmerzhaften Neuromen verringert und auch die chronische Schmerzsituation vieler Patienten verbessert werden.
Literatur:
1 Salminger S et al.: Immediate and secondary reconstruction of iatrogenic nerve lesions. Chir Prax 2014; 78: 625-37 2 Riegler G et al.: Ultrasound anatomic demonstration of the infrapatellar nerve branches. Arthroscopy 2018; 34: 2874-83 3 Aszmann OC et al.: Die Behandlung chronisch schmerzhafter Neurome mittels End-zu-Seit Neurorraphie. Handchir Mikrochir Plast Chir 2010; 42: 225-32 4 Souza JM et al.: Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clin Orthop Relat Res 2014. Epub ahead of print 2014. Doi: 10.1007/s11999-014-3528-7 5 Dumanian GA et al.: Targeted muscle reinnervation treats neuroma and phantom pain in major limb amputees: a randomized clinical trial. Ann Surg. Epub ahead of print 26 October 2018. Doi: 10.1097/SLA.0000000000003088 6 Vlot MA et al.: Symptomatic neuroma following initial amputation for traumatic digital amputation. J Hand Surg Am 2018; 43: 86.e1-86.e8 7 Stokvis A et al.: Insufficient pain relief after surgical neuroma treatment: prognostic factors and central sensitisation. J Plast Reconstr Aesthet Surg 2010; 63: 1538-43 8 Kern U et al.: Phantom limb pain in daily practice – still a lot of work to do! Pain Med 2012; 13: 1611-26 9 Kent ML et al.: Perioperative pain management strategies for amputation: a topical review. Pain Med 2017; 18: 504-19 10 Navarro X et al.: Neural plasticity after peripheral nerve injury and regeneration. Prog Neurobiol 2007; 82: 163-201 11 Rosén B, Lundborg G: Sensory re-education after nerve repair: aspects of timing. Handchir Mikrochir Plast Chir 2004; 36: 8-12 12 Decrouy-Duruz V et al.: Evaluation of surgical treatment for neuropathic pain from neuroma in patients with injured peripheral nerves. J Neurosurg 2018; 128: 1235-40 13 Poppler LH et al.: Surgical interventions for the treatment of painful neuroma: a comparative meta-analysis. Pain 2018; 159: 214-23 14 Guse DM, Moran SL: Outcomes of the surgical treatment of peripheral neuromas of the hand and forearm: a 25-year comparative outcome study. 2013; 71: 654-8
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...