Systemische Therapie des fortgeschrittenen HCC
Bericht:
Dr. Norbert Hasenöhrl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Erstlinienbehandlung des fortgeschrittenen hepatozellulären Karzinoms hat sich verändert. Heute werden hier meist Immuncheckpointinhibitoren gegeben – allerdings nicht nach Lebertransplantation. Die Frage der Zweitlinientherapie ist noch nicht restlos geklärt. Eine Möglichkeit scheint in einer ICI-Rechallenge zu bestehen, wie der Wiener Hepatologe Ap. Prof. Priv.-Doz. Dr. Matthias Pinter im Rahmen der OeGHO-Frühjahrstagung berichtete.
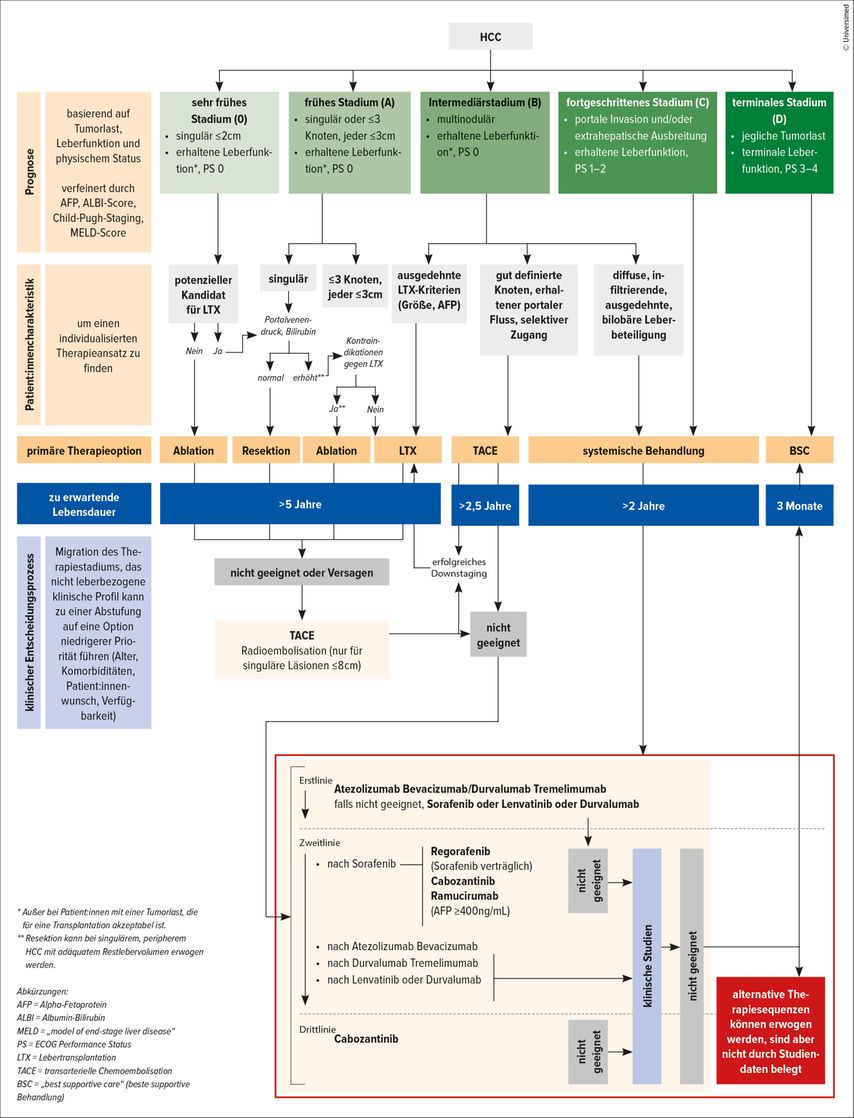
Das sogenannte „Barcelona Clinic Liver Cancer“(BCLC)-Stagingsystem wird zur Stadieneinteilung des hepatozellulären Karzinoms (HCC) verwendet.1 Das HCC macht etwa 75% aller primären Lebertumoren aus, während die meisten anderen Fälle Cholangiokarzinome sind.2
Aufgrund einer Reihe rezenter Entwicklungen musste die BCLC-Klassifikation aus 2018 mit einem Update versehen werden, das 2022 publiziert wurde.1 Abbildung 1 zeigt den Therapiealgorithmus in dieser aktuellen Version. Die genannten Fortschritte und somit auch das Update beziehen sich vor allem auf die Therapie des fortgeschrittenen HCC („Advanced HCC“ – aHCC), also des Stadiums C der Klassifikation.
Hier geht es um systemische Therapien bei Karzinomen mit portaler Invasion und/oder extrahepatischer Ausbreitung bei erhaltener Leberfunktion und einem ECOG Performance Score von 1 oder 2. In dieser Indikation haben Immuntherapeutika die zuvor verwendeten Tyrosinkinaseinhibitoren (TKI) Sorafenib und Lenvatinib aus der Erstlinie verdrängt.1
Erstlinienbehandlung
IMbrave150 war eine globale, offene Phase-III-Studie, an der 501 Patient:innen mit nicht resektablem HCC teilnahmen.3 Sie wurden im Verhältnis 2:1 zu einer Therapie mit dem PD-L1-Antikörper Atezolizumab plus dem VEGF-Antikörper Bevacizumab (n=336) oder dem TKI Sorafenib (n=165) randomisiert. Die koprimären Endpunkte waren das Gesamtüberleben (OS) und das progressionsfreie Überleben (PFS) in der „Intention to treat“(ITT)-Population.
In der primären Analyse war unter Atezolizumab/Bevacizumab die Hazard-Ratio (HR) für Tod 0,58 im Vergleich zu Sorafenib (p<0,001). Das OS nach zwölf Monaten betrug 67,2% unter Atezolizumab/Bevacizumab und 54,6% unter Sorafenib. Das mediane PFS lag bei 6,8 bzw. 4,3 Monaten.
Unerwünschte Wirkungen (AE) der Grade 3 oder 4 traten bei 56,5% bzw. 55,1% auf. Unter Atezolizumab/Bevacizumab war bei 15,2% eine Hypertonie Grad 3 oder 4 zu verzeichnen, andere höhergradige toxische Effekte waren hingegen selten. Nach etwas längerer Beobachtungszeit von 15,6 Monaten blieben sowohl die Wirksamkeits- als auch die Sicherheitsdaten im Wesentlichen erhalten.4
In der HIMALAYA-Studie wurde der PD-L1-Inhibitor Durvalumab, einerseits in Kombination mit einer einmaligen Dosis des CTLA4-Antikörpers Tremelimumab, andererseits in Monotherapie, mit Sorafenib verglichen.5 Primärer Endpunkt war das OS. 1171 Patient:innen mit nicht resektablem HCC und ohne vorhergegangene systemische Behandlung nahmen teil. Es zeigte sich, dass Patient:innen unter der Kombination Tremelimumab/Durvalumab (STRIDE) hinsichtlich des OS signifikant besser abschnitten als unter Sorafenib (HR 0,78). Die Durvalumab-Monotherapie war bezüglich des OS der Therapie mit Sorafenib nicht unterlegen. Die OS-Rate nach 36 Monaten betrug 30,7% unter STRIDE, 24,7% unter Durvalumab-Monotherapie und 20,2% unter Sorafenib.
Diese Daten führten dazu, dass nunmehr Atezolizumab/Bevacizumab bzw. Tremelimumab/Durvalumab die Erstlinienbehandlung bei HCC Stadium C darstellen. Sind diese Therapien nicht möglich, so sollten Sorafenib oder Lenvatinib in Monotherapie gegeben werden. Die Zulassung für eine Durvalumab-Monotherapie ist noch ausständig.1
Weitere Studien zur Erstlinie
In der LEAP-002-Studie wurde die Kombination des TKI Lenvatinib mit dem PD-1-Rezeptor-Antikörper Pembrolizumab verglichen mit einer Lenvatinib-Monotherapie. Die koprimären Endpunkte waren OS und PFS. Das mediane OS unter Lenvatinib/Pembrolizumab betrug 21,2 Monate (und war damit das längste bisher berichtete OS in einer Phase-III-Studie der Erstlinie für HCC), unter Lenvatinib-Monotherapie waren es 19,0 Monate. Allerdings erreichte der primäre Endpunkt die vordefinierte statistische Signifikanzgrenze nicht.6
Zwei weitere Phase-III-Studien wurden ebenfalls am ESMO-Kongress vorgestellt. Beiden Studien ist gemeinsam, dass ein hoher Prozentsatz der Teilnehmenden (83% bzw. 75%) aus Asien stammte, sodass die Anwendbarkeit der Ergebnisse auf eine europäische Population nicht ganz sicher ist.
Eine Studie verglich die Kombination Camrelizumab plus Rivoceranib mit Sorafenib. Bei Camrelizumab handelt es sich um einen PD-1-Antikörper, also ein Immuntherapeutikum, während Rivoceranib ein TKI ist. Sowohl hinsichtlich des OS (22,1 vs. 15,2 Monate; p<0,0001) als auch des PFS (5,6 vs. 3,7 Monate; p<0,0001) war die Kombination der Vergleichsgruppe signifikant überlegen.7
Die RATIONALE-301-Studie verglich den PD-1-Antikörper Tislelizumab mit Sorafenib. Hier konnte zwar hinsichtlich des OS (15,9 vs. 14,1 Monate) keine Überlegenheit von Tislelizumab nachgewiesen werden, sehr wohl aber eine Nichtunterlegenheit (p=0,0398).8
Patient:innen nach Lebertransplantation
Es gibt aber Patient:innen, die für eine Immuntherapie nicht uneingeschränkt geeignet sind. Ein systematisches Review analysierte 31 Publikationen, in denen von insgesamt 52 Patient:innen berichtet wurde, die nach einer Lebertransplantation (LTX) Immuncheckpoint-Inhibitoren (ICI) erhalten hatten. Dabei zeigte sich bei 15 Patient:innen (28,8%) eine akute Abstoßungsreaktion, an der sieben Patient:innen (13,4%) starben. Die Krankheitskontrollrate (DCR) lag bei 44,2%, die Gesamtansprechrate (ORR) bei 34,6%. Die Wirksamkeit der ICI scheint also auch in dieser Situation gegeben zu sein, das Risiko für Abstoßung und Tod ist jedoch substanziell, weshalb eine Immuntherapie bei diesen Patient:innen kontraindiziert ist.9
Deshalb sollte bei diesen Patient:innen primär auf eine TKI-Therapie zurückgegriffen werden. Eine retrospektive Studie, an der 31 Patient:innen mit einem HCC-Rezidiv nach LTX teilnahmen, untersuchte die systemische Gabe von Sorafenib. Hier war das mediane OS 19,3 Monate, die mediane Zeit bis zur Progression 6,77 Monate.10 In einem ähnlichen Setting (allerdings mit historischen Kontrollen) wurde Sorafenib mit „best supportive care“ (BSC) verglichen. Hier brachte der TKI eine wesentliche Verbesserung, nämlich ein OS von 21,3 Monaten, während es unter BSC nur 11,8 Monate waren (p=0,0009).11 Insgesamt war das Sicherheitsprofil unter Sorafenib akzeptabel, schwere Toxizitäten waren selten.
Auch Lenvatinib wurde bei LTX-Patient:innen untersucht, konkret waren es 45. Hier fand sich ein medianes OS von 14,5 Monaten. Die Sicherheitsdaten waren vergleichbar mit jenen, die sich bei nicht transplantierten HCC-Patient:innen unter der gleichen Substanz fanden.12
Sequenztherapie
Die Frage, womit behandelt werden soll, wenn in der Erstlinie ein ICI verabreicht wurde, ist heute noch nicht eindeutig zu beantworten, weil dazu Daten aus großen Studien fehlen. Betroffen sind ungefähr 40% bis 50% der HCC-C-Patient:innen nach systemischer Erstlinienbehandlung.
In den BCLC-Leitlinien werden nach Erstlinientherapie mit Sorafenib entweder die TKI Regorafenib oder Cabozantinib oder der VEGF-Rezeptor-2-Antikörper Ramucirumab empfohlen, während nach ICI in der Erstlinie lediglich auf klinische Studien verwiesen wird.1 Auch die ILCA- und die ESMO-Guidelines verweisen nach ICI auf die genannten TKI sowie auf Ramucirumab. Hier kann also – bei sehr niedrigem Evidenzgrad – jede zugelassene Therapie, je nach Verfügbarkeit, verabreicht werden.
Eine retrospektive multizentrische Studie untersuchte anhand von 49 Patient:innen, die zuvor mit Atezolizumab/Bevacizumab behandelt worden waren, eine Zweitlinientherapie mit einem TKI. Dies waren Sorafenib (n=29), Lenvatinib (n=19) oder (in einem Fall) Cabozantinib. Insgesamt ergab sich in dieser Analyse ein medianes OS von 14,7 Monaten. Das mediane PFS war unter Lenvatinib mit 6,1 Monaten signifikant länger als unter Sorafenib (2,5 Monate; p=0,004), während sich beim medianen OS zwar ein numerischer, aber nicht signifikanter Unterschied zeigte (16,6 vs. 11,2 Monate; p=0,347).13
Ein Markov-Modell, also eine statistische Simulation, die auf den verfügbaren Phase-III-Daten beruhte, ergab, dass mit einer gewissen Wahrscheinlichkeit die Sequenzen Atezolizumab/Bevacizumab → Lenvatinib oder Atezolizumab/Bevacizumab → Sorafenib die längsten Überlebenszeiten bringen.14 Dies muss jedoch natürlich durch randomisierte, kontrollierte Studien bestätigt werden.
Die Frage, ob eine ICI-Behandlung in der Zweitlinie effektiv ist, wenn schon in der Erstlinie ICI verabreicht worden sind, ist derzeit nur sehr vorläufig zu beantworten. In einer internationalen, retrospektiven Studie erhielten 58 Patient:innen mit aHCC zwei Linien mit einem ICI. Hier fand sich eine ORR von 22% in der ersten und von 26% in der zweiten ICI-Linie, die DCR betrug 59% bzw. 55% und die mediane Zeit bis zur Progression (TTP) lag bei 5,4 bzw. 5,2 Monaten. Auch die Zahl der AE Grad 3 und 4 unterschieden sich zwischen den beiden Linien nicht wesentlich. Diese Daten stellen jedenfalls ein Rationale für prospektive Studien zur Frage einer ICI-Rechallenge dar.15
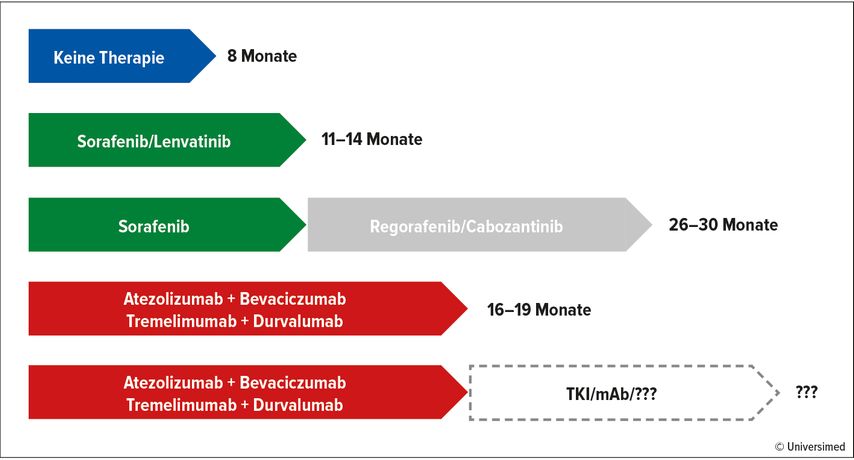
Abbildung 2 gibt einen Überblick über die medianen OS-Zeiten für verschiedene therapeutische Ansätze bei aHCC.
Abb. 2: Medianes Gesamtüberleben bei verschiedenen Therapien. Modifiziert nach Cheng AL et al., Abou- Alfa GK, Llovet JM et al., Kudo M et al., Finn RS et al. & Kelly RK et al. 20204,5,16–19
Fazit
-
Atezolizumab plus Bevacizumab sind heute Referenzstandard in der Erstlinientherapie des aHCC.
-
Durvalumab plus Tremelimumab sind die erste zugelassene duale ICI-Therapie bei aHCC in der Erstlinie.
-
Bei Rezidiv nach Lebertransplantation sind nach wie vor TKI die Therapie der Wahl in der Erstlinie.
-
Im Vergleich zu Sorafenib ist Camrelizumab + Rivoceranib überlegen und Tislelizumab nicht unterlegen. Dies wurde allerdings in vorwiegend asiatischen Studienpopulationen (83% und 75%) gezeigt.
-
Für die Sequenztherapie kann gesagt werden:
- Wenn Sorafenib in der Erstlinie gegeben wurde, kommen Regorafenib, Cabozantinib und Ramucirumab infrage (Evidenzlevel I, A).
- Ansonsten können alle zugelassenen Therapien je nach Verfügbarkeit, Nebenwirkungsprofil und Komorbiditäten verabreicht werden (Evidenzlevel V, C).
Quelle:
Dieser Text beruht auf einem Vortrag, den Ap. Prof. Priv.-Doz. Dr. Matthias Pinter, PhD, Universitätsklinik für Innere Medizin III, MedUni Wien, bei der Frühjahrstagung der OeGHO gehalten hat.
Literatur:
1 Reig M et al.: BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update. J Hepatol 2022; 76(3): 681-93 2 McGlynn KA et al.: Epidemiology of hepatocellular carcinoma. Hepatology 2021; 73(Suppl 1): 4-13 3 Finn RS et al.: Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020; 382(20): 1894-905 4 Cheng AL et al.: Updated efficacy and safety data from IMbrave150: atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 2022; 76(4): 862-73 5 Abou-Alfa GK et al.: Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evidence 2022; 1(8): EVIDoa2100070 6 Finn RS et al.: Primary results from the phase III LEAP-002 study: Lenvatinib plus pembrolizumab versus lenvatinib as first-line (1L) therapy for advanced hepatocellular carcinoma (aHCC). ESMO 2022. Abstr. #LBA34 7 Qin S et al.: Camrelizumab (C) plus rivoceranib (R) vs. sorafenib (S) as first-line therapy for unresectable hepatocellular carcinoma (uHCC): a randomized, phase III trial. ESMO 2022. Abstr. #LBA35 8 Qin S et al.: Final analysis of RATIONALE-301: randomized, phase III study of tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. ESMO 2022. Abstr. #LBA36 9 Kayali S et al.: Immune checkpoint inhibitors in malignancies after liver transplantation: a systematic review and pooled analysis. Liver Int 2023; 43(1): 8-17 10 Gomez-Martin C et al.: Efficacy and safety of sorafenib in combination with mammalian target of rapamycin inhibitors for recurrent hepatocellular carcinoma after liver transplantation. Liver Transpl 2012; 18(1): 45-52 11 Sposito C et al.: Comparative efficacy of sorafenib versus best supportive care in recurrent hepatocellular carcinoma after liver transplantation: a case-control study. J Hepatol 2013; 59(1): 59-66 12 Bang K et al.: Efficacy and safety of lenvatinib in patients with recurrent hepatocellular carcinoma after liver transplantation. Cancer Med 2023; 12(3): 2572-9 13 Yoo C et al.: Clinical outcomes with multikinase inhibitors after progression on first-line atezolizumab plus bevacizumab in patients with advanced hepatocellular carcinoma: a multinational multicenter retrospective study. Liver Cancer 2021; 10(2): 107-14 14 Cabibbo G et al.: First-line immune checkpoint inhibitor-based sequential therapies for advanced hepatocellular carcinoma: rationale for future trials. Liver Cancer 2022; 11(1): 75-84 15 Scheiner B et al.: Efficacy and safety of immune checkpoint inhibitor rechallenge in individuals with hepatocellular carcinoma. JHEP Rep 2023; 5(1): 100620 16 Llovet JM et al.: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359(4): 378-90 17 Kudo M et al.: Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: arandomised phase 3 non-inferiority trial. Lancet 2018; 391(10126): 1163-73 18 Finn RS et al.: Outcomes of sequential treatment with sorafenib followed by regorafenib for HCC: Additional analyses from the phase III RESORCE trial. J Hepatol 2018; 69(2): 353-8 19 Kelley RK et al.: Second-line cabozantinib after sorafenib treatment for advanced hepatocellular carcinoma: a subgroup analysis of the phase 3 CELESTIAL trial. ESMO Open 2020; 5(4): e000714
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...