Subtypisierung des neuroendokrinen kleinzelligen Karzinoms – relevant für die Therapie?
Autor:
Univ.-Prof. Dr. Helmut Popper
Institut für Pathologie
Medizinische Universität Graz
E-Mail: helmut.popper@medunigraz.at
SCLC und LCNEC zeigen beide die Expression neuroendokriner Gene. Eine Zuordnung der Expressionsmuster zu therapeutischen Targets könnte für die Wahl der Therapie von Bedeutung sein. Insbesondere die Aurorakinase A ist ein vielversprechendes Ziel für therapeutische Ansätze.
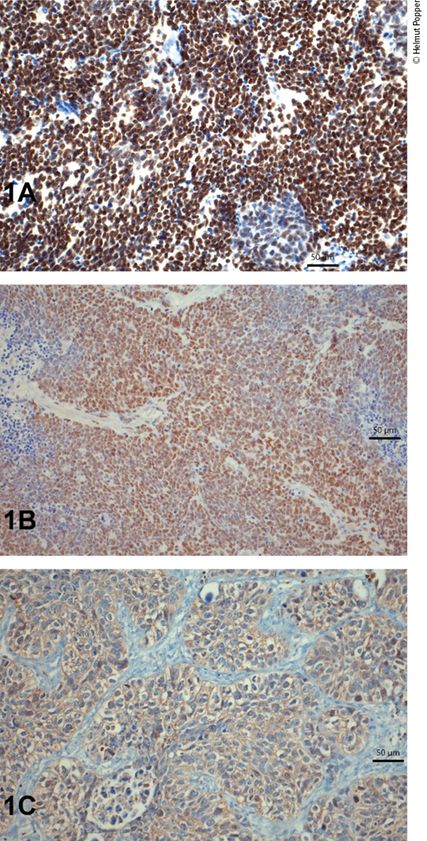
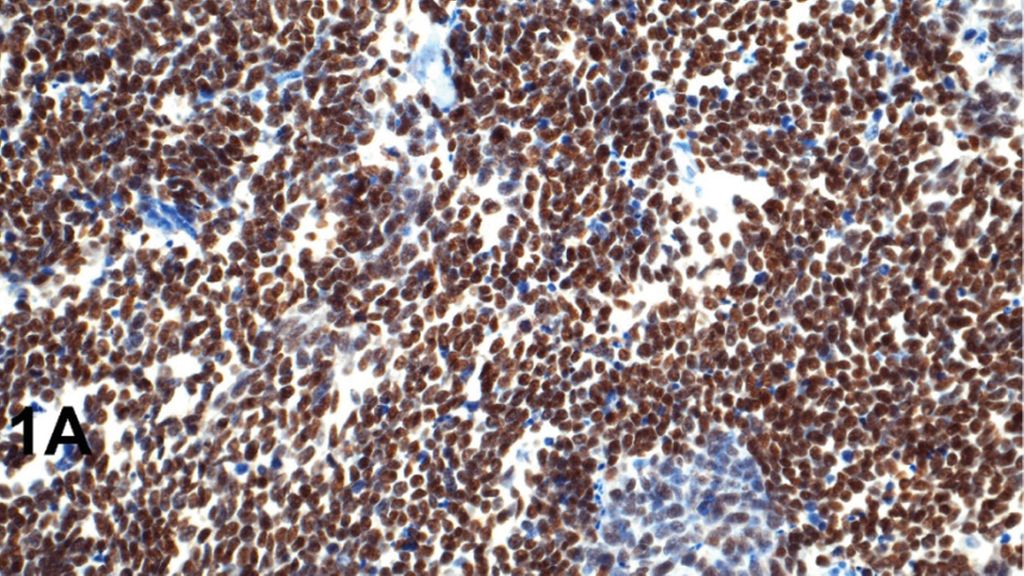
Abb. 1: A) SCLC positiv für ASCL1, B) SCLC positiv für NeuroD, C) SCLC positiv für Aurorakinase A. Für die neuroendokrinen Mastergene findet sich eine Expression in den Tumorzellkernen, während die Reaktion für die Kinase typischerweise zellmembranständig ist. Maßstabbalken 50µm
Das kleinzellige neuroendokrine Karzinom (SCLC) wurde anhand von Befunden aus Zellkulturen subtypisiert. Folgende neuroendokrine Gene wurden nachgewiesen: „achaete-scute family BHLH transcription factor 1“ (ASCL1), „neuronal differentiation 1“ (NeuroD), „POU class 2 homeobox 3“ (POU2F3), und „yes 1 associated transcriptional regulator“ (YAP1).1 In einer Folgestudie wurde versucht, dies mithilfe von immunhistochemischen Färbungen an einer Serie von SCLC nachzuweisen.2 Während alle SCLC mit positiver Reaktion für ASCL1 und NeuroD auch neuroendokrine Marker exprimierten (NCAM, ISNM1, Synaptophysin, Chromogranin A), waren die POU2F3-positiven SCLC negativ für die neuroendokrinen Marker. SCLC mit Expression von YAP1 zeigten Expressionen für ASCL1, NeuroD oder POU2F3, sodass die Autoren anzweifelten, ob YAP1 als ein Subtyp für SCLC angesehen werden kann.
In unserer Studie folgten wir diesem wissenschaftlichen Ansatz einer Unterteilung des SCLC, schlossen aber auch Fälle des zweiten hochmalignen neuroendokrinen Karzinoms „large cell neuroendocrine carcinoma“ (LCNEC) ein und untersuchten weiters, ob es für diese Karzinome therapierelevante Expressionsmuster gibt.
In einem ersten Ansatz wurden SCLC und LCNEC in einem Gewebearray untersucht. Eine Expression von ASCL1 und NeuroD fand sich bei 40% der SCLC und 27% der LCNEC. 18 bzw. 6% der SCLC und LCNEC exprimierten POU2F3, noch geringer war eine Positivität für YAP1 beim SCLC zu finden, während über 40% YAP1-positive Fälle beim LCNEC gefunden wurden. Interessanterweise fanden wir ebenso wie Baine et al.2 Koexpressionen für ASCL1 und NeuroD (8 in SCLC und 8 in LCNEC), während keine Kombination in POU2F3-positiven Fällen zu sehen war.
Mehrere therapeutische Targets (Hemmstoffe) sind bei beiden hoch-malignen neuroendokrinen Karzinomen in Evaluierung: „fibroblast growth factor receptor 1 and 2“ (FGFR1, FGFR2), C-Myc-Onkogen und Aurorakinase A. Während sowohl bei FGFR1 und -2 und C-Myc nur sehr wenige Fälle eine positive Reaktion aufwiesen, fand sich eine positive Reaktion für Aurorakinase A bei 95% der SCLC bzw. 66% der LCNEC. Es fand sich ein tendenziell höherer Prozentsatz an positiven Fällen mit NeuroD bzw. kombinierter NeuroD/ASCL1-Expression, aber kein signifikantes Muster an Zuordnung zu einem der neuroendokrinen Mastergene.
Diskussion
SCLC wird in der überwiegenden Zahl der Fälle sehr spät diagnostiziert. Zumeist sind die Patienten bereits im klinischen Stadium IV (also metastasiert). Nicht viel besser ist die Situation beim LCNEC – auch hier sind die Patienten zumeist im Stadium III oder IV. Für beide hochmalignen neuroendokrinen Karzinome der Lunge gibt es nach wie vor keine neuen Therapieoptionen im Stadium IIIB und IV. SCLC wird klassisch mittels Chemo- und Strahlentherapie behandelt, während die Therapie beim LCNEC nicht einheitlich ist: Hier wird seit Jahren entweder mit einer Chemotherapie nach dem „Kleinzellerschema“ behandelt oder eine Cisplatin-basierte Therapie wie bei den NSCLC angewandt. Zwar ist in den letzten Jahren durch das molekulare Profil für das LCNEC eine neue Zuordnung möglich geworden, indem LCNEC mit Verlust von RB1-Gen besser auf die Kleinzellertherapie anspricht, während für LCNEC mit PTEN-Verlust eher eine NSCLC-Therapie anzuraten wäre. Neue Optionen für das SCLC haben sich mit einer Kombination von Immuntherapie (z.B. Atezolizumab) und Chemotherapie ergeben, dazu gibt es eine noch laufende klinische Studie.3,4
Auch zur Aurorakinase A gibt es derzeit eine klinische Studie in Kombination mit Chemotherapie.5–7 Aufgrund der großen Zahl der SCLC und LCNEC, die Aurorakinase A exprimieren, dürfte diese Therapie eine echte Alternative für die beiden hochmalignen Karzinome sein.
Inwieweit die Expression der neuroendokrinen Mastergene eine Rolle für die Therapie mit der Kombination Chemotherapie und Hemmung von Aurorakinase A spielen, muss sicher noch in weiteren Studien untersucht werden. Ob diese Mastergene einen Einfluss auf die Prognose und den Verlauf dieser Tumorerkrankung haben, wird ebenfalls noch zu untersuchen sein.
Literatur:
1 Rudin CM et al.: Molecular subtypes of small cell lung cancer: a synthesis of human and mouse model data. Nat Rev Cancer 2019; 19(5): 289-97 2 Baine MK et al.: SCLC subtypes defined by ASCL1, NEUROD1, POU2F3, and YAP1: a comprehensive immunohistochemical and histopathologic characterization. J Thorac Oncol 2020; 15(12): 1823-35 3 Mansfield AS et al.: Safety and patient-reported outcomes of atezolizumab, carboplatin, and etoposide in extensive-stage small-cell lung cancer (IMpower133): arandomized phase I/III trial. Ann Oncol 2020; 31(2): 310-7 4 Liu SV et al.: Updated overall survival and PD-L1 subgroup analysis of patients with extensive-stage small-cell lung cancer treated with atezolizumab, carboplatin, and etoposide (IMpower133). J Clin Oncol 2021; 39(6): 619-30 5 Du R et al.: Targeting AURKA in cancer: molecular mechanisms and opportunities for cancer therapy. Mol Cancer 2021; 20(1): 15 6 Gong X et al.: Aurora A kinase inhibition is synthetic lethal with loss of the RB1 tumor suppressor gene. Cancer Discov 2019; 9(2): 248-63 7 Yan M et al.: Aurora-A kinase: a potent oncogene and target for cancer therapy. Med Res Rev 2016; 36(6): 1036-79
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...