Spannende Antworten auf offene Fragen am EHA 2022
Autor:
Univ.-Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder2
Priv.-Doz. Dr. Niklas Zojer, PhD2
1 Wilhelminen-Krebsforschungsinstitut
c/o 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie
und Palliativmedizin
Klinik Ottakring, Wien
2 1. Medizinische Abteilung
Zentrum für Onkologie,
Hämatologie und Palliativmedizin
Klinik Ottakring, Wien
Zum ersten Mal seit 2019 wurde der Kongress der European Hematology Association wieder als „Facetoface“-Meeting abgehalten, wobei die Möglichkeit einer virtuellen Teilnahme angeboten wurde. Zum Thema multiples Myelom gab es erwartungsgemäß zahlreiche Neuerungen.
Neu diagnostizierte, für die Transplantation geeignete Patienten
Was bringt die „Early on“-ASCT?
Paul Richardson stellte die in Nordamerika generierten Ergebnisse der DETERMINATION-Studie vor, die im Wesentlichen dasselbe Konzept wie die bereits publizierte Studie der IFM-Gruppe (IFM 2009) verfolgte – allerdings mit der Ausnahme, dass in der DETERMINATION-Studie die Erhaltungstherapie mit Lenalidomid bis zum Progress bzw. bis zur Unverträglichkeit verabreicht wurde.
Insgesamt wurden 722 Patienten in zwei Gruppen – mit oder ohne Stammzelltransplantation (ASCT) – randomisiert (RVD x 3-ASCT-RVD x 2 vs. RVD x 8). Beide Gruppen erhielten anschließend eine Erhaltungstherapie mit Lenalidomid. Patienten, die nach konventioneller Induktionstherapie (ohne ASCT) relapsierten, sollten eine Rescue-ASCT erhalten. Somit sollte der Einfluss einer ASCT im Rahmen der Induktionstherapie mit einer ASCT zum Zeitpunkt des Rezidivs evaluiert werden. Die Nachbeobachtungszeit betrug etwas mehr als 6 Jahre.
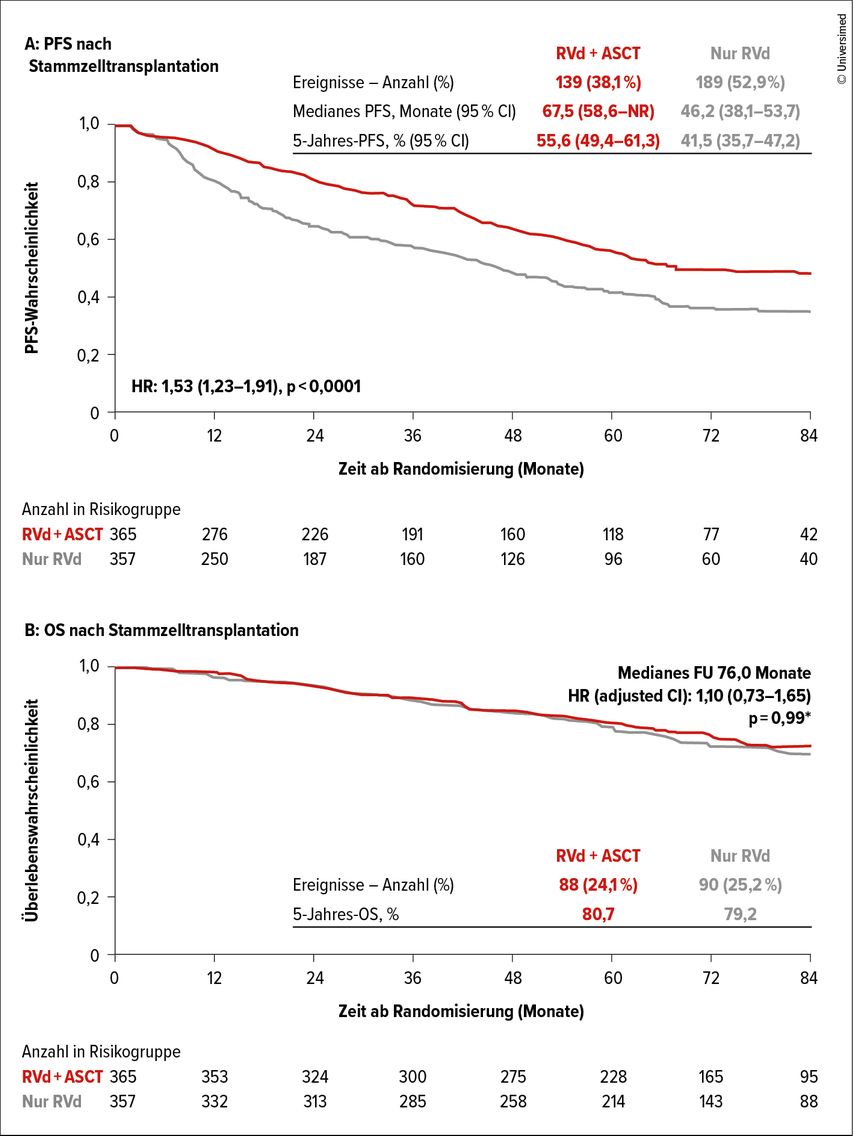
Die Ergebnisse zeigten erwartungsgemäß eine signifikante Verlängerung des medianen progressionsfreien Überlebens (PFS 67,6 vs. 46,2 Monate; Abb. 1A) mit einer frühen ASCT im Rahmen der Induktionstherapie, jedoch keine signifikante Verlängerung der Gesamtüberlebenszeit (OS; Abb. 1B). Somit können Befürworter der ASCT auf die Verlängerung des PFS1 hinweisen, während Befürworter einer konventionellen Induktionstherapie auf das verkürzte PFS nach Rezidiv primär transplantierter Patienten verweisen können, was letztlich dazu führt, dass die ASCT in der Gesamtgruppe der Patienten keinen Überlebensvorteil bringt (OS-Rate nach 4 Jahren: 84% vs. 85%). Allerdings erhielt in der konventionellen Gruppe (ohne ASCT) nur ein kleiner Anteil der Patienten beim Rezidiv eine ASCT. Diese Ergebnisse befördern natürlich die Diskussion um den Stellenwert der ASCT im Rahmen der Induktionstherapie.
Abb. 1A+B: DETERMINATION-Studie: signifikant längeres PFS durch Stammzelltransplantation (1A), jedoch kein Unterschied im Gesamtüberleben (1B). Modifiziert nach Paul Richardson et al.; EHA 2022; Abstract #LBA2326
Mit hochdosiertem Melphalan wird eine höhere Rate an Befunden mit≥Komplettremission (CR-Rate 62% vs. 52%) sowie an MRDneg (10-5) erreicht (52,1% vs. 37,3%; Abb. 1C) und bei Patienten mit Hochrisiko-Zytogenetik ein längeres PFS erzielt. Alsbesonders vorteilhaft erwies sich die ASCT bei Patienten mit t(4;14), während bei jenen mit einer del17p eine numerische, aber nicht signifikante Verlängerung des PFS zu verzeichnen war. Inwieweit sich dies auf die Überlebenszeit der betroffenen Gruppen auswirkt wurde nicht gezeigt, weshalb angenommen werden kann, dass derzeit kein signifikanter Vorteil zu erkennen ist.
Abb. 1C: DETERMINATION-Studie: PFS bei Patienten in Abhängigkeit von MRD-Status und Therapiearm. Modifiziert nach Paul Richardson et al.; EHA 2022; Abstract #LBA2326
Das bemerkenswert lange PFS (67,6 vs. 46,2 Monate) im Vergleich zur IFM-2009-Studie (46,2 vs. 42 Monate) haben die Autoren auf die kontinuierliche Verabreichung der Lenalidomid-Erhaltungstherapie zurückgeführt, die ja in der französischen Studie mit maximal einem Jahr begrenzt war. Sekundäre primäre Malignome (SPM) wurden bei 10,7% respektive 10,4% der Patienten beobachtet, wobei im ASCT-Arm mehr hämatologische Malignome (AML/MDS/ALL 13 vs. 7) auftraten. Erwartungsgemäß traten unter der ASCT mehr Nebenwirkungen auf, die zu einer passageren Verschlechterung der Lebensqualität geführt haben.
KRd statt R in der Erhaltungstherapie?
Dominik Dytfeld präsentierte die Ergebnisse einer prospektiv randomisierten Erhaltungstherapiestudie (ATLAS-Studie). 180 Patienten nach Stammzelltherapie und unterschiedlicher Induktionsbehandlung (<12 Monate) wurden in Gruppen mit KRd bzw. R-Erhaltungstherapie randomisiert. KRd war für 36 Zyklen geplant; danach sollte die Therapie deeskaliert und auf Lenalidomid kontinuierlich reduziert werden. Patienten mit Standard-Risiko(SR)- Zytogenetik, die nach 6 Zyklen MRD-negativ wurden, konnten die Tripeltherapie bereits nach 8 Zyklen beenden und wurden auf alleinige Lenalidomid-Erhaltungstherapie umgestellt. Primäres Studienziel war das PFS in beiden Armen.
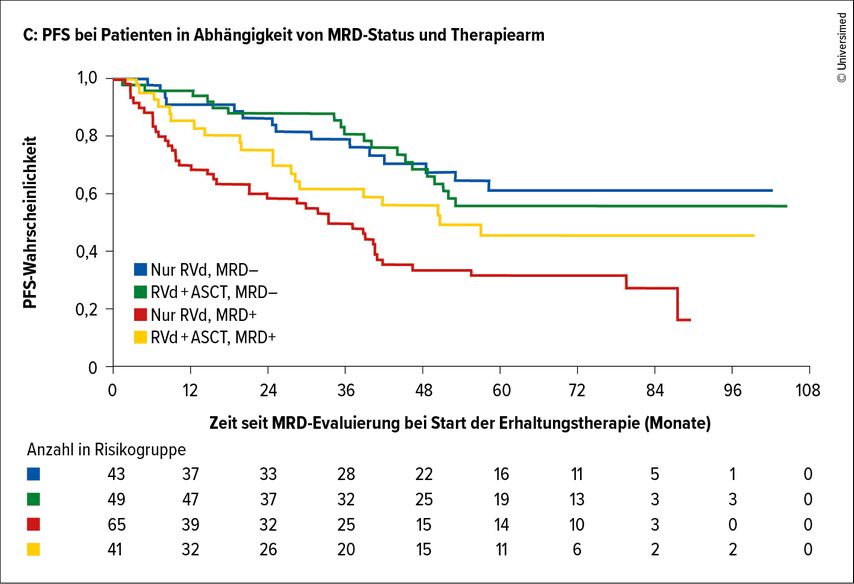
Nach 6 Zyklen erreichten 47% der Patienten im KRd- und 29% im Lenalidomid-Arm einen MRDneg-Status. Die Progressionsrate lag nach einem medianen Follow-up (FU) von 33 Monaten bei 25% und 44% der Patienten im KRd- bzw. R-Arm. Dementsprechend wurde mit KRd eine signifikante Verlängerung des PFS (59,0 vs. 41,4 Monate, p=0,026; Abb. 2A+B) erreicht. Bezüglich des OS zeigte sich allerdings kein Unterschied (Abb. 2C). Den größten Nutzen von der Tripelkombination hatten Patienten mit SR-Zytogenetik (HR: 0,44; CI: 0,24–0,81), aber auch jene mit HR-Zytogenetik profitierten von der Erhaltungstherapie mit KRd (HR: 0,74; CI: 0,30–1,86). Hämatologische Nebenwirkungen waren in beiden Gruppen vergleichbar, allerdings fanden sich unter KRd mehr Infektionen (15% vs. 6%).
Abb. 2: Ergebnisse der ATLAS-Studie. KRd-Erhaltungstherapie führt zu signifikant längerem PFS im Vergleich zu Lenalidomid-Monotherapie (2A). Standard-Risiko-Patienten, die nach 6 Zyklen Erhaltungstherapie MRDneg waren, wurde ab dem 9. Zyklus nur mehr mit Lenalidomid-Monotherapie weiterbehandelt (2B). Derzeit ist kein Unterschied bzgl. des Gesamtüberlebens zwischen KRd und R-Erhaltungstherapie erkennbar (2C). Modifiziert nach Dominik Dytfeld et al.: EHA 2022; Abstract #S175
Neu diagnostizierte, für die Transplantation nichtgeeignete Patienten
KRd vs. KTd – warum es einen Unterschied macht
Die Ergebnisse der AGMT-Studiengruppe, die die Frage der Nichtunterlegenheit von KTd gegenüber KRd in Bezug auf Ansprechraten bei neu diagnostizierten, nicht für eine Transplantation geeigneten Patienten untersuchthatte, wurden vom Autor dieses Textes, der auch einer der Studienautoren war, präsentiert.
Im zweiten Teil der Studie wurde eine Erhaltungstherapie mit Carfilzomib über 12 Monate mit einer Kontrollgruppe ohne Maintenance verglichen. Insgesamt wurden 123 Patienten mit einem medianen Alter von 75 Jahren randomisiert. Bei 88,1% bzw. 93,3% der Patienten im KRd- bzw. KTd-Arm konnte ein Ansprechen festgestellt werden. Die Rate an ≥VGPR („very good partial response) lag bei 65,6% und 77,4% respektive. MRDneg-Befunde wurden bei 59% und 39% der Patienten in der KRd- bzw. KTd-Gruppe festgestellt. PFS und OS waren in beiden Gruppen vergleichbar, wobei das mediane PFS im KRd-Arm bei 34,4 und in der KTd-Gruppe bei 25,3 Monaten lag (p=0,853). Die mediane Überlebenszeit unter KRd lag bei 52,2 Monaten, während der Median unter KTd noch nicht erreicht wurde (p=0,463).
Subanalysen zeigten ein signifikant kürzeres PFS bei Patienten mit HR-Zytogenetik, außerdem zeigte sich ein numerisch verkürztes OS, der Unterschied erreichte aber nicht statistische Signifikanz. Die Carfilzomib-Erhaltungstherapie führte zu einer numerischen Verlängerung des PFS (25,2 vs. 13,8 Monate, p=0,43), ein statisch signifikanter Unterschied war allerdings nicht zu verzeichnen. Ein hoher Immun-Score, definiert durch die Verteilung verschiedener Zellpopulationen wie z.B. regulatorischer T-Zellen, natürlicher Killerzellen und anderer, war mit einem kürzeren PFS verknüpft.
Grad-3/4-Thrombopenie und -Neutropenie waren unter KRd häufiger, ebenso wie kardiale Nebenwirkungen und Exanthemesowie Grad-1/2-Durchfälle, während unter KTd vermehrt Neuropathien, Konstipation, tiefe Venenthrombosen (DVT) und Grad-1/2-Infektionen zu verzeichnen waren.
Belantamab Mafodotin + Rd in der Erstlinie?
Belantamab Mafodotin (Belamaf), ein Antikörper mit BCMA-Spezifität, der an ein Toxin („maleimidocaproyl monomethyl auristatin F“ [mcMMAF]) gekoppelt ist, wurde bisher ausschließlich bei vorbehandelten Patienten erfolgreich eingesetzt. Beim EHA-Meeting wurde von Evangelos Terpos die Toleranz und Effizienz einer Kombination von Belamaf und Rd bei neudiagnostizierten, älteren Patienten (medianes Alter 72 Jahre) vorgestellt.
Nach einem medianen FU von 4,2 Monaten konnte bei 28 von 34 eingebrachten und evaluierbaren Patienten eine Remissionsrate von 96,4% beobachtet werden. Eine CR wurde bei 14,3% und eine VGPR bei 35,7% der Patienten festgestellt. Als Grad-3/4-Nebenwirkungen wurden vorwiegend Fatigue (36,1%) und Sehschwäche (16,7%) beobachtet, während unter den Grad-1/2-Nebenwirkungen Augensymptome (75,0%), Visusverlust (58,3%) und Keratopathie (50%) am häufigsten zu verzeichnen waren.
Diese Phase-I/II-Studie belegte somit die gute Wirksamkeit dieser Tripelkombination auch in der Erstlinie, es bleibt aber unsicher, wie sich diese Kombination in der Praxis in früher Linie durchsetzen wird.
Neuentwicklungen bei Patienten mit rezidivierter/refraktärer Erkrankung
Belantamab Mafodotin
Belantamab Mafodotin ist mittlerweile in der klinischen Praxis für das rezidivierte/refraktäre Myelom etabliert. Seine beachtliche Wirkung in dieser Indikation wird allerdings durch sein spezifisches Nebenwirkungsprofil, insbesondere die Augentoxizität mit Keratopathie, Visuseinschränkung und Augenbrennen, getrübt.
Belantamab führt in Kombination mit Bortezomib oder Lenalidomid und zuletzt, wie von Ajay Nooka beim EHA-Kongress vorgestellt, in Kombination mit einem Gamma-Sekretase-Inhibitor bei umfangreich vorbehandelten Patienten zu beachtlichen Remissionsraten zwischen 30 und 60%.
Außerdem wurden zwei kleine Studien zu Belantamab-Monotherapie bei Patienten mit Amyloidose von Efstathios Kastritis und Jahanzaib Khwaja präsentiert, wobei in der ersteren 72% der multipel vorbehandelten Patienten ein Ansprechen und in der zweiten Präsentation 54% eine VGPR oder besser erreicht hatten.
Was können die BiTEs Teclistamab und Talquetamab?
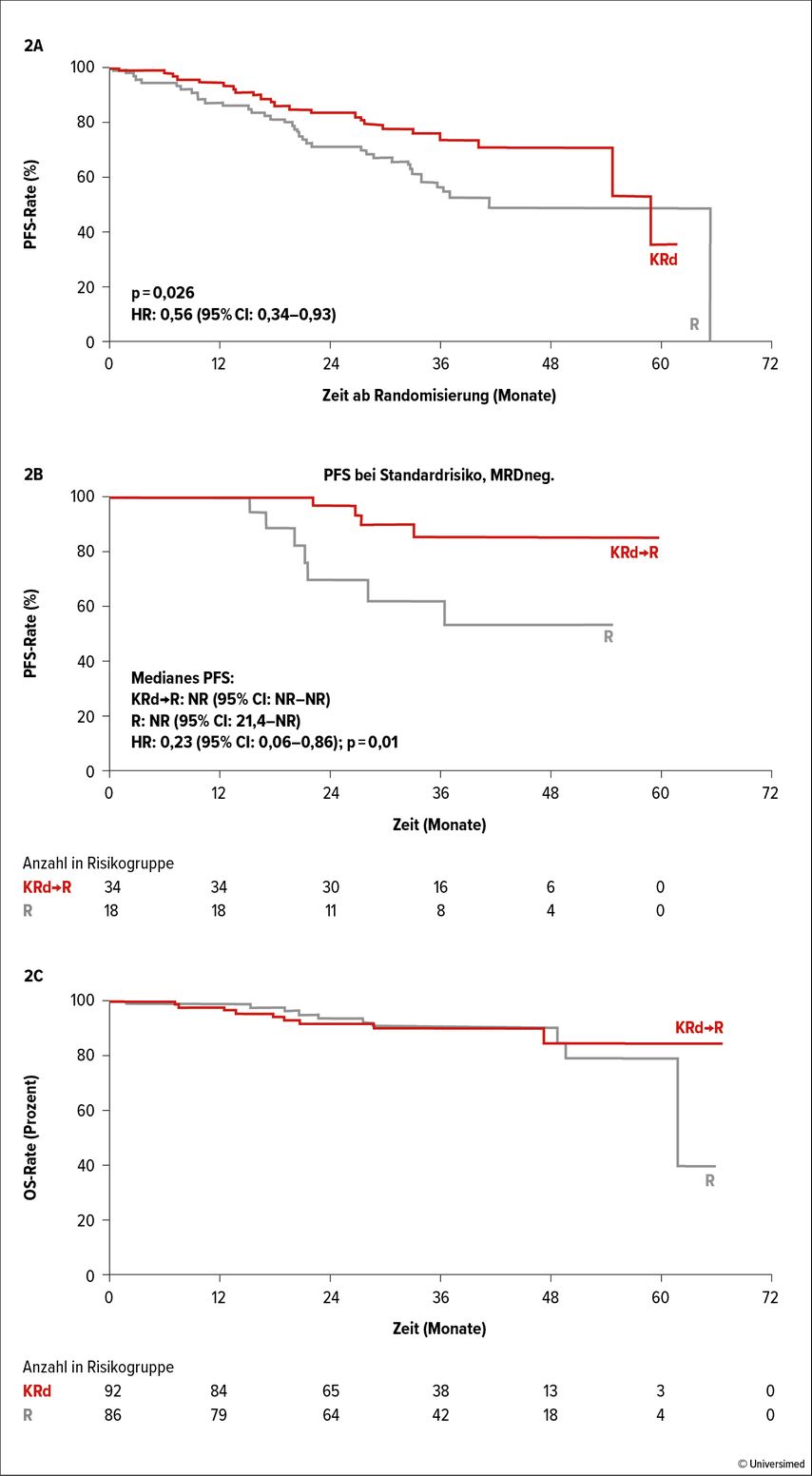
Mittlerweile sind mehrere BiTEs („Bi-specific T-cell engagers“, Tab. 1) in klinischer Prüfung. Nachdem in Österreich „Named patient“-Programme mit Teclistamab und Talquetamab angelaufen sind, soll hier vor allem auf rezente Studiendaten mit diesen BiTEs eingegangen werden.
Teclistamab ist ein humanisiertes IgG4- BiTE mit Bindungsavidität von BCMA und CD3. Cyrille Touzeau präsentierte die Langzeit-FU-Daten (Median 14,1 Monate) der MajesTEC-1-Studie, in die tripelrefraktäre Patienten eingeschlossen wurden. Die Patienten hatten im Median 5 Vortherapielinien und erreichten unter Teclistamab-Monotherapie eine Gesamtansprechrate von 63% und eine ≥VGPR von 39,4%. Das PFS lag bei 11,3 Monaten (CI: 8,8–17,1) und die Ansprechdauer bei 18,4 Monaten.
Infektionen waren die häufigsten nicht-hämatologischen Grad-3/4-Nebenwirkungen (44,8%). Ein Grad-3/4-Zytokinfreisetzungssyndrom (CRS) wurde nur bei einem Patienten beobachtet. Die mediane Dauer von CRS aller Grade lag bei 2 Tagen. Weiters mussten 5 behandlungsbezogene Todesfälle beobachtet werden. Die Ergebnisse dieser Studie wurden fast zeitgleich im „New England Journal of Medicine“ publiziert.
Paula Rodríguez-Otero berichtete über eine Phase-I/II-Studie mit der Kombination Daratumumab (1800mg, s.c.) und Teclistamab SC 1,5–3mg/kg QW oder Q2W mit der primären Zielsetzung, die optimale Dosis für die Kombinationspartner für eine Phase-II-Studie zu ermitteln. In die Studie waren zum Zeitpunkt des Daten-Cut-offs 46 Patienten mit im Median 6 Vortherapielinien aufgenommen worden, wobei 15% mit BCMA-gerichteten Therapien vorbehandelt waren. Von den 37 evaluierbaren Patienten zeigten 29 (78%) ein Ansprechen, 73% hatten mindestens eine VGPR. Die mediane Zeit bis zum Ansprechen lag bei einem Monat, die mediane Dauer des Ansprechens war zum Zeitpunkt der Analyse nicht erreicht. Unter der Kombinationstherapie wurde bei CD38-vortherapierten Patienten ein vermehrter Anteil an CD38+/CD8+ T-Zellen beobachtet, was auf einen möglichen synergistischen Effekt der Kombinationspartner hinweist.
Talquetamab bindet einerseits an GPRC5D – ein Membranprotein, das nicht freigesetzt wird – und an den T-Zell-Rezeptor CD3, was die Aktivierung von T-Zellen befördert. Monique C. Minnema berichtete über ein Update der Phase-I/II-Studie MonumenTAL-1, in die Patienten mit „triple class exposed“ r/r MM eingebracht wurden, wobei auch Patienten, die bereits mit Anti-BCMA-Therapien behandelt wurden, eingeschlossen werden konnten. Als empfohlene Dosis für Phase-II-Studien wurden 405μg/kg, sc qw bzw. 800μg/kg, sc q2w eruiert. Zur Reduzierung des Risikos für ein CRS („cytokine release syndrome“) wurde eine stufenweise Dosiserhöhung vorgenommen. Bei den Patienten mit niedriger und jenen mit höherer Dosis wurde ein objektives Ansprechen bei 70% bzw. 64% und eineVGPR oder besser bei 57% bzw. 52% erzielt. Die Zeit bis zum Ansprechen war mit 0,9 Monaten (Median) kurz.
Häufigste Nebenwirkungen waren Zytopenien (Grad 1/2) und CRS (Grad 1/2: 77% bzw. 80%, Grad 3:3% bzw. 0). Grad-1/2-Infektionen wurden bei 47% bzw. 34% und Grad-3/4-Infektionen bei 7% bzw. 9% der Patienten beobachtet. Zu den ungewöhnlichen Nebenwirkungen zählten Nagelveränderungen (bei 83% bzw. 75%) und Geschmacksveränderungen (bei 63% bzw. 57% der Patienten). Unter beiden Dosierungen wurden vergleichbare pharmakokinetische und pharmakodynamische Profile erhoben.
Neues Konstrukt: Modakafusp Alfa
Bei Modakafusp Alfa handelt es um ein neues Antikörper-Konstrukt. Der Fab-Teil bindet an CD38, während an den Fc-Teil des Antikörpers α-Interferon gebunden ist, wodurch sowohl die angeborene als auch die adaptive Immunität aktiviert und damit ein Anti-Myelom-Effekt induziert wird.
Eine Phase-I-Studie belegt die klinische Wirksamkeit einer Dosis von 1,5mg/kg q4 Wochen bei 30 Patienten mit r/r MM. Die Gesamtansprechrate lag bei 43% und bei jenen mit CD38-Vorbehandlung bzw. Anti-BCMA-Therapie bei 39% bzw. 27%.
Zu den häufigsten Nebenwirkungen zählten Zytopenien (Thrombopenie 73% [Grad 3/4: 47%] und Neutropenie 70% [Grad 3: 30%]). Infusionsbedingte Nebenwirkungen wurden bei 33% der Patienten beobachtet, wovon 3% als Grad 3 eingestuft wurden.
Was sind die wichtigsten Entwicklungen bei denCAR-T-Zellen?
Neben Updates zur KarMMa- und zur CARTITUDE-Studie, die die herausragende Wirksamkeit von BCMA-gerichteten CAR-T-Zellen einmal mehr unter Beweis gestellt haben, verdienen unseres Erachtens zwei Entwicklungen besondere Aufmerksamkeit.
Rascher zum Produkt mit T-ChargeTM …
Die eine betrifft die von Novartis entwickelte T-ChargeTM-Plattform, welche die Produktionszeit von CAR-T-Zellen auf zwei Tage verkürzt. Dies erfolgt unter Anwendung spezieller supportiver Zytokine, die den derart generierten CAR-T-Zellen mehr „Stammzellcharakter“ mit der Fähigkeit zur Replikation und Differenzierung, auch nach Rücktransfusion beim Patienten, verleihen. Es werden daher nur etwa 25% der normalerweise eingesetzten T-Zellen benötigt.
Beim EHA-Meeting wurden von Adam Sperling die rezenten Ergebnisse mit dieser CAR-T-Zell-Plattform berichtet. Bei den bisher 22 behandelten Patienten wurde eine Ansprechrate von 93% erzielt, eine VGPR oder besser konnte bei 53% beobachtet werden. Ein MRDneg(10–6)-Befund wurde bei 33% der Patienten erreicht. Sowohl mit qPCR als auch mit Durchflusszytometrie konnte eine signifikante In-vivo-Expansion der zirkulierenden CAR-T-Zellen (76% der zirkulierenden T-Zellen) mit einem Maximum 14 Tage nach Rückinfusion nachgewiesen werden.
Zu den häufigsten Nebenwirkungen zählten Grad-3-Neutropenie (100%), Anämie (87%) und Thrombopenie (73%). Alle Patienten entwickelten ein CRS, ein Grad-3-CRS wurde allerdings nur bei 2 Patienten registriert. Grad-2-Neurotoxizität wurde bei 24% der Patienten beobachtet.
... oder „In house“-Produktion
Da kommerzielle CAR-T-Zell-Produkte nur in geringer Zahl nach Europa geliefert werden und unser Kontinent Gefahr läuft, ins Hintertreffen zu gelangen, sind mehrere akademische Gruppen dazu übergegangen, eigene CAR-T-Zell-Programme zu etablieren. Dies stellt unseres Erachtens die zweite wesentliche Neuentwicklung dar.
Beeindruckend sind die von Carlos Fernandez De Larrea aus Barcelona präsentierten Ergebnisse mit „in house“ generierten BCMA-CAR-T-Zellen. Die Autoren arbeiten auch mit einem Produktionsverfahren, welches deutlich kürzer als bei kommerziellen CAR-T-Zellen ist. Außerdem haben sie die CAR-T-Zellen fraktioniert verabreicht, wobei bei der ersten Dosis 10% und bei der zweiten und dritten Verabreichung 30% bzw. 60% der CAR-T-Zellen infundiert wurden. Vier Monate nach der ersten Applikation wurde bei Patienten mit stabiler Erkrankung oder besser und guter Toleranz der ersten Infusionen eine vierte Infusion mit 3x10–6/kg CAR-T-Zellen vorgenommen. Von den 28 dafür infrage kommenden Patienten erhielten 24 (86%) eine vierte CAR-T-Zell-Infusion. Eine Lymphodepletion wurde bei 38% dieser Patienten vorgenommen.
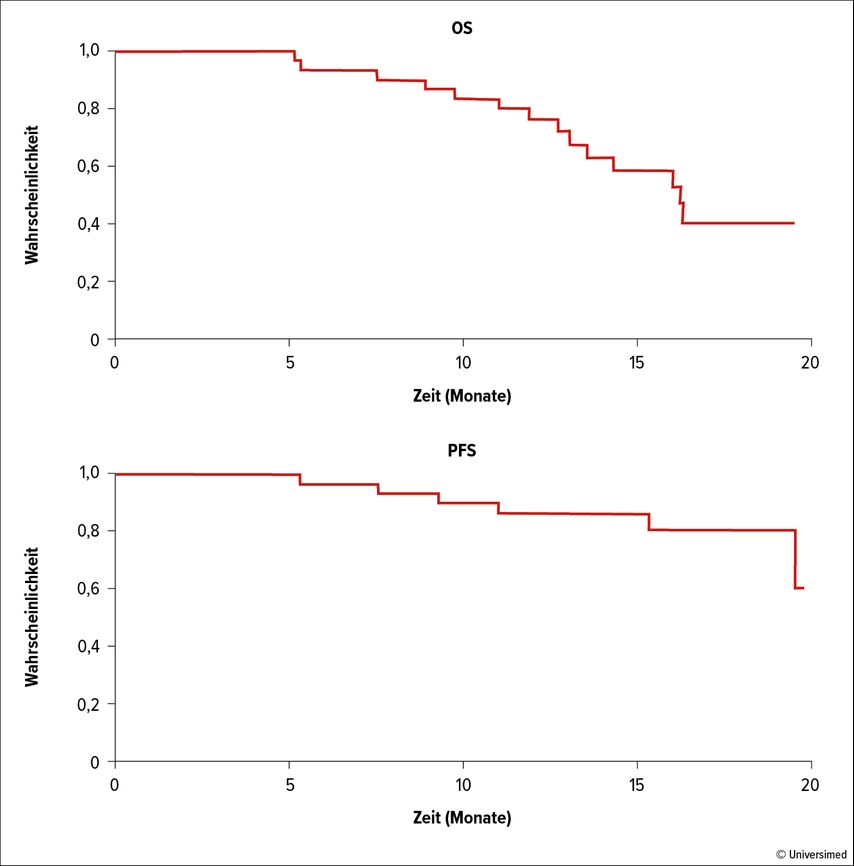
Mit diesem Konzept konnte bei 29% der Patienten eine Verbesserung des Ansprechstatus im Vergleich zum Ergebnis nach Initialtherapie erzielt werden. Insgesamt konnten die Autoren bei den bisher 30 behandelten Patienten eine Ansprechrate von 100% und VGPR oder besser bei 90% sowie einen MRDneg-Status bei 92% der 26 untersuchten Patienten erzielen. Nach einem medianen FU von 16 Monaten sind 53% der Patienten ohne Progression, und die Überlebensrate liegt nach 16 Monaten bei 80% (Abb. 3).
Abb. 3: Progressionsfreies und Gesamtüberleben von 30 Patienten mit einem „in house“ generierten CAR-T-Zell-Konstrukt gegen BCMA. Modifiziert nach Carlos Fernandez De Larrea et al.: EHA2022; Abstract #14
Grad-1/2-CRS wurde bei 87% verzeichnet, jedoch kein Grad-3/4-CRS. Neurotoxizität wurde nicht beobachtet, jedoch erwartungsgemäß ausgeprägte hämatologische Toxizität, und zwar Neutropenie bei 100%, davon 97% Grad 3/4, Anämie bei 85%, davon 43% Grad 3/4, und Thrombopenie bei 79%, davon 70% Grad 3/4.
Nathalie Asherie aus Israel berichtete ebenfalls über Ergebnisse mit einem „in house“ etablierten CAR-T-Zell-Konstrukt bei 20 Patienten mit r/r MM. Ihre Ergebnisse zeigten eine initiale Ansprechrate von 75%.
Interessant in diesem Zusammenhang sind CAR-T-Zellen gegen andere Epitope als BCMA. Mingming Zhang aus China berichtete über die erfolgreiche Etablierung von CAR-T-Zellen gegen GPRC5D und einer Ansprechrate von 100%, allerdings bei einer kleinen Gruppe von 9 Patienten mit r/r MM.
Resümee
Mittlerweile sind immunchemotherapeutische Protokolle Standard in der Erstlinientherapie. Neue Immuntherapien wie BiTEs, Antikörperkonjugate und zelluläre Therapien rücken in frühe Therapielinien vor. Dies ist verständlich, da konventionelle beim Myelom eingesetzte Therapeutika als Monotherapie Ansprechraten von maximal 40% erreichen. Da mit den neuen Immuntherapeutika ein weit höherer Wirkungsgrad erreicht wird, scheint es sinnvoll, diese mit unterschiedlichen Zielstrukturen und unter Berücksichtigung ihres Toxizitätsprofils für die Erstlinientherapie zu kombinieren.
Dieser Prozess ist im Gange, verlangt aber ein schrittweises Herangehen und eine sorgfältige Evaluierung der Effizienz und Toxizität verschiedener Kombinationen. Unklar ist, ob und wie lange konventionelle Medikamente hier einen wertvollen Beitrag zum Gesamterfolg leisten werden. Obwohl die Heilung mit modernen Therapiekonzepten von „Good risk“-Patienten in greifbare Nähe rückt, muss ihre überlegene Wirksamkeit bei „Poor risk“-Patienten erst unter Beweis gestellt werden.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...