Resektionsränder nach neoadjuvanter Chemotherapie: Einfluss auf Lokalrezidivrate und Überleben
Autorin:
Dr. Kerstin Wimmer
Abteilung für Allgemeinchirurgie
Medizinische Universität Wien
E-Mail: kerstin.wimmer@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Erzielen eines negativen Resektionsrandes stellt einen wichtigen Faktor dar, um die Lokalrezidivrate des Mammakarzinoms niedrig zu halten. Im primären Setting hat sich ein knapper Resektionsrand als onkologisch sicher etabliert. Nun stellt sich die Frage, ob das Operieren in den neuen Tumorgrenzen nach neoadjuvanter Chemotherapie genauso sicher ist.
Keypoints
-
„No tumor on ink“ bedeutet, dass keine Tumorzelle den mit Tusche markierten Präparaterand erreicht.
-
Im primären Setting hat sich gezeigt, dass „no tumor on ink“ hinsichtlich der Lokalrezidivrate gleich sicher ist wie ein größerer Abstand zum Resektionsrand.
-
Nun konnte auch im neoadjuvanten Setting bestätigt werden, dass ein knapper Resektionsrand (R≤1mm) als onkologisch sicher gelten kann.
„No tumor on ink“ im primären Setting
Der Einfluss des Resektionsrandes auf die Lokalrezidivrate beim Mammakarzinom wurde in der Vergangenheit ausreichend bestätigt.1 Im primären Setting, in dem keine Chemotherapie vor brusterhaltender Operation verabreicht wird, weiß man mittlerweile, dass kein großer Sicherheitsabstand zum Tumor nötig ist.2
Während man früher annahm, dass möglichst weite tumorfreie Resektionsränder die günstigste lokale Kontrolle über ein Mammakarzinom erzielen könnten, ging man in den letzten Jahren immer mehr dazu über, den Abstand zum Tumor zu verschmälern.1,3,4 Heute gilt, dass der Abstand zum Tumor weit genug ist, wenn der Tumor den durch Patholog*innen farblich getuschten Präparatrand nicht erreicht. Somit hat sich die Definition „no tumor on ink“ als onkologisch sicher etabliert.3
Resektionsränder im neoadjuvanten Setting
Nun stellt sich die Frage, wie weit der Abstand des Tumors zum Resektionsrand sein muss, wenn zuvor eine neoadjuvante Chemotherapie durchgeführt wurde. Häufig kommt es unter einer Chemotherapie zu einem sehr guten Ansprechen, welches mit einer deutlichen Größenabnahme oder sogar einer kompletten pathologischen Remission einhergeht. In letzterem Fall kann im Operationspräparat kein Tumor mehr nachgewiesen werden.
Reicht es in diesen Fällen nun aus, in den neuen Tumorgrenzen zu operieren, oder muss ein größerer Sicherheitsabstand gewählt werden? Zu beachten ist, dass in manchen Fällen Tumoren unter dem Einfluss der neoadjuvanten Chemotherapie nicht konzentrisch schrumpfen, sondern fleckige Residuen bilden.5 Dies kann dazu führen, dass bei einer sehr knappen Resektion des Tumors eventuell ein angrenzendes Tumorresiduum zurückgelassen wird.
Studie: Resektionsränder nach neoadjuvanter Therapie
Unsere im Folgenden vorgestellte Arbeit hat sich dem Resektionsrand im neoadjuvanten Setting gewidmet und möchte die Frage klären, ob „no tumor on ink“ auch nach neoadjuvanter Chemotherapie als onkologisch sicher gilt. Es handelt sich hierbei um eine retrospektive Analyse von 416 Patient*innen, die zwischen 1994 und 2014 an der Allgemeinchirurgie der Medizinischen Universität Wien und im Ordensklinikum Barmherzige Schwestern Linz brusterhaltend operiert worden sind.6
Die Weite der jeweiligen Resektionsränder wurde aus den histologischen Befunden erhoben. War nach neoadjuvanter Chemotherapie noch Tumorgewebe im Operationspräparat aufzufinden, so wurden die negativen Tumorränder als knapp (R≤1mm) oder weit (R>1mm) definiert. Bei Patient*innen mit einer kompletten pathologischen Resektion wurden die Resektionsränder als „RX“ definiert. Patient*innen, bei denen in der endgültigen Histologie eine R1-Resektion zu finden war und eine Mastektomie oder keine weitere Resektion durchgeführt wurde, wurden aus der Studie ausgeschlossen, sodass am Ende 406 Patient*innen Eingang in die Studie fanden.
Ziel dieser Studie war es, den Einfluss von knappen oder weiten Resektionsrändern auf onkologische Endpunkte wie die Lokalrezidivrate zu messen. Ebenso wurde untersucht, ob es einen Unterschied zu den Patient*innen mit pathologisch kompletter Remission gab. Endpunkte der Studie waren das lokalrezidivfreie Überleben (LRFS), welches als Zeit zwischen Operation und dem Auftreten eines ipsilateralen Rezidivs definiert wurde, sowie das krankheitsfreie Überleben („disease-free survival“, DFS) und das Gesamtüberleben („overall survival“, OS).
Das mediane Patient*innenalter lag bei 51,5 Jahren (min. 20,5 bis max. 82,6 Jahre). Das mediane Follow-up betrug 84,3 Monate (95% CI: 71,6–97,1 Monate). Die Rate an postmenopausalen Frauen war mit 55,2% (n=224) nur etwas höher als die der prämenopausalen Frauen (44,8%, n=182). Bei fast allen Patient*innen (92,8%) war zum Diagnosezeitpunkt der Tumor palpabel und bei etwa einem Drittel der Patient*innen gab es zum Zeitpunkt der Vorstellung einen klinischen Verdacht auf eine Lymphknotenmetastasierung.
In der präoperativen Biopsie waren folgende Brustkrebssubtypen zu finden:
-
190 HR+/HER2−/nd (46,8%)
-
118 HR−/HER2−/nd (29,1%)
-
58 HR+/HER2+ (14,3%)
-
40 HR−/HER2+ (9,9%)
Bei 51 Patient*innen wurde der HER2-Status weder vor noch nach der neoadjuvanten Chemotherapie bestimmt. Diese Fälle wurden als „nd“ („not done“) klassifiziert.
Alle 406 Patient*innen wurden brusterhaltend operiert, bei 48 Patient*innen musste eine Nachresektion aufgrund eines positiven Tumorrandes erfolgen. Dies ergab eine Re-Resektionsrate von 11,8%. Ein knapper Resektionsrand von unter 1mm (R≤1mm) war bei 74 Patient*innen (18,2%) zu finden, ein weiter Resektionsrand von über 1mm (R>1mm) bei 284 Patient*innen (70,0%), während in 48 Fällen aufgrund einer pCR ein RX vorlag.
Im Follow-up-Zeitraum verstarben 64 Patient*innen (15,8%) und Lokalrezidive wurden bei 39 Patient*innen diagnostiziert, während bei 13 Patient*innen (3,2%) ein kontralaterales Rezidiv auftrat. In 354 Fällen (87,2%) wurde kein Rezidiv diagnostiziert. Ein axilläres Rezidiv wurde bei neun Patient*innen (2,2%) nachgewiesen, Fernmetastasen hingegen bei 86 Patient*innen (21,2%).
Keine signifikanten Unterschiede in den Lokalrezidivraten bei R0- und RX-Resektionen
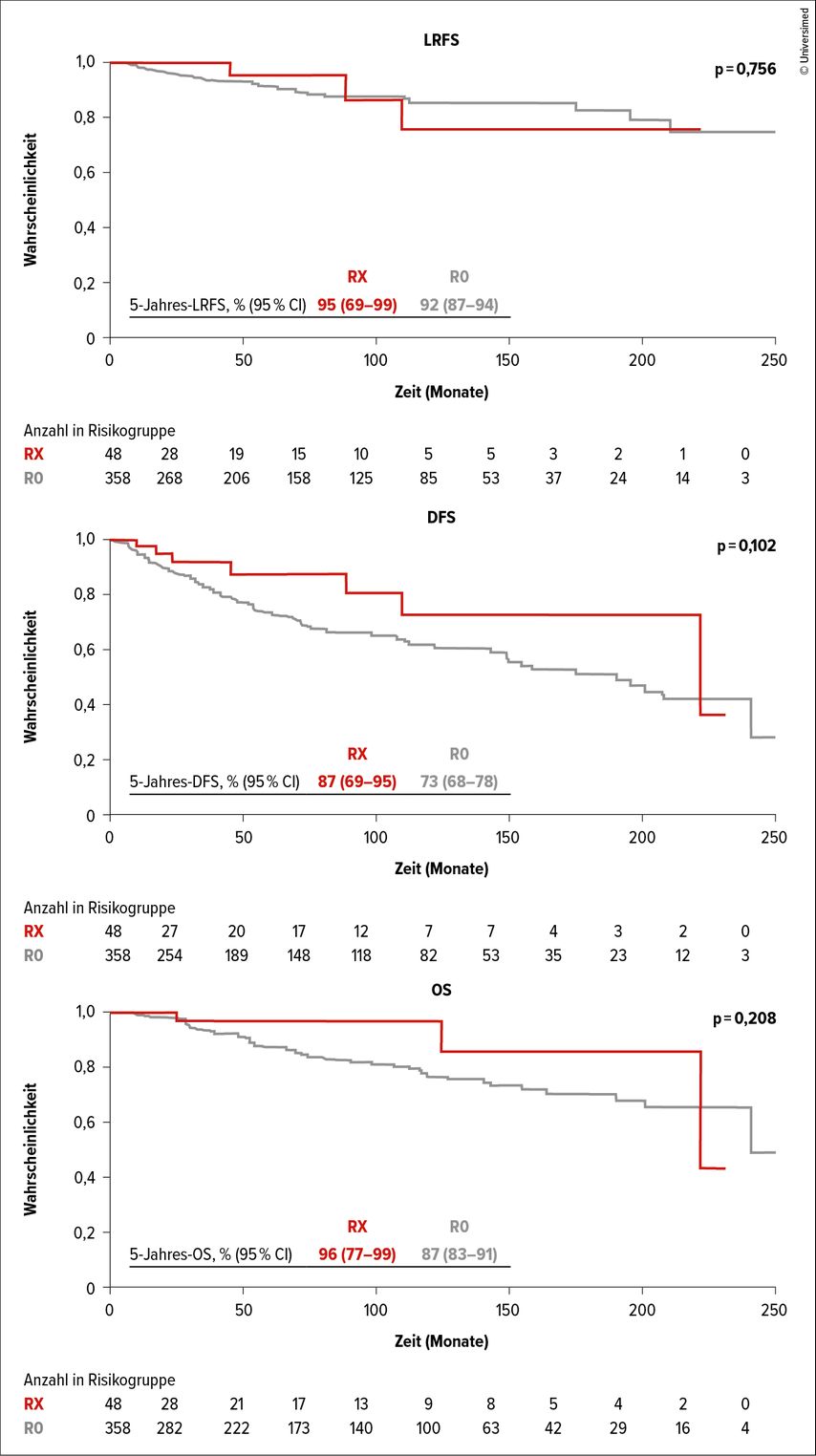
Hinsichtlich des LRFS und des OS konnten keine signifikanten Unterschiede zwischen R0-Resektionen – unabhängig vom Resektionsabstand – und RX-Resektionen gefunden werden. Auch wenn kein signifikanter Unterschied hinsichtlich des Gesamtüberlebens zu finden war, so zeichnete sich doch ein Trend ab.
Patient*innen mit RX hatten ein um 9,1% verlängertes 5-Jahres-Gesamtüberleben. Des Weiteren fand sich ein Trend hinsichtlich eines verlängerten DFS bei RX-Patient*innen im Vergleich zu R0-Resektionen, allerdings zeigte sich auch hier kein signifikanter Unterschied. Überlebenskurven sind in der Abbildung 1 dargestellt.
Abb. 1: Die Kaplan-Meier-Kurven zeigen das lokalrezidivfreie Überleben (LRFS), das krankheitsfreie Überleben (DFS) und das Gesamtüberleben (OS) von Patient*innen mit R0-Resektion (rot) oder RX-Resektion (blau). Modifiziert nach Wimmer K et al.6
Keine signifikanten Unterschiede in den Lokalrezidivraten bei knappen oder weiten Resektionsrändern
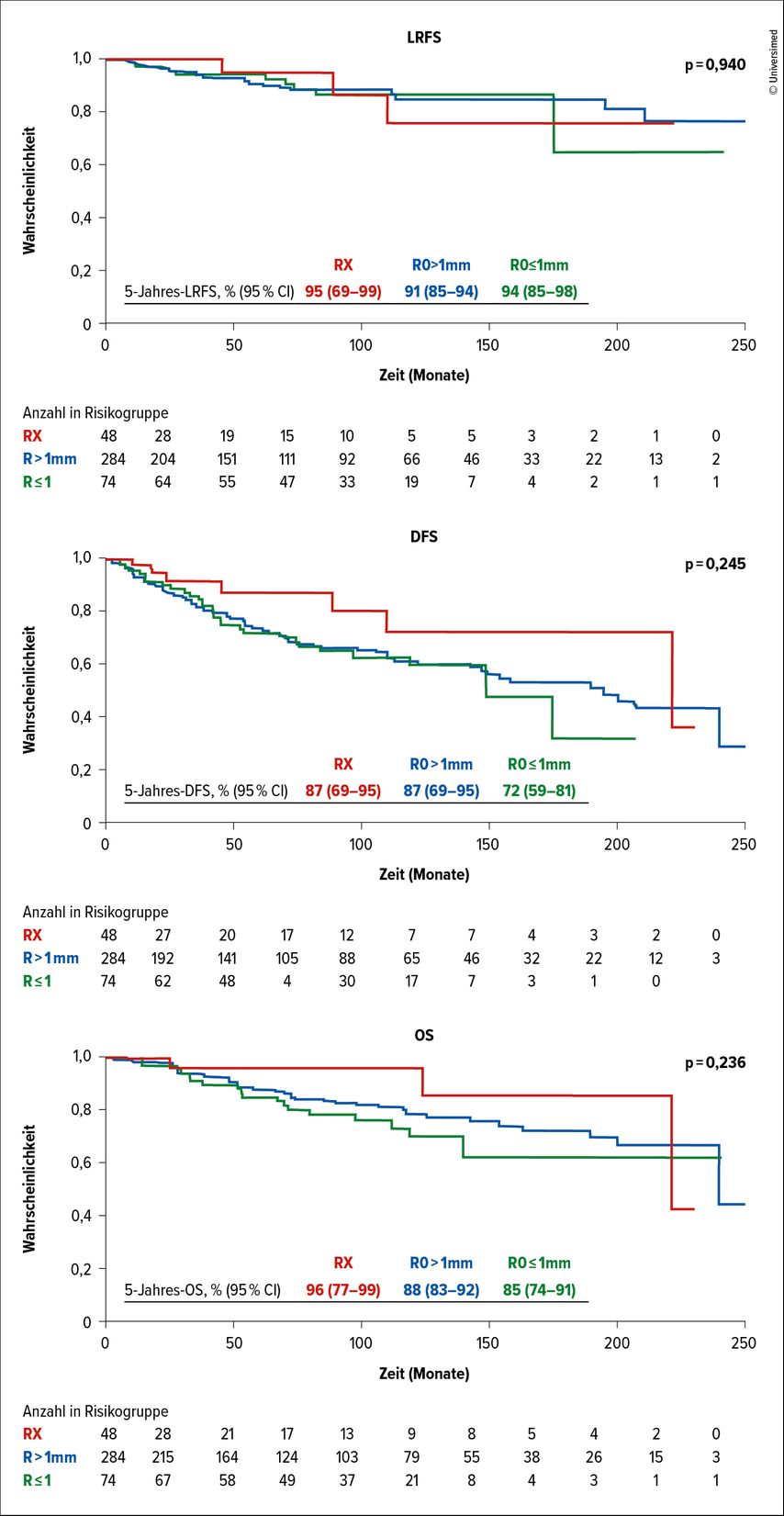
Unterschied man nun die R0-Resektionen in knappe (R≤1mm) und weite Resektionsränder (R>1mm) und verglich diese auch mit RX-Resektionen, so fand sich auch hier kein signifikanter Unterschied zwischen den Raten des lokalrezidivfreien und des krankheitsfreien Überlebens und des Gesamtüberlebens.
Überlebenskurven dieser drei Gruppen sind in Abbildung 2 dargestellt.
Abb. 2: Die Kaplan-Meier-Kurven zeigen das lokalrezidivfreie Überleben (LRFS), das krankheitsfreie Überleben (DFS) und das Gesamtüberleben (OS) von Patient*innen mit Resektion R≤1mm (grün), Resektion R>1mm (rot) oder RX-Resektion (blau). Modifiziert nach Wimmer K et al.6
Nodalstatus als unabhängiger prognostischer Faktor
In einer Multivariatanalyse wurde ersichtlich, dass ein negativer Nodalstatus einen unabhängigen prognostischen Faktor für ein verlängertes krankheitsfreies (HR: 0,46; p<0,0001; 95% CI: 0,31–0,67) sowie Gesamtüberleben (HR: 0,46; p=0,004; 95% CI: 0,27–0,78) darstellt. Hinsichtlich der Lokalrezidivrate konnte hier allerdings kein signifikanter prognostischer Wert gefunden werden (HR: 0,63; p=0,164; 95% CI: 0,33–1,21; Abb.3).
Fazit
Die hier präsentierte Arbeit ist eine große, retrospektive Analyse von 406 Patient*innen, die in zwei verschiedenen Brustgesundheitszentren behandelt und nach neoadjuvanter Chemotherapie einer brusterhaltenden Operation unterzogen wurden.
Die vorgestellten Daten bestätigen, dass eine brusterhaltende Operation innerhalb der neuen Tumorgrenzen nach neoadjuvanter Chemotherapieonkologisch sicher ist. Wurde das vor der neoadjuvanten Chemotherapie geklippte Tumorbett reseziert und erhielten Patient*innen im Anschluss eine Strahlentherapie, erzielten wir auch im neoadjuvanten Setting unter Einhaltung eines freien Resektionsrandes gemäß „no tumor on ink“exzellente 5-Jahres-Lokalrezidivraten von 8,5%.
Zusammenfassend lässt sich sagen, dass keine signifikanten Unterschiede in den Überlebenskurven zwischen knappen und weiten Resektionsrändern sowie Resektionen nach einer pCR (RX) zu finden sind. Demnach ist auch im neoadjuvanten Setting eine knappe Tumorresektion onkologisch sicher. Zusätzlich hat sich gezeigt, dass ein negativer Nodalstatus einen prognostisch günstigen Faktor hinsichtlich eines längeren krankheitsfreien Überlebens sowie Gesamtüberlebens darstellt.
Literatur:
1 Houssami N et al.: The association of surgical margins and local recurrence in women with early-stage invasive breast cancer treated with breast-conserving therapy: ameta-analysis. Ann Surg Oncol 2014; 21(3): 717-30 2 Morrow M et al.: Surgical margins in lumpectomy for breast cancer—bigger is not better. New Engl J Med 2012; 367(1): 79-82 3 Moran MS et al.: Society of Surgical Oncology—American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. J Clin Oncol 2014; 32(14): 1507-15 4 Gradishar WJ et al.: Breast cancer version 2.2015 J Natl Compr Cancer Netw 2015; 13(4): 448-75 5 Wang S et al.: Shrink pattern of breast cancer after neoadjuvant chemotherapy and its correlation with clinical pathological factors. World J Surg Oncol 2013; 11(1): 166 6 Wimmer K et al.: Impact of surgical margins in breast cancer after preoperative systemic chemotherapy on local recurrence and survival. Ann Surg Oncol 2020; 27: 1700-7
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...