
PRRT bei NET: Patient:innenselektion und Timing
Autor:
Prim. Univ.-Prof. Mag. Dr. Michael Gabriel
Institut für Nuklearmedizin und Endokrinologie
Kepler Universitätsklinikum GmbH
Med Campus III, 4021 Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In Österreich leben ca. 4500 Betroffene mit der Diagnose eines neuroendokrinen Tumors (NET). Das entspricht einer Inzidenz von 2,51 pro 100000 Einwohner:innen. Inden letzten Jahren ist diese Inzidenz um den Faktor 5–10 gestiegen, wobei sich die Frage stellt, ob diese Zunahme eventuell aufgrund besserer Diagnoseverfahren beeinflusst wird.
Neben der erhöhten Inzidenz von neuroendokrinen Tumoren (NET) zeigte sich weiters, dass die Häufigkeit des Nachweises von Metastasen bei initialer Diagnose von 29% im Jahr 1994 auf 13% im Jahr 2009 abnahm, was den Verdacht nahelegt, dass die Erkrankung inzwischen häufiger in früheren Stadien diagnostiziert wird.
NET zeichnen sich dadurch aus, dass der Ursprungsort überwiegend im gastroenteropankreatischen (GEP) Bereich gelegen ist und 70% der Fälle primär asymptomatisch verlaufen. Es können dabei Metastasen in unterschiedlichen (manchmal in entfernt liegenden) Körperregionen auftreten, weshalb ein präzises Stagingverfahren von klinisch-therapeutischer Relevanz ist. Ca. 95% der Fälle mit einem NET weisen in den entsprechenden Tumorzellen eine Somatostatin-Rezeptor(SSTR)-Überexpression auf, welche die Grundlage für die nuklearmedizinische Bildgebung und in weiterer Folge auch für die zielgerichtete Behandlung auf Basis strahlender Substanzen darstellt. Gerade der nuklearmedizinische Ansatz ist in vielen Fällen der „klassischen“ Chemo- und Strahlentherapie bei dieser Tumorentität überlegen, wobei der Differenzierungsgrad des Tumorgewebes eine wichtige Rolle spielt.
Insbesondere dann, wenn bereits ein metastasiertes bzw. inoperables Tumorstadium vorliegt, ist mithilfe der sogenannten 68Ga-DOTA-Somatostatin(SST)-PET/CT der In-vivo-Nachweis dieser SSTR im Tumorgewebe möglich. Entsprechend dem Schlüssel-Schloss-Mechanismus eröffnet ein positiver In-vivo-Nachweis der Rezeptoren die Möglichkeit eines Einsatzes „kalter“, lang wirksamer Somatostatin-Analoga (SSTA) bzw. auch die Option einer Indikationsstellung hinsichtlich einer weiterführenden Radionuklidpeptidtherapie (PRRT), in erster Linie unter Verwendung von 177Lu-DOTA-TATE.
Der Begriff „Theranostik“, welcher bei nuklearmedizinischen Anwendungen in letzter Zeit häufig verwendet wird, soll dabei zum Ausdruck bringen, dass die Tumorherde, welche mit PET-CT bildlich dargestellt werden, auch selektiv durch die systemische PRRT-Anwendung bestrahlt und geschädigt werden.
Indikationen, Kontraindikationen und Wirksamkeit der PRRT
Die PRRT ist indiziert für die systemische Behandlung von SSTR-positiven NET im metastasierten und inoperablen Stadium.1 Dies trifft in erster Linie auf Tumoren ausgehend vom GEP-System bzw. teils auch vom Bronchialsystem zu. In erster Linie sind Tumorentitäten mit guter histologischer Differenzierung (Grad 1 und Grad 2) dafür geeignet. Voraussetzung ist eine ausreichende Aufnahme des Radiopharmakons in die Tumormanifestationen, welche durch die vorausgehende 68Ga-DOTA-SST-PET/CT verifiziert wird. Darüber hinaus sollte eine ausreichende Nierenfunktion vorliegen, zumal das verwendete Radiopharmakon auch nephrotoxische Nebenwirkungen verursachen kann.
Nicht geeignet ist diese Behandlung für Patient:innen mit einem weit fortgeschrittenen Tumorstadium mit einer Lebenserwartung von wenigen Monaten (Karnofsky-Index <50% oder ECOG >2). Eine relative Kontraindikation ist weiters eine eingeschränkte Knochenmarkreserve. Nephrotoxische bzw. hämatotoxische Vorbehandlungen sollten in der Therapieentscheidung mitberücksichtigt und ggf. die zu applizierenden Aktivitäten individuell angepasst werden.
Grundsätzlich ist das Nebenwirkungsprofil der PRRT als günstig zu bezeichnen. Neben gering- bis mäßiggradigen Nierenfunktionseinschränkungen wurden auch einzelne Fälle eines myoelodysplastischen Syndroms nach Behandlung mit 177Lu-DOTA-TATE beschrieben. Andererseits konnte in der Phase-III-Zulassungsstudie NETTER-1 nach 20 Monaten ein statistisch signifikant längeres progressionsfreies Überleben (PFS) bei 65,2% im PRRT-Arm gegenüber nur 10,8% im Kontrollarm (Sandostatin© LAR© 60mg i.m.) gezeigt werden.2
In der finalen Auswertung der Studienergebnisse zeigte sich ein tendenziell verlängertes Gesamtüberleben von 11,7 Monaten (HR: 0,73) im PRRT-Arm; die fehlende Signifikanz könnte durch das Cross-over-Studiendesign mit einem Wechsel von Patient:innen der Kontrollgruppe in die PRRT-Gruppe erklärbar sein.
Dieses positive Ergebnis bei Patient:innen mit Dünndarm-NET konnte in der aktuellen Phase-II-Studie OCLURANDOM mit 84 Patient:innen mit einem inoperablen progredienten pankreatischen NET bestätigt werden.3 In dieser prospektiven randomisierten Studie erhielten die Patient:innen entweder 177Lu-DOTA-TATE oder 37,5mg Sunitinib p.o. täglich. Ersten Resultaten zufolge betrug das mediane PFS 20,7 Monate im PRRT-Arm und elf Monate im Behandlungsarm mit Sunitinib. Nach zwölf Monaten waren 80% der Patient:innen im PRRT-Arm progressionsfrei, hingegen nur 42% im Sunitinib-Arm. Die Nebenwirkungsrate (Grad 3–4) lag im PRRT-Arm bei 44% und im Sunitinib-Arm bei 63%, was auf eine bessere Verträglichkeit dieser Therapieform hinweist.
Timing und Prädiktoren für das Therapieansprechen
Die PRRT unter Verwendung von 177Lu-DOTA-TATE ist als Zweitlinientherapie zur Behandlung von nichtresektablen oder progredient-metastasierenden, gut differenzierten (G1 und G2) SSTR-positiven GEP-NET seit 2017 in der EU zugelassen.
In verschiedenen Leitlinien ist diese Radionuklidtherapie bei der ersten Progression bzw. als Zweitlinientherapie von G1- bzw. G2-Tumoren neuroendokrinen Ursprungs vorgesehen. Auch bei ausgewählten SSTR-positiven NET Grad 3 mit einem Ki-67-Index >20% kann eine PRRT in Erwägung gezogen werden.
Bei Tumoren mit einem sehr hohen Ki-67-Index von >55% wird eine PRRT, speziell bei neuroendokrinen Karzinomen (NEC), nicht empfohlen, zumal bei diesen Tumoren neben dem aggressiven Wachstum meist auch keine ausreichende Aufnahme des Radiopharmakons in die Läsionen nachweisbar ist. Die hohe Proliferationsrate lässt sich in diesen Fällen oftmals durch die 18F-FDG-PET/CT als Marker für den erhöhten Glukoseumsatz gut darstellen.
Wie schon in der Zulassungsstudie von Strosberg JR et al. gezeigt werden konnte, ist die PRRT der alleinigen Anwendung der „kalten“, lang wirksamen SST-Analoga hinsichtlich PFS deutlich überlegen. Folglich empfiehlt die aktuelle ESMO-Leitlinie4 den frühzeitigen Einsatz der PRRT. Dies trifft in erster Linie auf vom Dünndarm ausgehende Tumoren zu. Aber auch bei pankreatischen NET ist die PRRT als Zweitlinienbehandlung nach Chemotherapie eine mögliche Option, wobei pankreatische NET G3 mit moderatem Ki-67 ähnlich wie pankreatische NET G2 zu betrachten sind.
Im Besonderen wird die PRRT bei SSTR-positiven pankreatischen NET G1/G2 mit einem Ki-67-Index <10% als mögliche Zweitlinientherapie nach dem Einsatz von lang wirksamen SST-Analoga oder nach Chemotherapie eingestuft und (zukünftig) zielgerichteten Behandlungsstrategien gleichgestellt, z.B. Biologika. Wie es aufgrund von in Überarbeitung befindlichen Leitlinien den Anschein haben dürfte, wird in Bezug auf die PRRT ein „Upgrade“ zu erwarten sein. Einige sehr vielversprechende Studien stellen auch die Möglichkeit der kombinierten Anwendung der PRRT mit einem Radiosensitizer, wie z.B. Capecitabin, mit einer potenziell erhöhten Ansprechrate bei pankreatischem NET in Aussicht.
Nach erfolgter PRRT hat sich gerade bei Patient:innen mit einer funktionellen Komponente des Tumors das Fortführen der monatlichen Gabe eines lang wirksamen SST-Analogons hinsichtlich Symptomkontrolle bewährt. Bei gutem Therapieansprechen der Radionuklidtherapie mit einer Remission oder Stabilisierung der Tumorerkrankung kann im Falle einer neuerlichen Progression die PRRT wiederholt werden, speziell in den Fällen, die initial gut auf diese Therapie angesprochen haben, und frühestens nach einem Jahr nach Abschluss der Radionuklidbehandlung.
Die PRRT kann nicht nur isoliert angewendet werden, sondern kann auch mit einem lokalen Therapieverfahren, z.B. mittels Radiofrequenzablation, kombiniert werden. Diese ergänzende Behandlungsoption sollte gerade bei entdifferenzierten Einzelläsionen, z.B. 18F-FDG-positiven und 68Ga-negativen, ins Auge gefasst werden. Darüber hinaus sollte auch eine operative Entfernung des Primärtumors bereits vor der systemischen Radionuklidtherapie in Erwägung gezogen werden. Verschiedene (retrospektive) Studien weisen auf einen positiven Effekt hinsichtlich PFS und medianem Gesamtüberleben hin.
Unter Berücksichtigung möglicher postoperativer Komplikationen, z.B. Fistelbildung nach Pankreasoperation, ist die Entscheidung individuell zu treffen. Zudem kann durch die Resektion des Primärtumors auch eine fortschreitende Fibrose bzw. desmoide Reaktion mit der Folge einer lokalen Obstruktion bzw. Mesenterialischämie positiv beeinflusst werden. Im Zuge eines solchen Eingriffes sollte auf alle Fälle auch die Gallenblase im Hinblick auf die Therapie mit lang wirksamen SST-Analoga mitentfernt werden.
In puncto Verbesserung der Lebensqualität kann speziell bei Patient:innen mit einer funktionellen Komponente – unabhängig vom objektiven Therapieansprechen – eine Besserung der Beschwerdesymptomatik erzielt werden. Jedoch sollte in diesen Fällen ein lang wirksames SST-Analogon im Intervall kombiniert werden, nachdem die Wirkung der PRRT mit Verzögerung eintritt.
Das Therapieansprechen wird in erster Linie mittels 68Ga-DOTA-SST-PET/CT überprüft. Dabei zeigt sich, dass das objektive Therapieansprechen respektive Stabilisierung der NET-Erkrankung bei ca. 80% der Fälle nach erfolgter Behandlung liegt. Diejenigen Patient:innen, deren Erkrankung nach Radionuklidbehandlung rasch progredient ist, weisen allgemein eine schlechte Prognose auf. Selbst bei Patient:innen mit einer stabilen Tumorerkrankung nach PRRT ohne signifikante Verkleinerung der Läsionen konnte gezeigt werden, dass diese mitunter über viele Jahre, manchmal sogar Jahrzehnte hinweg einen günstigen Krankheitsverlauf haben.5 Das ist auch im angefügten Patient:innenbeispiel dargestellt (Abb. 1).
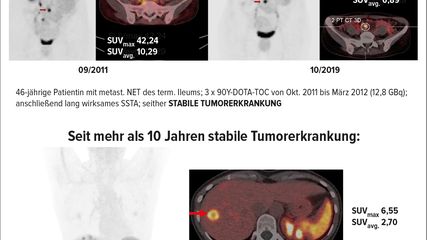
Abb. 1:46-jährige Patientin mit einem metastasierenden NET des terminalen Ileums: Von Okt. 2011 bis März 2012 wurden insgesamt 3 Gaben 90Y-DOTA-TOC mit einer Gesamtaktivität von 12,8GBq verabreicht. Anschließend folgte eine Erhaltungstherapie mit einem lang wirksamen SST-Analogon. Wie die 68Ga-DOTA-SST-PET/CT-Untersuchung zeigt, besteht eine stabile Tumorerkrankung und die weiterhin berufstätige Patientin weist einen Karnofsky-Index von 100% auf
Es hat sich hinsichtlich Langzeitprognose weiters gezeigt, dass ein hoher Karnofsky-Index, ein niedriger Wert der Tumormarker (NSE und Chromogranin A), eine niedrige Tumorlast (speziell, was die Lebermetastasierung anbelangt) sowie ein Ki-67-Index ≤10% günstige Prädiktoren für den weiteren Krankheitsverlauf nach PRRT darstellen.6 Vorausgesetzt, dass keine Entdifferenzierung von Tumorläsionen mit Verlust der SSTR-Expression im Krankheitsverlauf auftritt, ist die wiederholte Anwendung der PRRT ggf. in Kombination mit einem lang wirksamen SST-Analogon als Erhaltungstherapie ein Erfolg versprechendes Behandlungskonzept mit einem akzeptablen Nebenwirkungsprofil.7
Literatur:
1 Poeppel TD et al.: Peptide receptor radionuclide therapy for patients with somatostatin receptor expressing tumours. German Guideline (S1). Nuklearmedizin 2015; 54(1): 1-11 2 Strosberg JR et al.: Phase 3 trial of 177lu-dotatate for midgut neuroendocrine tumors. N Engl J Med 2017; 376(2): 125-35 3 Baudin E et al.: First multicentric randomized phase II trial investigating the antitumor efficacy of peptide receptor radionucleide therapy with 177lutetium–octreotate (OCLU) in unresectable progressive neuroendocrine pancreatic tumor: results of the OCLURANDOM trial. ESMO Congress 2022; Abstr. #8870 4 Pavel M et al.: Gastroenteropancreatic neuroendocrine neoplasms: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020; 31(7): 844-60 5 Gabriel M et al.: Twelve-year follow-up after peptide receptor radionuclide therapy. J Nucl Med 2019; 60(4): 524-29 6 Aalbersberg EA et al.: J Nucl Med 2019; 60: 1259-65 7 Yordanova A et al.: The role of adding somatostatin analogues to peptide receptor radionuclide therapy as a combination and maintenance therapy. Clin Cancer Res 2018; 24(19): 4672-9
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


