Potenzielle Komplikationen und hämatopathologische Herausforderungen
Autor:innen:
PD Dr. Elena Gerhard-Hartmann
Prof. Dr. Ioannis Anagnostopoulos
Institut für Pathologie und Referenzzentrum für Lymphknotendiagnostik und Hämatopathologie Universität Würzburg
Korrespondenz:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
CAR-T-Zell-Therapien haben sich als vielversprechende Therapieoption für eine Reihe hämatologischer Neoplasien etabliert. Mit der zunehmenden klinischen Anwendung wird jedoch deutlich, dass das Spektrum der assoziierten potenziellen Komplikationen komplex ist und deren Kenntnis sowie frühzeitige Identifikation von großer klinischer Bedeutung sind.
Keypoints
-
Das Spektrum der Komplikationen der CAR-T-Zell-Therapie wird mit zunehmendem Einsatz und wachsendem Erfahrungsschatz komplexer.
-
Ungewöhnliche morphologische/immunphänotypische Befunde nach einer CAR-T-Zell-Therapie sollten ergänzende ausführliche Untersuchungen ggf. einschließlich molekularer Analysen auslösen, um deren Pathogenese aufzuklären.
-
Der In-situ-Nachweis von CAR-T-Zellen ist methodisch bereits möglich, steht jedoch noch nicht für die diagnostische Routine zur Verfügung.
Adoptive Zelltherapien unter Verwendung chimärer Antigenrezeptoren (CAR) haben die Landschaft der onkologischen Immuntherapie grundlegend verändert.1 Bei CAR-T-Zellen handelt es sich um patienteneigene (autologe) T-Lymphozyten, die gentechnisch so modifiziert werden, dass sie ein Gen für einen chimären Antigenrezeptor exprimieren, mit dem tumorspezifische Antigene erkannt werden.
Geschichte
Die Entwicklung der CAR-T-Zell-Technologie begann in den späten 1980er-Jahren, als die Arbeitsgruppe um den israelischen Immunologen Prof. Dr. Zelig Eshhar die erste Generation von CAR-T-Zellen konstruierte.2 Diese enthielt ein Antikörper-Einzelkettenfragment („single chain variable fragment“, scFv), bestehend aus den variablen Regionen der schweren und leichten Immunglobulinkette, fusioniert mit der intrazellulären Signaldomäne des T-Zell-Rezeptorkomplexes (CD3-zeta-Kette).
Diese erste CAR-T-Zell-Generation zeigte jedoch in klinischen Studien nur eine unzureichende antitumorale Wirksamkeit, was vor allem auf eine mangelhafte Expansion und Persistenz der transfundierten Zellen zurückzuführen war. Durch gezielte Weiterentwicklungen in verschiedenen Forschungsgruppen gelang der Fortschritt zur zweiten Generation von CAR-T-Zellen, die zusätzlich eine kostimulatorische Domäne, beispielsweise CD28, enthielt. Diese Modifikation führte zu einer stärkeren Signaltransduktion nach Antigenbindung und einer länger anhaltenden T-Zell-Aktivierung.
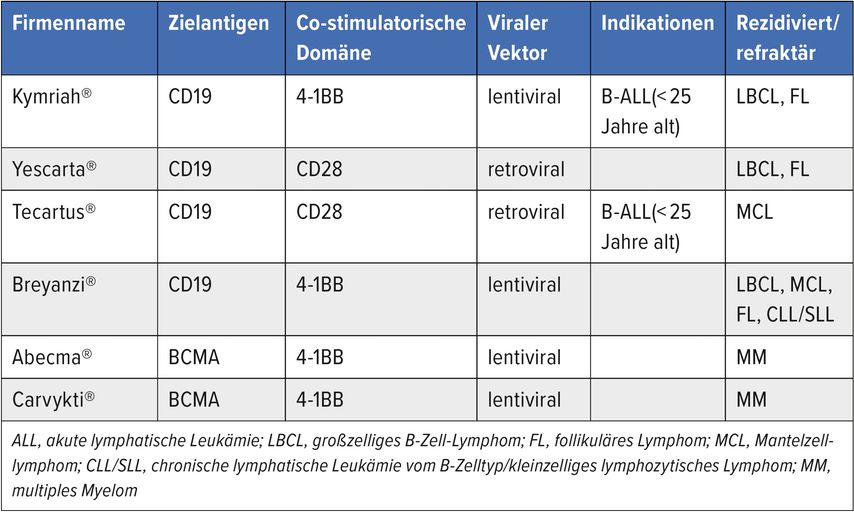
Die aktuell durch die U.S. Food and Drug Administration (FDA) und die Europäische Arzneimittel-Agentur („European Medicines Agency“, EMA) zugelassenen CAR-T-Zell-Produkte der dritten Generation bestehen aus der Antigenbindedomäne, einer Scharnierregion (engl. „hinge“), der Transmembrandomäne, einer oder mehreren kostimulatorischen Domänen (CD28, 4-I1BB bzw. CD137) sowie der CD3-zeta-Kette (Tab.1).
Herstellung
Die Herstellung der aktuell zugelassenen CAR-T-Zell-Produkte erfolgt in mehreren Schritten. Zunächst werden patienteneigene T-Zellen mittels Leukapherese aus dem peripheren Blut gewonnen und ex vivo kultiviert. Anschließend wird das für den CAR codierende genetische Konstrukt in die T-Zellen eingebracht. Die so modifizierten T-Zellen werden danach über mehrere Tage in Kultur vermehrt, qualitätskontrolliert und schließlich nach einer lymphodepletierenden Chemotherapie wieder in die Patient:innen reinfundiert.
Zur Integration des CAR-Gens werden derzeit retrovirale oder vom humanen Immundefizienzvirus-1 (HIV-1) abgeleitete lentivirale Vektoren verwendet. Beide Vektortypen integrieren die CAR-codierende Genkassette zufällig in das Genom der T-Zellen. Diese Integrationsweise kann jedoch potenzielle Risiken bergen,darunter die Stilllegung („silencing“), Überexpression oder Mutation betroffener Gene, was langfristig die Sicherheit und Funktionalität der CAR-T-Zellen beeinflussen kann.3
Nebenwirkungen derCAR-T-Zell-Therapie
Die Nebenwirkungen der CAR-T-Zell-Therapie lassen sich in kurzfristige und langfristige Komplikationen unterteilen.4
Zu den häufigsten akuten Nebenwirkungen zählt das Zytokinfreisetzungssyndrom („cytokine-release syndrome“, CRS), ein Sammelbegriff für ein Spektrum klinischer Symptome und Laborbefunde, die durch eine ausgeprägte Interaktion bzw. Aktivierung von Immunzellen mit Tumorzellen ausgelöst werden. Typische klinische Manifestationen sind Fieber, Hypotonie und Hypoxie, begleitet von erhöhten Zytokinspiegeln im Serum.
Eine weitere häufige, kurzfristige Komplikation kann ein Immuneffektorzell-assoziiertes Neurotoxizitätssydnrom (ICANS) sein, das meist nach einem CRS auftritt. Die zugrunde liegenden pathophysiologischen Vorgänge sind noch nicht im Detail entschlüsselt. Es wird aber angenommen, dass eine überschießende Zytokinfreisetzung zu einer endothelialen Dysfunktion auch der Blut-Hirn-Schranke führen kann. Ferner ist wahrscheinlich auch eine geringe Expression von CAR-T-Ziel-Antigenen in Zellen der Blut-Hirn-Schranke bzw. im ZNS beteiligt. Die Störung der Blut-Hirn-Schranke ermöglicht den Übertritt von CAR-T-Zellen in das ZNS, was eine entzündliche Neurotoxizität zur Folge haben kann.
Zu den langfristigen Nebenwirkungen zählen Thrombozytopenie, eine Depletion von B-Zellen mit konsekutivem Immunglobulinmangel (insbesondere IgG), die Entwicklung einer Resistenz gegenüber CAR-T-Zellen sowie in seltenen Fällen die Entstehung sekundärer T-Zell-Lymphome. Besonders bei den beiden letztgenannten Komplikationen ist die pathologische Expertise von zentraler Bedeutung, insbesondere zur Unterscheidung zwischen einer Persistenz bzw. einem Rezidiv der Grunderkrankung und dem Auftreten einer sekundären Neoplasie, wie im Folgenden näher erläutert.
Therapieresistenz undsekundäre T-Zell-Lymphome
Trotz der beeindruckenden und oft lang anhaltenden Remissionen, die durch die CAR-T-Zell-Therapie erzielt werden können, zeigt mehr als die Hälfte der behandelten Patient:innen ein fehlendes Ansprechen oder erleidet einen Rückfall. Die verfügbaren Daten deuten darauf hin, dass die Resistenz gegenüber der CAR-T-Zell-Therapie multifaktoriell bedingt ist.
Antigenverlust
Ein zentraler Mechanismus ist ein Antigenverlust der Zielzellen. Durch den Selektionsdruck der Therapie können Antigen-negative Tumorsubklone entstehen, die expandieren und zum Krankheitsrezidiv führen. Die Häufigkeit und Ausprägung dieses Phänomens hängen von der Grunderkrankung, dem CAR-T-Design, der Patient:innenpopulation, der Vortherapie, der Dauer der Nachbeobachtung sowie von der Nachweismethode ab.
Ein CD19-negativer Rückfall tritt bei B-akuter lymphatischer Leukämie (ALL) bei etwa 18–25% der pädiatrischen und 7–9% der erwachsenen Patient:innen auf,5 bei aggressiven B-Zell-Lymphomen wird eine vergleichbare Häufigkeit berichtet (18–25%).5,6 Für das multiple Myelom sind Daten zum BCMA-Verlust bislang begrenzt.
Der Verlust der CD19-Expression kann durch verschiedene genetische Mechanismen verursacht werden. In der B-ALL liegt die Hauptursache in Alterationen des CD19-Gens (Genlokus 16p11.2),7 insbesondere in Mutationen mit konsekutiver Trunkierung oder Leserasterverschiebung oder in einem Verlust des entsprechenden chromosomalen Bereichs (z.B. durch homozygote Deletion des Chromosoms 16).
Bei aggressiven B-Zell-Lymphomen treten CD19-Mutationen seltener auf; hier werden stattdessen häufiger Veränderungen in Genen beschrieben, die den B-Zell-Phänotyp (z.B. PAX5, CD79A), Immuncheckpoint-Moleküle (CD274), das Tumormikromilieu (TMEM30A) oder die zelluläre Aggressivität (INPP4B, SEB1, SYNE1) beeinflussen.8,9
Transdifferenzierung
Ein weiterer Resistenzmechanismus ist die Transdifferenzierung, bei der Tumorzellen ihre zelluläre Identität verändern. Dabei können Neoplasien unterschiedlicher Liniendifferenzierung entstehen, die jedoch auf einem gemeinsamen Ursprungsklon basieren.
Transdifferenzierungen in eine akute myeloische Leukämie sind bei Patient:innen mit B-ALL nach CAR-T-Zell-Therapie gut dokumentiert.10 Bei B-Zell-Lymphomen wurden vereinzelt Übergänge in ein histiozytäres Sarkom, eine undifferenzierte Neoplasie oder seltener in ein T-Zell-Lymphom beobachtet.9,11
Mit molekularen Analysen konnten bei solchen Transdifferenzierungen ungewöhnliche Mutationsmuster nachgewiesen werden, die in lymphatischen Neoplasien sonst selten vorkommen. Zusätzlich wurde eine Hypermethylierung der Gene des B-Zell-Programms mit Stilllegung der entsprechenden B-Zellantigen-Expression beobachtet, die hierdurch auch zur Transdifferenzierung beitragen kann.
T-Zell-Neoplasien
Eine weitere bedeutsame langfristige Komplikation der CAR-T-Zell-Therapie ist das im Jahr 2023 erstmals von der FDA und anschließend auch von der EMA berichtete erhöhte Risiko für die Entwicklung von T-Zell-Neoplasien nach anti-BCMA- oder anti-CD19-gerichteten autologen CAR-T-Zell-Therapien.12 Diese Berichte sind von besonderer Relevanz, da sie eine mögliche Assoziation zwischen der CAR-Transduktion und einer malignen Transformation der T-Zellen implizieren.
Weltweit haben bislang über 40000 Patient:innen zugelassene CAR-T-Zell-Produkte erhalten. Bei einem durchschnittlichen Wert von 108 CAR-positiven Zellen pro Patient:in lässt sich hochrechnen, dass mehr als 1013 zufällige Vektorintegrationen stattgefunden haben können, zumal einzelne Zellen multiple Integrationsereignisse aufweisen können. Dennoch deuten aktuelle Daten darauf hin, dass das Risiko sekundärer Malignome nach CAR-T-Zell-Therapie nicht wesentlich höher ist als bei Patient:innen, die intensive zytotoxische Therapien erhalten haben.13,14
Bisher wurden etwa 30 Fälle sekundärer T-Zell-Lymphome nach CAR-T-Zell-Therapie beschrieben, von denen jedoch noch nicht alle vollständig molekularbiologisch untersucht sind.12–18 In sechs Fällen konnte das CAR-Transgen innerhalb des malignen Klons nachgewiesen werden. Die Mehrzahl dieser Neoplasien trat innerhalb von zwei Jahren nach der CAR-T-Zell-Gabe auf.
Neben einer Insertion des CAR-Vektors in onkogenrelevante Regionen kommen weitere Mechanismen als mögliche transformierende Ursachen infrage, wie z.B.:
-
genetische oder epigenetische Veränderungen während der Ex-vivo-Expansion der T-Zellen
-
eine anhaltende T-Zell-Aktivierung in einem zytokinreichen Mikromilieu nach der Therapie
-
das Vorliegen (prä-)maligner somatischer Mutationen bereits in der Ausgangs-T-Zell-Population
Letzteres konnte bei einer Patientin beobachtet werden, die einen Monat nach CAR-T-Zell-Therapie eines EBV-positiven diffusen großzelligen B-Zell-Lymphoms ein EBV-positives T-Zell-Lymphom entwickelte. Detaillierte molekulare Analysen zeigten, dass beide Neoplasien von einer gemeinsamen hämatopoetischen Stammzellpopulation abstammten, die Mutationen in den Genen TET2 und DNMT3A trug.14
Für die hämatopathologische Diagnostik ergeben sich daraus neue Aufgaben: In Zukunft wird erwartet werden, dass Patholog:innen nicht nur Resistenzmechanismen und Sekundärneoplasien identifizieren, sondern auch den Phänotyp, die Persistenz und die tumorinfiltrierende Aktivität von CAR-T-Zellen überwachen sowie prädiktive Marker für den Therapieerfolg definieren. Diesbezüglich ist insbesondere der In-situ-Nachweis von CAR-T-Zellen von großem Interesse.
Die derzeit verfügbaren Nachweismethoden und ihre Limitationen sind in Tabelle 2 zusammengefasst, wobei keine der genannten Methoden bereits in der Routinediagnostik verfügbar ist.19
Tab. 2: Möglichkeiten eines In-situ-Nachweises von chimären Antigenrezeptoren (modifiziert nach Chen PH et al.)19
Literatur:
1 Cappell KM, Kochenderfer JN: Nat Rev Clin Oncol 2023; 20(6): 359-71 2 Eshhar Z et al.: Proc Natl Acad Sci USA 1993; 90(2): 720-24 3 Bushman FD: Mol Ther 2020; (2)28: 352-6 4 Ye X et al.: Front Immunol 2025; 16: 1490491 5 Majzner RG, Mackall CL: Cancer Discov 2018; 8(10): 1219-26 6 Neelapu SS et al.: N Engl J Med 2017; 377(26): 2531-44 7 Orlando EJ et al.: Nat Med 2018; 24(10): 1504-6 8 Sworder BJ et al.: Cancer Cell 2023; 41(1): 210-25 9 Laurent C et al.: Am J Surg Pathol 2022; 46(9): 742-53 10 Jacoby E et al.: Nat Commun 2016; 7: 12320 11 Zhang Q et al.: Blood 2020; 136(17): 1980-3 12 Levine BL et al.: Nat Med 2024; 30(2): 338-41 13 Elsallab M et al.: Blood 2024; 143(20): 2099-2105 14 Hamilton MP et al.: N Engl J Med 2024; 390(22): 2047-60 15 Ghilardi G et al.: Nat Med 2024; 30(4): 984-9 16 Ozdemirli M et al.: N Engl J Med 2024; 390(22): 2074-82 17 Lamble AJ et al.: Blood Adv 2024; 8(13): 3544-8 18 Berg P et al.: Mol Med 2025; 17(2): 211-8 19 Chen PH et al.: Am J Pathol 2024; 194(8): 1409-23
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...