Patientenselektion in der CAR-T-Zell-Therapie
Autor:
OA Dr. Jakob D. Rudzki
Department für Innere Medizin
Abt. f. Hämatologie & Onkologie
KMT Ambulanz + Station
CAR-T-Coordinator
MUI/Tirol Kliniken
E-Mail: jakob.rudzki@tirol-kliniken.at
Das österreichische CAR(„chimeric antigen receptor“)-T-Zell-Netzwerk wurde im Herbst 2019 gegründet und umfasst sechs hochqualifizierte Zentren in unterschiedlichen Bundesländern. Als gemeinsames Ziel wurde die Harmonisierung des Zugangs zur CAR-T-Zelltherapie in allen CAR-T-Zentren Österreichs definiert.
Keypoints
-
Patientenselektion im Rahmen des CAR-T-Zell-Netzwerks zielt primär darauf ab, den existierenden Daten zufolge jenen Patienten den Zugang zu einer effektiven Therapie zu ermöglichen, die mit hoher Wahrscheinlichkeit zu den Long-Term-Respondern gehören.
-
Eine harmonisierte Vorgehensweise in allen sechs CAR-T-Zentren im Rahmen des CAR-T-Zell-Netzwerks eröffnet die unikale Chance, auch „Problempatienten“ mit z.B. High-Risk-Lymphomen einheitlich zu evaluieren, diese ebenso zu behandeln und im Sinne einer Qualitätsprüfung auch gemeinsam auszuwerten. Auf diese Weise gelingt es eventuell einen Schritt näher an Informationen zu gelangen, die eine prospektive Risikostratifizierung dieses Patientenkollektivs erlauben.
-
Die Zusammenarbeit mit den Zuweiserhäusern lässt sich nur dann substanziell verbessern, wenn der Weg auch gemeinsam beschritten wird. Diskussionsbereitschaft und breite Informationsvermittlung wird dann auch in einer adäquaten Patientenzuweisung und -behandlung resultieren.
-
Die CAR-T-Zell-Therapie sollte einen wichtigen Stellenwert im Therapiealgorithmus einnehmen, mit einem hohen Therapieanspruch – und somit nicht als letzte Linie oder gar als Notfalltherapie angesehen werden. Soll dieses Konzept erfolgreich sein, muss es schon früh angedacht und diskutiert werden, um adäquate Schritte zu planen, ohne dabei den aktuell vorherrschenden Therapiealgorithmus zu unterlaufen.
Derzeit gibt es in Österreich sechs CAR-T-Zentren (von Osten nach Westen):
-
Medizinische Universitätsklinik Wien/Allgemeines Krankenhaus Wien,
-
St.-Anna-Kinderspital, Wien,
-
Medizinische Universitätsklinik Graz/Landeskrankenhaus Universitätsklinikum Graz,
-
Ordensklinikum Elisabethinen Linz,
-
Paracelsus Privatmedizinische Universität/Landeskrankenhaus Salzburg,
Medizinische Universität Innsbruck/ Tirol Kliniken.
Das CAR-T-Zell-Netzwerk wurde im Herbst 2019 gegründet und hatte von Beginn an ein ambitioniertes primäres Ziel: eine Harmonisierung des Zugangs zur CAR-T-Zell-Therapie in allen aktiv behandelnden CAR-T-Zentren Österreichs. Dieser unikale Konsensus aller genannten CAR-T-Zentren wurde als Leitstruktur in Form eines Positionspapiers verschriftlicht, um als Leitstruktur für CAR-T-Zentren zu dienen.1 Auf diese Weise wurde unnötiger Patiententourismus im Vorfeld unterbunden. Auf der anderen Seite wurde der Grundstein zu einer Zusammenarbeit der Zentren gelegt, welche einen regen Austausch von Patienten ermöglichte und so diverse Studienprotokolle unabhängig von Bundeländergrenzen zugänglich machte.
Vor Ort kann auf bewährte und profunde Art und Weise in lokalen Tumorboards diskutiert und zugleich aber auch im Falle von komplexen Fällen zwischen den CAR-T-Zentren beratend und diskutierend agiert werden. Dies erfolgt stets im Lichte der aktuell vorherrschenden Erkenntnisse aus bereits vorliegenden Studienergebnissen oder aber auch basierend auf neuen Wissensstandards. Somit wird die Diskussion immer auf der Grundlage der aktuellen Erkenntnisse der CAR-T-Community geführt.
Der „Austrian CAR T selection algorithm“
Ein weiterer wichtiger Meilenstein der Zusammenarbeit der einzelnen CAR-T-Zentren in Österreich definierte sich mit der Entwicklung des Österreichischen Patienten-Selektionsalgorithmus. Wie hinlänglich bekannt, wird anhand von 5Hauptselektionskriterien und 7 Nebenselektionskriterien eine Beurteilung der Eignung eines Patienten für die zugelassene kommerzielle CAR-T-Zell-Therapie in der Entität des relapsierten/refraktären diffusen großzelligen B-Zell-Lymphoms (DLBCL) getroffen. Eine ausführliche und fundierte Diskussion und Beurteilung der Patienten ermöglichen es letztendlich, jene Patienten zu selektionieren, die, aller Voraussicht nach, den größtmöglichen Benefit mit dieser Therapie erzielen.
Eine unumstrittene Tatsache ist, dass all jene Patienten, die kaum Komorbiditäten aufweisen, kaum Komplikationen (wie das Zytokinfreisetzungssyndrom [CRS] oder das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom [ICANS]) im Zuge der CAR-T-Zell-Therapie entwickeln, bzw. wenn diese doch in unterschiedlichem Ausmaß auftreten, diese zumindest besser überstanden werden. Diese Aspekte können derzeit leider noch nicht in direkten Bezug zu prospektiven Markern gebracht werden. Es handelt sich hier aber in letzter Instanz um ein erklärtes Ziel zahlreicher Gruppen auf dem Gebiet der CAR-T-Zell-Anwendung und wissenschaftlichen Forschung, speziell auch in Österreich.
Die „Lebendigkeit“ eines angewandten Algorithmus
Ein ausgewiesenes Ziel des genannten Selektionsalgorithmus ist es auch, am Puls der Zeit zu bleiben und somit neuen Erkenntnissen Raum zu bieten, damit diese in die praktische Anwendung von CAR-T-Zellen Einzug halten mögen.
Bereits im CART2020 Meeting in Sitges (Spanien) wurde das erste Amendment vom Vorsitzenden und Gründer des CAR-T-Netzwerks, Prof. Dr. Uli Jäger, nach konsensueller Beratung aller sechs CAR-T-Zentren und deren Vertreter verlautbart. Anstoß der Diskussion war, wie so oft, ein Patientenfall in einem der Zentren (Medizinische Universität Innsbruck), der anlassbezogen dazu genützt wurde, um über den Stellenwert der zerebralen Beteiligung im Rahmen des DLBCL zu diskutieren. Unter Reflexion der präsentierten Daten der Studie TRANSCEND NHL-001, bei welcher diese Patienten im Unterschied zu den pivotalen Zulassungsstudien JULIET oder ZUMA-1 nicht per se ausgeschlossen wurden und somit eine erfolgreiche Machbarkeit demonstriert werden konnte, wurde eine Abänderung des bestehenden Algorithmus in puncto zerebrale Manifestation im Rahmen des DLBCL aufgenommen.2,3
Um bei diesem Bespiel zu bleiben: Eine erneute Adaptierung in genau diesem Aspekt wurde beim diesjährigen CAR-T-Netzwerk-Meeting (22.–23.03.2021, virtuell) nach wiederholter Diskussion in den zuvor abgehaltenen diversen CAR-T-Zell-Meetings des Netzwerks konsensuell festgelegt. Präsentiert wurde dies von mir im Rahmen des Netzwerk-Meetings, aber auch auf der Frühjahrstagung der Österreichischen Gesellschaft für Hämatologie & Medizinische Onkologie (OeGHO) im Zuge des Vortrags „CAR-T-Cells und zelluläre Therapien“.
Die Updates der Daten der Studie TRANSCEND NHL-001 (Lisocabtagen maraleucel® für das r/r DLBCL und zahlreiche Subtypen)4, aber auch die zahlreichen Real-Life-Datenberichte und -präsentationen 2021 (im Rahmen der Tagungen der American Society of Hematology, der European Hematology Association und der European Society for Blood and Marrow Transplantation) über die Beteiligung des Zentralnervensystems (ZNS) bei DLBCL im realen Setting außerhalb von Studien legten allesamt nahe, die Implementierung der Änderung im Selektionsalgorithmus zu gestatten, von ursprünglich „keine ZNS-Beteiligung“ zu vorerst „no active/symptomatic CNS involvement at the time of infusion“ (entspricht dem erwähnten 1st Amendment, vorgeschlagen am CART2020 in Sitges durch Prof. Dr. U. Jäger stellvertretend für das CAR-T-Netzwerk).
Auch dieser Passus unterlag im Lichte der aktuellen Erkenntnisse einer Änderung und wurde durch eine weitere Adaptierung im Rahmen des rezenten CAR-T-Netzwerk-Meetings angekündigt und wie folgt formuliert: „stabile ZNS-Beteiligung zum Zeitpunkt der Infusion“ (2nd Amendment, März 2021). Dies soll vielmehr eine beherrschbare und stabile ZNS-Manifestation widerspiegeln und somit auch diesen Patienten einen Zugang zur CAR-T-Zell-Therapie ermöglichen. Denn letztlich zeigte sich, dass jene Patienten keinen substanziellen Nachteil im Sinne einer erhöhten Komplikationsrate oder gar eines schlechteren Ansprechens auf CAR-T-Zell-Therapien aufwiesen.
Verbesserung der Kommunikation mit den Zuweiserzentren
Einmal mehr ist darauf zu verweisen, dass eine Therapie nur dann erfolgreich angewandt werden kann, wenn eine gezielte Anwendung gewährleistet wird, diese aber auch bei all jenen Patienten ankommt, die jene Therapie wirklich benötigen. Um zu vermeiden, dass diese Patienten nicht erkannt oder gar zu spät an ein CAR-T-Zentrum zugewiesen werden, hat sich das CAR-T-Netzwerk auch mit dieser Thematik tiefgründig auseinandergesetzt.
Der erste Schritt wurde letztes Jahr mit der Entwicklung von Informationskarten mit namentlicher Auflistung aller österreichweit Hauptverantwortlichen und Ansprechpartner in Bezug auf die CAR-T- Zell-Therapie in den jeweiligen CAR-T-Zentren gesetzt. Dies ermöglicht den Kollegen der Zuweiserhäuser eine direkte Kontaktaufnahme mit den Zentren und somit eine rasche Evaluation eines potenziellen CAR-T-Patienten, sei es im Sinne einer möglichen Teilnahme an einer laufenden Studie oder der Vorstellung bezüglich der kommerziellen Anwendung der CAR-T-Zell-Therapie.
Ein nächster und auch wesentlicher Schritt, um die Zuweisung von potenziellen CAR-T-Zell-Therapie-Patienten zu verbessern, ergab sich mit der Entwicklung von Zuweiserformularen. Ein solches ist im Detail in der Abbildung 1 dargestellt, hier mit dem Logo der Medizinischen Uniklinik Innsbruck/Tirol Kliniken als Beispiel. Dieses wird je nach CAR-T-Zentrum durch das jeweilige Hauslogo ersetzt. Das Formular unterstützt jeden Zuweiser darin, alle für den CAR-T-Beauftragten wichtigen Informationen bereits zu Beginn in übersichtlicher Form online in Form eines ausfüllbaren PDF-Formulars anzuführen. Auf diese Art und Weise kommt es zu einer Harmonisierung und zugleich Erhöhung der Qualität der weitergeleiteten Information bezüglich eines potenziellen CAR-T-Zell-Therapie-Patienten an das CAR-T-Zentrum.
Abb. 1: Zuweiserformular – interaktives PDF-Formular zur Online-Anwendung (hier mit dem Logo der MUI/ Tirol Kliniken – wird je nach CAR-T-Zentrum mit dem jeweiligen Hauslogo angepasst)
Das High-Risk-Lymphoma-Szenario
Ein durchaus brisantes Thema befasst sich mit einer kleinen, aber überaus wichtigen Subgruppe an Patienten mit großzelligem B-Zell-Lymphom, welche hier unter dem Synonym des High-Risk-Lymphoma-Szenarios subsummiert wird. Diese spezielle Gruppe an Patienten trägt meist charakteristische Merkmale:
-
einen hohen aaIPI ≥3 („age adjusted“ internationaler prognostischer Index),
-
eine „bulky disease“ (definitionsgemäß eine lokale Lymphommanifestation mit einem Durchmesser ≥8cm),
-
eine extranodale Manifestation (zusätzlicher negativer prognostischer Marker) sowie
eine deutlich erhöhte Laktatdehydrogenase (LDH>ULN) vor dem Leukapheresetermin (ebenso prognostisch ungünstig).11,12
Ebenso fließen
-
genetische Merkmale wie Rearrangements (im Falle eines High-Grade-Lymphoms [BCL-2- , BCL-6-, myc- Rearrangements]) und „Double expressor“-Status (wenngleich dies auch keine eigene histologische Entität darstellt, aber prognostisch als ungünstig anzusehen ist)13 und
(immun-)histologische Eigenschaften, wie blastäre Morphe oder ein hoher Ki-67-Proliferationsindex, ein.
Des Weiteren ist sowohl für das Ansprechen als auch für die anhaltende Response unter CAR-T-Zell-Therapie der Performance-Score des Patienten als prognostisch relevant und als evident wichtig zu erachten. Gleichermaßen relevant ist der ZNS-Status im Sinne einer möglichen Beteiligung im Rahmen der Grunderkrankung (hier sei auf den weiter oben diskutierten und adaptierten „Austrian selection algorithm“ verwiesen).5
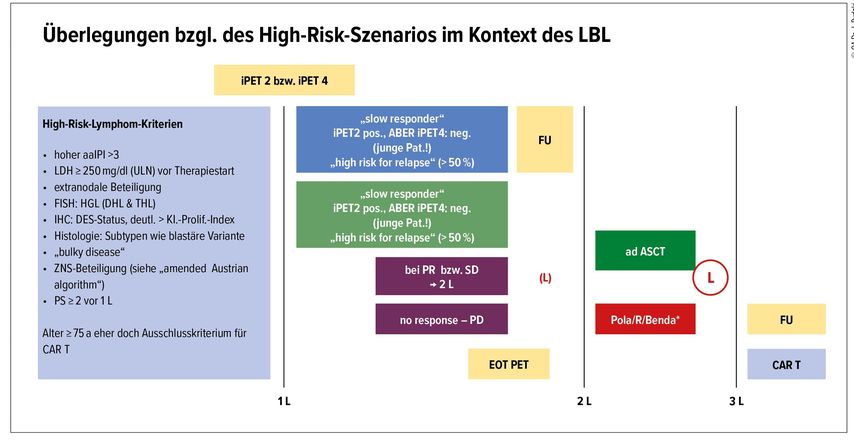
Das Alter der Patienten ist an sich kein Ausschlusskriterium, jedoch speziell ab dem Alter von 75 muss angesichts der Daten, die von Fitzgerald et al. im Rahmen des ASH-Meetings 2020 präsentiert worden waren, die CAR-T-Zell-Therapie wohl kritisch hinterfragt werden.14 Hier konnte die grundsätzliche Machbarkeit auch im hohen Alter gezeigt werden, dennoch verweisen die Autoren des Abstracts auch darauf, dass vor allem die neurologische Komplikationsrate unter der CAR-T-Zell-Therapie mit beträchtlich erhöhtem Alter signifikant zunimmt. Angesichts der in dieser Situation vorliegenden alternativen Therapieoptionen ist die Wahl der CAR-T-Zell-Therapie in dieser speziellen Alterskategorie wohl kritisch zu hinterfragen. In Abbildung 2 wird im Detail dargestellt, wie ein solcher Patient durch die jeweiligen Linien der Therapie mittels bildgebender Evaluation (Interim-Positronenemissions-Tomografie [PET]) früh genug bezüglich des Therapieansprechens erfasst werden kann, in direkter Anlehnung an die Daten von Casasnovas et al.6–10
Abb. 2: High-Risk-Lymphoma-Szenario mit Darstellung eines konsensuellen „Algorithmus“ der frühen Evaluation und Durchführung einer „frühen“ Leukapherese in diesem speziellen, oftmals therapierefraktären Patientenkollektiv. LBL, „large B cell lymphoma“; iPET, interim PET CT; FU, Follow-up; EOT, „end of treatment“; aaIPI, age-adjusted IPI; LDH, Laktatdehydrogenase; FISH, Fluoreszenz-in-situ-Hybridisierung; IHC, Immunhistochemie; HGL, „high grade lymphoma“; DHL, Double-Hit-Lymphome; THL, Triple-Hit-Lymphome; DES, „double expressor status“; KI.-Prolif., KI Proliferationsindex; PS, „performance score“; PR, partielle Remission; SD, „stable disease“; PD, „progressive disease“; L, Leukapherese; ASCT, autologe Stammzelltransplanatation; CAR T, „Chimeric antigen receptor“-T-Zellen; Pola/R/Benda, Polatuzumab/ Rituximab/ Bendamustin; 1 L, erste Linie; 2 L, zweite Linie, 3 L, dritte Linie der Therapie. * Wenn hier eine L. evaluiert und durchgeführt wird – dann vor der Gabe von Bendamustin bzw. wenn Therapie nötig, dann die ersten 2 Zyklen P/R/Benda ohne Bendamustin!
Ein wichtiger Aspekt der hier früher angesetzten Leukapherese wurde konsensuell im CAR-T-Netzwerk diskutiert. Für diese spezielle Population von DLBCL-Patienten, die offensichtlich bereits auf die Erstlinientherapie nicht optimal/suboptimal ansprechen und für die zweite Linie der Therapie evaluiert werden, könnte zeitgleich eine frühe Leukapherese interessant werden. Zum einen werden Zellen für ein eventuelles Manufacturing von CAR-T-Zellen reserviert und zum anderen wird gewährleistet, dass durch eine nachgeschaltete Zweitlinientherapie keine ungewollte/unplanmäßige Lymphopenie ein suffizientes Manufacturing verhindern könnte. Da es sich hier um eine kleine Gruppe an Patienten mit refraktärem Lymphom handelt, wurde im CAR-T-Netzwerk dieses konsensuelle Vorgehen beschlossen, welches die Option einer frühen Besprechung und Planung einer CAR-T-Zell-Therapie mit eventueller Durchführung einer frühen Leukapherese (noch vor Beginn der zweiten Linie der Therapie nach initialem Therapieversagen) eröffnet. Der große Vorteil einer solchen gemeinsam beschlossenen Vorgehensweise liegt darin, dass auf diese Weise über alle sechs Zentren gleich entschieden und verlaufskontrolliert (Interim-PET) wird und letztlich auch die Generierung der CAR-T-Zellen zu exakt dem gleichen Zeitpunkt erfolgt, um eine Vergleichbarkeit der so gesammelten Daten am Ende zu ermöglichen (Ansprechen, progressionsfreies Überleben, Gesamtüberleben etc.) (Abb. 2).
Fazit
Es konnte erneut gezeigt werden, dass sechs Zentren ein gemeinsames Ziel ansteuern („engineered immunity – CARs to kill cancer“) und somit in aufeinanderabgestimmter Form an diese Thematik herantreten. Die Patienten werden auf diese Weise in harmonisierter Form für die kommerzielle CAR-T-Zell-Therapie evaluiert, zeitgleich eröffnet dies auch den lebendigen Austausch in Bezug auf das Rekrutieren von Patienten in die aktuell in Österreich vorherrschende Studienlandschaft der CAR-T-Studien bzw. die kommerzielle CAR-T-Zell-Therapie. Es fördert die Qualität der Zuweisung und letztlich unterstützt dieses Vorgehen, dass Patienten, die sich für eine derartige wertvolle und effektive Therapie eignen, dieser zeitgerecht vorgestellt werden.
Literatur:
1 Greinix HT et al.: Memo 2020; 13: 27-31 2 Neelapu SS et al.: N Engl J Med 2017; 377: 2531-44 3 Schuster SJ et al.: NEngl J Med 2019; 380: 45-564 Abramson JS et al.: JClin Oncol 2018; 36: 7505 5 Iacoboni G et al.: Real-world evidence of tisagenlecleucel for the treatment of relapsed or refractory large B-cell lymphoma. Cancer Med 2021; 10: 3214-23 6 Nols N et al.: Leuk Lymphoma 2014; 55: 773-80 7 Gouill SL, Casasnovas RO: Blood 2017; 129: 3059-70 8Casasnovas RO et al.: Blood 2011; 118: 37-43 9 Lin C et al.: J Nucl Med 2007; 48: 1626-32 10 Kasamon YL, Wahl RL: Curr Opin Oncol 2008; 20: 206-19 11 Jäger U et al.:ASH-Meeting 2020; Abstr. #1194 12 Iacoboni G et al.: ASH-Meeting 2020; Abstr. #1220 13 Chong EA et al.: ASH-Meeting 2020; Abstr. #1213 14 Fitzgerald L et al.: ASH-Meeting 2020; Abstr. #3038
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...