Palliativmedizin im klinischen Alltag
Autorin:
Dr. Eva Stauß-Christner
Fachärztin für Gynäkologie und Geburtshilfe, Zusatz-Weiterbildung Palliativmedizin
Universitätsklinikum und Medizinische Fakultät
Tübingen
Die Palliativmedizin ist ein junges Fachgebiet. Seit Gründung der ersten Palliativstation in Köln im Jahr 1983 kam es zu einer bedeutsamen Entwicklung in der Palliativversorgung in Deutschland. In Österreich eröffnete 1992 im Krankenhaus Göttlicher Heiland die erste Hospizstation, die später aus finanziellen Gründen in eine Palliativstation umgewandelt wurde. Mittlerweile gibt es eine Vielzahl an unterschiedlichsten Angeboten palliativer Betreuungsmöglichkeiten, um die individuellen Bedürfnisse der Patient:innen sowie deren Familien zu berücksichtigen.
Keypoints
-
Die frühe Integration einer palliativmedizinischen Mitbehandlung ist bereits in frühen Phasen einer nicht heilbaren Erkrankung sinnvoll und indiziert.
-
Zur adäquaten Symptomerfassung dienen zwei Screeninginstrumente – MIDOS und Distress-Thermometer.
-
Tumorpatient:innen sind mit verschiedensten Symptomen konfrontiert. Am häufigsten treten Schmerzen, Übelkeit und Erbrechen auf. In Abhängigkeit von der Tumorentität oder der Metastasenlokalisation können Dyspnoe oder eine maligne intestinale Obstruktion eine weitere Symptomlast darstellen. Die Therapie sollte potenzielle Ursachen berücksichtigen und in Abhängigkeit von der Gesamtsituation und nach Maßgabe des Patient:innenwillens in den Behandlungsablauf eingeschlossen werden.
Palliative Care
Das Konzept „Palliative Care“ entwickelte sich ursprünglich aus dem Lebenswerk der englischen Krankenschwester, Sozialarbeiterin und Ärztin Cicely Saunders. In dem von ihr 1967 gegründeten St. Christopher’s Hospice in London sammelte sie über Jahre Erfahrungen in der Begleitung Sterbender. Sie gilt somit als Wegbereiterin der modernen Hospizarbeit und Palliativmedizin.
Nach Schätzungen des Zentrums für Krebsregisterdaten des Robert-Koch-Institutes sind im Jahr 2019 in Deutschland etwa 502000 Krebserkrankungen erstmalig diagnostiziert worden. In Österreich erkranken jährlich etwa 42000 Menschen an Krebs. Etwa 1,6 Millionen Menschen in Deutschland leben mit einer Krebserkrankung, welche innerhalb der letzten fünf Jahre diagnostiziert worden ist. Die relative 5-Jahres-Überlebensrate von Krebspatient:innen im Vergleich zur allgemeinen Bevölkerung gleichen Alters und Geschlechts ist stark von der Tumorentität abhängig. Dieser Umstand zeigt die Notwendigkeit einer bestmöglichen Betreuung und Versorgung von Patient:innen sowie deren Angehörigen in dieser existenziellen Ausnahmesituation.
Die frühe Integration einer palliativmedizinischen Mitbehandlung ist bereits in frühen Phasen einer nicht heilbaren Erkrankung sinnvoll und indiziert, um die Lebensqualität der Patient:innen zu erhalten und nach Möglichkeit zu verbessern. Im Rahmen der palliativmedizinischen Interventionsstudie von Temel JS et al. (2010) konnte das Konzept „early palliative care“ bestätigt werden. Durch die frühzeitige palliativmedizinische Mitbetreuung zeigte sich bei Patient:innen mit einem metastasierten nichtkleinzelligen Bronchialkarzinom eine höhere Lebensqualität. Es kam zu weniger Klinikeinweisungen. Die Patient:innen entwickelten ein besseres Verständnis für ihre Prognose. Depressive Störungen traten weniger auf und es wurden weniger palliative Chemotherapien in den letzten acht Wochen vor Versterben durchgeführt.
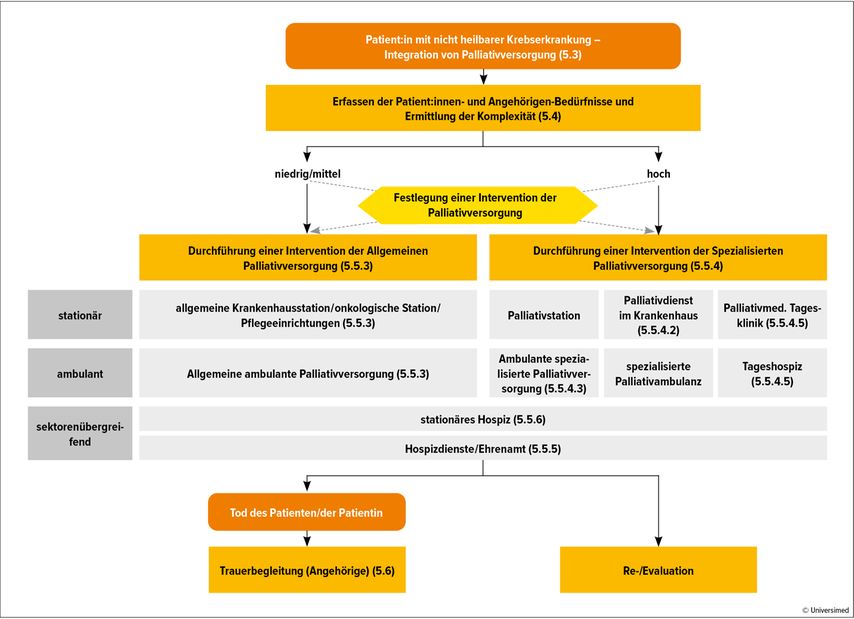
Am erstaunlichsten war aber, dass sich die Überlebenszeit signifikant von acht auf elf Monate verlängerte, obwohl die Patient:innen gegen Ende ihres Lebens meist weniger aggressiv therapiert wurden. Ein Behandlungspfad, der den Betroffenen ab dem Zeitpunkt der Diagnosestellung Orientierung bietet und mögliche Versorgungsoptionen aufzeigt, um deren individuelle Bedürfnisse zu berücksichtigen, wurde von der S3-Leitlinie „Palliativmedizin“ entwickelt (Abb. 1).
Abb. 1: Behandlungspfad für Patient:innen und Angehörige, S3-Leitlinie Palliativmedizin, Langversion 2.2., September 2020
Symptomerfassung
Da viele Patient:innen im Rahmen einer nicht heilbaren Erkrankung bereits frühzeitig unter deutlichen Einschränkungen der Lebensqualität aufgrund einer entsprechenden Symptomlast leiden, ist eine regelmäßige und strukturierte Symptomerfassung zur Qualitätssicherung und Evaluation des Behandlungserfolges unerlässlich und sie sollte integraler Bestandteil des palliativmedizinischen Handelns sein. Im Behandlungsalltag haben sich zwei Screeninginstrumente als hilfreich erwiesen, die den Betroffenen als Fragebögen zur Selbsteinschätzung ausgehändigt werden können.
Minimales Dokumentationssystem
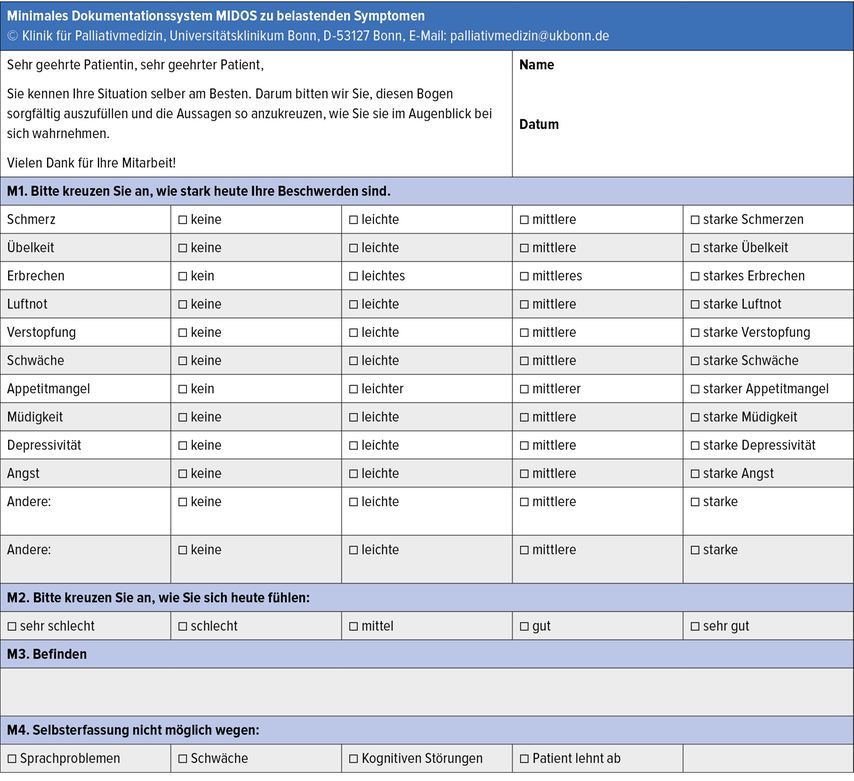
Die in dem Screeninginstrument Minimales Dokumentationssystem (MIDOS) abgebildeten Dimensionen betreffen die Intensität der Symptome sowie das Befinden, das orientierend die Lebensqualität abbildet (Abb. 2). Es kann als Selbsteinschätzung durch die Patient:innen oder als Fremderfassung beispielsweise durch die Angehörigen erfolgen. Aufgrund der geringen Belastung sowie des niedrigen Zeitaufwandes ist dieses System für regelmäßige Verlaufskontrollen geeignet.
Abb. 2: Minimales Dokumentationssystem MIDOS zu belastenden Symptomen. Deutsche Gesellschaft für Palliativmedizin
Distress-Thermometer
Zur Erfassung psychosozialer Belastungen bei onkologischen Patient:innen dient das Distress-Thermometer, welches aus einer Skala von 0–10 und einer zusätzlichen Problemliste besteht. Bei entsprechender Belastung können die Betroffenen an die jeweiligen professionellen Dienste überwiesen werden.
Kontrolle häufiger Symptome
Übelkeit/Erbrechen
Bei fast 60% aller Patient:innen mit einer fortgeschrittenen Tumorerkrankung treten in deren Verlauf Übelkeit und/oder Erbrechen auf. Dies kann sich erheblich auf die Lebensqualität auswirken. Das Symptom Übelkeit/Erbrechen wird von Patient:innen sehr unterschiedlich wahrgenommen.
Häufig wird die beim Erbrechen auftretende Begleitsymptomatik als belastend empfunden (z.B. Würgen, Kreislaufdysregulation, Schweißausbruch, epigastrische Schmerzen). Bei anhaltendem Erbrechen kann es zu somatischen Folgeerscheinungen wie Schleimhautschädigung, Dehydratation, Elektrolytstörungen oder Mangelernährung kommen.
Die Ursachen für Übelkeit/Erbrechen sind sehr vielschichtig. So können gastrointestinale Veränderungen oder ZNS-Veränderungen (z.B. Hirnfiliae) ursächlich sein. Des Weiteren kann Übelkeit/Erbrechen durch psychische Ursachen hervorgerufen werden oder medikamenteninduziert sein.
Im Vordergrund steht die symptomatische Therapie. Eine apparative Diagnostik ist in den meisten Fällen nicht indiziert. Die Therapie richtet sich nach der vermuteten Ursache. Reversible Ursachen, wie z.B. Hirndruck, Aszites, Hyperkalzämie, Schmerzen etc., sollten rasch behandelt werden. Alle nicht zwingend erforderlichen Medikamente sollten abgesetzt werden.
Die Antiemese sollte regelmäßig verabreicht werden. Bei ausgeprägter Symptomlast ist zu Beginn eine parenterale Gabe sinnvoll. Zeigt sich im Verlauf eine stabile Symptomkontrolle, kann die Antiemese versuchsweise oralisiert werden. Bei unzureichender Symptomkontrolle trotz Kombinationstherapie mit zwei Präparaten kann die Hinzunahme von Steroiden sinnvoll sein. Eine engmaschige Reevaluation der Therapie ist im Hinblick auf Dosiserhöhung oder Hinzunahme weiterer Antiemetika mit anderem Wirkansatz unabdingbar.
Obstipation/Ileus
Ungefähr 3% aller Tumorpatient:innen entwickeln im Verlauf ihrer Erkrankung eine maligne intestinale Obstruktion (MIO). Diese kann komplett oder inkomplett sein.
Am häufigsten hiervon betroffen sind Patient:innen mit einem Ovarialkarzinom (40%) sowie Patient:innen mit kolorektalen Tumoren (25%). Zur Diagnosestellung dient in der Regel die körperliche Untersuchung sowie die apparative Diagnostik mit Ultraschall und ggf. eine Computertomografie.
Sofern es sich um eine umschriebene Obstruktion handelt und der Allgemeinzustand der Betroffenen gut ist, ist eine operative Therapie meist möglich. Die Verbesserung der Darmpassage mit entsprechenden medikamentösen Maßnahmen kann bei einer inkompletten MIO sinnvoll sein.
Bei kompletter MIO steht die Symptomlinderung im Vordergrund. Eine effektive Antiemese, Sekretionshemmung, Spasmolyse und Analgesie sind besonders wichtig. In diesem Zusammenhang sollte auch frühzeitig an das Legen einer Ablauf-PEG(perkutane endoskopische Gastrostomie)-Sonde gedacht werden.
Dyspnoe
Die Atemnot ist eine subjektive unangenehme Erfahrung und ähnlich dem „Total-Pain-Konzept“ ein mehrdimensionales Symptom (sensorisches Erleben der Atemnot, emotionale Belastung und Beeinträchtigung durch die Atemnot). Zu Beginn müssen mögliche behandelbare Ursachen, wie z.B. eine Pneumonie, ermittelt werden und einer gezielten Therapie unter Berücksichtigung des Patient:innenwillens und in Zusammenschau der medizinischen/onkologischen Gesamtsituation zugeführt werden.
Bei fehlendem pathologischem Korrelat ist eine symptomatische Therapie indiziert. Hierbei spielt die Therapie mit Opiaten die größte Rolle. Die Linderung der Symptomlast lässt sich darauf zurückführen, dass im gesamten kardiorespiratorischen System Opioidrezeptoren vorhanden sind. Sollte sich die Atemnot-Symptomatik durch Opioide nicht ausreichend kontrollieren lassen, kann die Hinzunahme von Benzodiazepinen eine weitere Verbesserung bringen. Der wohl zugrunde liegende Wirkmechanismus besteht in einer verbesserten „coping capacity“.
Glukokortikoide werden generell nicht zur Behandlung der Atemnot eingesetzt. Ausnahmen stellen die Lymphangiosis carcinomatosa oder die Atemwegsobstruktion durch einen Tumor dar.
Schmerz
Das am häufigsten assoziierte Symptom bei Tumorerkrankungen ist der Schmerz. Bei ca. 50–80% der onkologischen Patient:innen treten im Verlauf der Erkrankung behandlungsbedürftige Schmerzen auf. Der Erfolg einer Schmerztherapie hängt entscheidend davon ab, ob die Schmerzursache korrekt diagnostiziert wurde. Die Schmerzen können tumorbedingt, therapiebedingt, tumorassoziiert oder tumorunabhängig sein. Es werden Nozizeptorschmerzen (somatisch/viszeral) und neuropathische Schmerzen unterschieden.
Die orale Applikation der Schmerzmedikation ist die Methode der Wahl, da dies die Autonomie der Patient:innen berücksichtigt. Die Einnahme sollte nach einem festen Zeitplan erfolgen. Der Therapieerfolg kann über verschiedene Instrumente zur Schmerzmessung („Verbal Rating Scale“ [VRS] oder visuelle Analogskala [VAS]) evaluiert werden, sodass eine kontrollierte Dosisanpassung jederzeit vorgenommen werden kann. Nebenwirkungen sollten durch eine entsprechende Begleitmedikation prophylaktisch behandelt werden (z.B. Übelkeit unter Opiattherapie). Die medikamentöse Schmerztherapie erfolgt nach dem bekannten WHO-Stufenschema.
Literatur:
• Bausewein C et al.: Leitfaden Palliative Care 2021 • Deutsche Gesellschaft für Palliativmedizin, AWMF. Erweiterte S3-Leitlinie Palliativmedizin für Patient:innen mit einer nicht heilbaren Krebserkrankung, Langversion 2.2 – September 2020; AWMF-Registernummer 128/001-OL • Hackl M & Ihle P: Krebserkrankungen in Österreich. Statistik Austria 2022 • Mehnert A et al.: Die deutsche Version des NCCN Distress-Thermometers. Empirische Prüfung eines Screening-Instruments zur Erfassung psychosozialer Belastung bei Krebs-Patient:innen. Zeitschrift für Psychiatrie, Psychologie und Psychotherapie 2006; 54(3): 213-32 • Stiel S et al.: Validierung der neuen Fassung des Minimalen Dokumentationssystems (/MIDOS2) für Patient:innen in der Palliativmedizin. Schmerz 2010; 24(6): 596-604 • Temel JS et al.: Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010; 363(8): 733-42 • Zentrum für Krebsregisterdaten, Robert-Koch-Institut. Online unter https://www.krebsdaten.de/krebs/DE/content/krebsarten/krebs_gesamt/krebs_gesamt_node.html
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...