Operative Therapie bei malignen und unklaren Tumoren des Plexus brachialis
Autor:
Univ.-Prof. Dr. med. Thomas Kretschmer
Prim. Abteilung für Neurochirurgie und Neurorestauration, Neurochirurgische Intensivmedizin
Zentrum für Schädelbasischirurgie (GFS) Leiter Neuroonkologisches Zentrum (DKG) Klinikum Klagenfurt
E-Mail: thomas.kretschmer@kabeg.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Chirurgie der Tumoren des Plexus brachialis unterscheidet sich in ihrem Ansatz wesentlich von der klassischen Sarkomchirurgie oder der Operation von Pancoast-Tumoren. Die operativen Behandlungsziele bei einzelnen Plexustumoren sind sehr unterschiedlich, die angewandten Operationstechniken vielfältig. Eine Operation soll möglichst funktionserhaltend erfolgen, wird unter intraoperativem Monitoring und mikrochirurgisch durchgeführt. In geeigneten Fällen werden Transplantatrekonstruktionen eingesetzt.
Keypoints
-
Die operative Therapie von Tumoren des Plexus brachialis ist individuell anzupassen und hängt von der Tumorentität und dem operativen Ziel ab.
-
In Abhängigkeit von der Tumorausdehnung werden Zugänge kombiniert, z.B. klassische Plexus-Zugänge mit dorsalen und anterolateralen Wirbelsäulenzugängen.
-
Der modifizierte (Fiolle-Delmas-)Birch-Zugang ist vielseitig, leicht erweiterbar und bietet eine sehr gute Exposition.
-
Geeignete Retraktoren, mikrochirurgische Präparation und Neuromonitoring verringern die Eingriffsmorbidität und bieten Funktionserhalt.
-
Es gilt, das „bloße Herausschneiden“ benigner und unklarer Entitäten unter Funktionsverlust unbedingt zu vermeiden.
-
Auch maligne Tumoren können mit minimiertem zusätzlichem Funktionsverlust entfernt werden. Eine Transplantatrekonstruktion ist in geeigneten Situationen zu erwägen.
-
Palliativchirurgische Ansätze zur Schmerzreduktion durch Dekompression und mikrochirurgische Neurolyse sind ebenso gerechtfertigt.
Tumoren des Plexus brachialis werden aufgrund ihrer bereits erreichten Größe, wegen positionsabhängiger Missempfindungen im Versorgungsgebiet des Plexus brachialis oder durch Nervenausfälle auffällig. Dies trifft häufig auch auf benigne Neoplasien zu. In über einem Drittel der Fälle und damit mit Abstand am häufigsten handelt es sich bei Tumoren des Plexus brachialis um periphere Nervenscheidentumoren (PNST). Diese entstehen direkt aus den Hüllstrukturen eines oder mehrerer Faszikel des betroffenen Nervs (z.B. Schwann-Zellen, in diesem Fall der Name „Schwannome“).
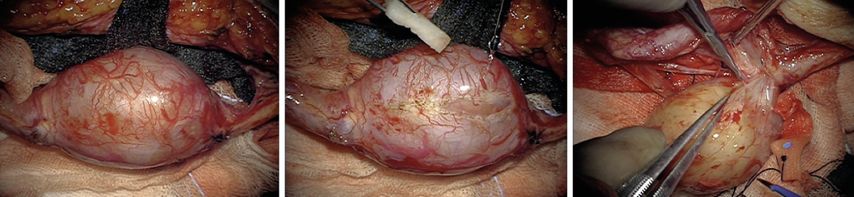
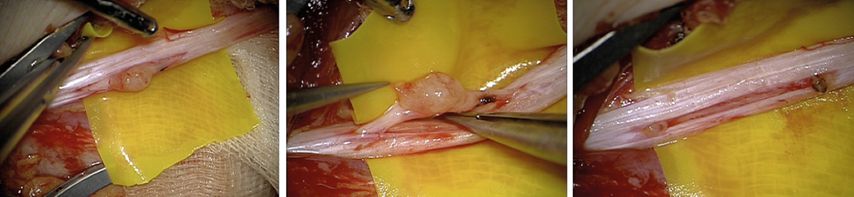
Bei einer operativen Therapie gilt es, unter Anwendung mikro- und nervenchirurgischer Prinzipien benigne periphere Nervenscheidentumoren (meist Schwannome und Neurofibrome) ohne wesentliche funktionelle Defizite zwischen den Faszikeln eines Nervs herauszupräparieren. Gelingen kann das nur, wenn das Wachstumsverhalten und die besondere mikrochirurgische Präparationstechnik zur Exstirpation solcher Tumoren beachtet werden. Die Exstirpation erfolgt unter Mikroskopsicht und Stimulationskontrolle aus dem Faszikelbett. Bei den Ausführenden sollte ausreichend Erfahrung in der Plexuschirurgie besteht (Abb. 1 und 2).1
Abb. 1: Größerer benigner peripherer Nervenscheidentumor (PNST), der in einem motorisch funktionslosen Areal der faszikeltragenden Hüllstruktur, der Pseudokapsel, unter Mikroskopsicht eröffnet (Mitte) und sukzessive aus seinem intakten Faszikelbett ausgeschält wird (rechts, ausgespleißtes, verbreitertes, ehemals tumortragendes Faszikelsegment oberhalb des Tumors)
Abb. 2: Sehr kleiner PNST, der von einem funktionslosen Faszikel ausgeht. Das mikrochirurgische Prinzip beinhaltet die interfaszikuläre Nerveröffnung unter motorischer Stimulation, Separierung der nicht betroffenen Faszikel und Exstirpation des Tumors unter Absetzen am funktionslosen proximalen und distalen Faszikelpol des Tumors mit Sicherheitsabstand
Plexus-brachialis-Tumoren und OP-Indikationen
Benignität und Malignität
Gutartige, zelluläre oder „antike“ Schwannome zeigen deutliche regressive Veränderungen mit Nekrosen. Deswegen können sie bei einer Kernspintomografie bei entsprechender Größe sehr inhomogen imponieren und mit malignen Neoplasien verwechselt werden.
Nur ein sehr geringer Anteil der peripheren Nervenscheidentumoren ist maligne (MPNST). Die Inzidenz in der Normalbevölkerung beträgt 0,001%; 2–5% unter Patienten mitNeurofibromatoseTyp I (NF1).2 Ruheschmerz, auch nachts, ist ein alarmierender Hinweis auf eine eventuell bestehende maligne Umwandlung eines PNST. Das Risiko für eine maligne Entartung nimmt ab einer Größe von ≥5cm und beim Vorliegen einer NF1 zu. Es liegt bei vorhandenem PNST während der Lebenszeit bei 10%.2
Eingeschränkte Möglichkeit Bildgebung
Bildmorphologisch ist noch keine zuverlässige Unterscheidung zwischen benignen und malignen PNST möglich. Die Bildgebung mit funktioneller Kernspintomografie und FDG-Positronenemissionstomografie/Computertomografie (FDG-PET/CT)3 oder Magnetresonanztomografie (MRT) wird aber zunehmend spezifischer und eignet sich mittlerweile sehr gut zur Verlaufskontrolle bei malignitätsgefährdeten Patienten (z.B. bekannte NF1-Erkrankung oder bekannter und noch nicht operierter Befund).
Für die Gruppe der NF1-Erkrankten gibt es gute Hinweise der Evidenzklasse II darauf, dass sowohl die MRT-Funktionsdiagnostik mit DWI(„diffusion weighted imaging“)/ADC(„apparent diffusion coefficient“)-Mapping (MRT-ADCmin ≤1) als auch das FGD-PET/CT (SUVmax >3,2) in der Lage sind, eine stark malignitätsverdächtige Mehranreicherung zu detektieren.4
Vorkommende Tumoren
Abgesehen von Nervenscheidentumoren inklusive der Hybridtumoren gibt es eine Vielzahl weiterer Tumoren, die den Plexus brachialis verdrängen, umwachsen oder infiltrieren können.
Bei den benignen Entitäten handelt es sich um Lipome, Fibrohamartome, Sanduhrmeningeome, Perineuriome, Epidermoidzysten, Hämangiome, Hämangioblastome, Osteochondrome, granuläre Zelltumoren, Ganglioneurome und Desmoide; unter den malignen Entitäten um extraossäre Ewing-Sarkome, Hämangioperizytome, Triton-Tumoren (MPNST plus Rhabdomyosarkom), Lymphome, Liposarkome, Fibrosarkome, Leiomyosarkome, Spindelzellsarkome, Synovialsarkome, Metastasen von Mammakarzinomen, Metastasen maligner Melanome und mehr.5,6,13
Weiters können sich die Myositis ossificans und fokale hypertrophe Neuropathien im Plexus brachialis ausdehnen. Somit sind Raumforderungen im Plexus häufig benigne, werden aber dennoch oft aufgrund ihrer Lokalisation symptomatisch. Ein simples Herausschneiden wird all diesen Läsionen nicht gerecht und erzeugt massive Defizite und Schmerzen.
Differenzialdiagnostisch ist bei schneller Größenzunahme vor allem das Lymphomzu erwägen und auszuschließen. Lymphome des Plexus kommen primär für eine nicht operative Behandlung mit Chemotherapie infrage. In Abhängigkeit von klinischer Symptomatik, erreichter Größe und Status von Ausfällen und Schmerzen kann aber auch bei Lymphomen eine operative Entfernung indiziert sein.
Eine formal benigne, sich jedoch sehr aggressiv verhaltende Entität ist das Desmoid. Bei Auftreten kommt es zu progredienten Funktionsausfällen der oberen Extremitäten und Hände als auch zu stark beeinträchtigenden Schmerzen. Es ist aufgrund seiner Gewebehärte und des den Plexus umschließenden, geradewegs einmauernden Wachstumsverhaltens nur sehr aufwendig und meist subtotal mit funktionserhaltender Absicht zu operieren. Das Desmoid entspricht in seiner Gewebeart der aggressiven Retroperitonealfibrose.
Zufallsbefunde und Metastasen
Neben symptomatischen Plexustumoren treten auch Zufallsbefunde auf. Meist ist dies im Rahmen eines allgemeinen Tumor-Screenings der Fall, so zum Beispiel auch bei der Nachsorge infolge eines Mammakarzinoms.
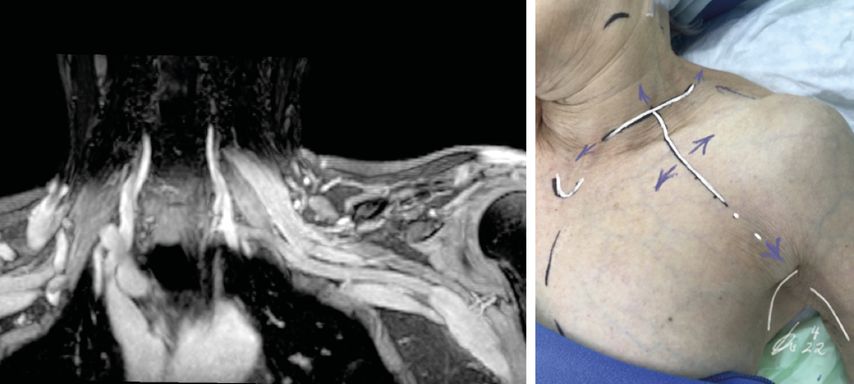
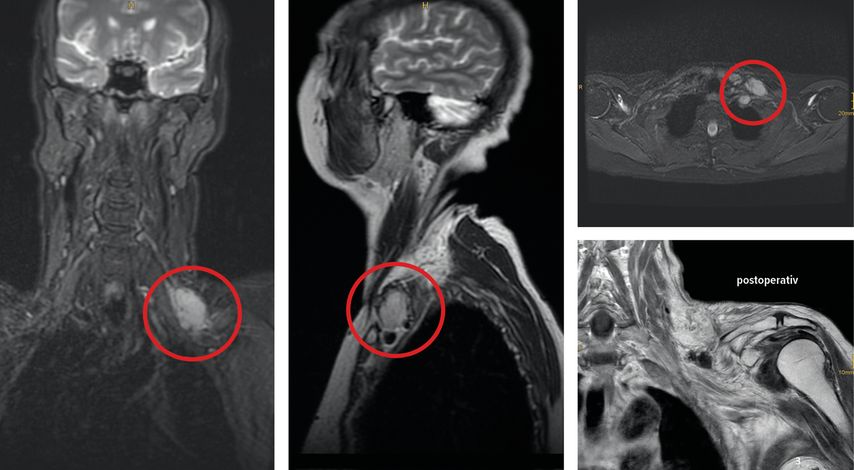
Metastasen können in den Plexus brachialis streuen und diesen mitsamt seiner Gefäßstrukturen infiltrieren. Manchmal sind Metastasen schwer von postradiogenen Signalanreicherungen im MRT oder von Vernarbungen nach Voroperationen zu unterscheiden (Abb. 3 links). Außer bei kleinen, noch nicht in den Nerv infiltrierten Befunden ist meist nur ein palliativer operativer Ansatz möglich. Dennoch kann ein solcher gerechtfertigt und für den Patienten hilfreich sein. Denn eine mikrochirurgische Dekompression unter Gewebeentfernung der auch konstringierenden Tumormasse, verbunden mit einer externen Neurolyse des befallenen Plexusanteils und Exzision infiltrierter, nicht mehr funktionsfähiger Plexusanteile, kann die starken Schmerzen mitunter deutlich lindern (Abb. 3).
Abb. 3: Metastasierung des Plexus brachialis links bei Mammakarzinom mit ausgedehnter Schmerzsymptomatik und progredientem Funktionsausfall. Links im MRT mit ummauernder und infiltrierender Absiedlung infraclaviculär lateral des M. pectoralis minor nach axillar. Rechts der T-förmige, von uns modifizierte Fiolle-Delmas-Birch-Zugang, der je nach gewünschter Exposition in alle Richtungen variiert werden kann (blaue Pfeilspitzen) und zusätzlich mit Zugängen am medialen Oberarm und subaxillär kombinierbar ist (weiße Markierungen in der Achsel oberhalb der Signatur)
Die Zeitlichkeit der Symptome
Schmerzen und Nervenausfälle im Versorgungsgebiet des betroffenen Plexusanteils können bereits vor einer Infiltration aufgrund der „Ummauerung“ entstehen. Es gibt Hinweise darauf, dass unterschiedliche Tumoren über Chemokine entzündliche Reaktionen und perineurale Mikroläsionen in nahem Nervengewebe auslösen und damit auch zur Schmerzerzeugung beitragen.7
Neben der Operation hat es sich bei unseren Patienten als hilfreich erwiesen, in derselben Sitzung unter Sichtkontrolle einen Schmerzkatheter in dem operierten Plexusabschnitt zu platzieren und für mehrere Tage nach der Operation zu belassen. Er wird an eine patientengesteuerte externe Schmerzpumpe angeschlossen und sollte so angelegt sein, dass seine Entfernung problemlos möglich ist.
Operative Ziele
Variable Zielstellung
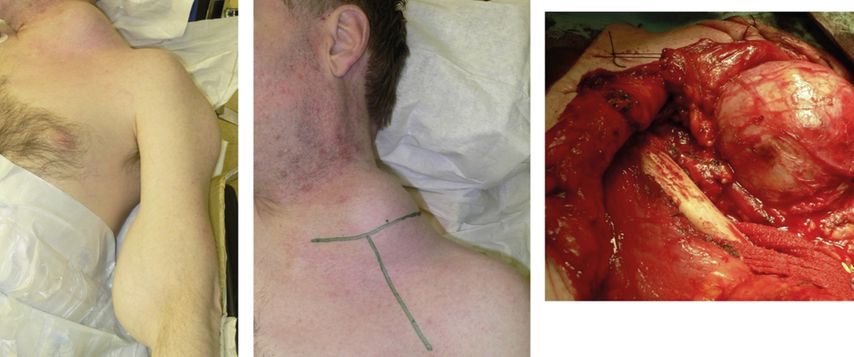
Das beabsichtigte Ziel und die Vorgehensweise bei einer Operation eines Plexustumors können somit in Abhängigkeit von der Entität sehr unterschiedlich sein. Das Ausmaß der möglichen Resektion ist präoperativ mitunter unklar. Um schonend und funktionserhaltend vorgehen zu können, ist es nötig, den Tumor und die involvierten Plexusanteile über weite Strecken zu verfolgen (Abb. 4): Die Tumoren müssen vom noch nicht betroffenen distalen und proximalen Nervenstamm entwickelt werden (Abb. 1). Es gilt, benigne PNST unter bestmöglichem Funktionserhalt komplett zu entfernen.
Abb. 4: Patient mit Schwannomatose (Neurofibromatose Typ III) und großem Plexustumor links am Nacken sowie Tumor am Ellenbogen. T-förmiger Fiolle-Delmas-Birch-Zugang (Mitte) und sehr gute Exposition sowohl nach intraforaminal als auch nach retroclaviculär, ohne Notwendigkeit, die Clavicula zu durchtrennen (rechts)
Moderat radikal planen
Maligne PNST des Plexus brachialis werden unter Erhalt der nicht betroffenen Plexusanteile ablativ, d.h. mit möglichsttumorfreien proximalen und distalen Resektionsrändern, reseziert. Formal kommt es somit maximal zu einer R1-Resektion. Aktuelle Daten aus den Niederlanden von der bisher größten Registerstudie für MPNST legen nahe, dass eine R0-Resektion gegenüber einer R1-Resektion keinen Überlebensvorteil bietet.8 Damit gibt es nunmehr auch Evidenz gegen radikalere, verstümmelnde Therapieansätze (z.B. Schulter/Arm-Ablatio).
Die moderate Radikalität eines Ansatzes mit freien Resektionsrändern der befallenen Plexuselemente versucht so viel Funktion wie möglich zu erhalten. Diskutiert wird zunehmend, ob bei derselben Operation eine Transplantatrekonstruktion mit durchgeführt werden sollte.9 Bei unseren eigenen Patienten entscheiden wir uns in geeigneten Fällen dafür. Für gutartige Prozesse sind verstümmelnde und ablative Ansätze obsolet. Leider werden benigne PNST vereinzelt immer noch wie maligne Tumorentitäten behandelt und mit der Folge entsprechender Komplettausfälle reseziert.1,10
Präoperative Diagnostik
Dass vor einer Operation nicht immer klar ist, um welche Tumorentität es sich handelt, kann problematisch sein. Perkutane Nadelbiopsien sind risikobehaftet, deswegen meist kontraindiziert und bei der präoperativen Diagnostik auch nicht ausreichend hilfreich, da das Probevolumen für eine sichere Aussage zu klein ist. Eine klare Unterscheidung zwischen PNST und MPNST ist nicht möglich. In 42,9% werden durch solche Biopsien neue Defizite und Ausfälle inklusive Schmerzen erzeugt.11
Besteht ein begründeter Verdacht auf Malignität, ist eine offene Biopsie möglichst nicht funktionstragender Anteile unter motorischer Stimulation und Mikroskopsicht indiziert. Erst dann wird in Abhängigkeit vom definitiven Ergebnis, bis zu dessen Erhalt es mehrere Tage dauert,die eigentliche Operation nach Befundbesprechung mit dem Patienten und Darstellung der Optionen durchgeführt. Somit gilt es, bei einem geplanten Plexustumoreingriff Zugänge zu wählen, die einerseits die Eingriffsmorbidität auf ein Minimum reduzieren und andererseits genügend operative Exposition bieten, um sicher, d.h. funktionsschonend, zu präparieren. Insbesondere im Falle von malignen Neoplasien und Desmoiden sollte das Operationsteam auch auf Gefäßnähte und -rekonstruktionen eingestellt sein.
Die Operation: Zugänge, Mikrochirurgie, Neuromonitoring
Minimieren der Eingriffsmorbidität
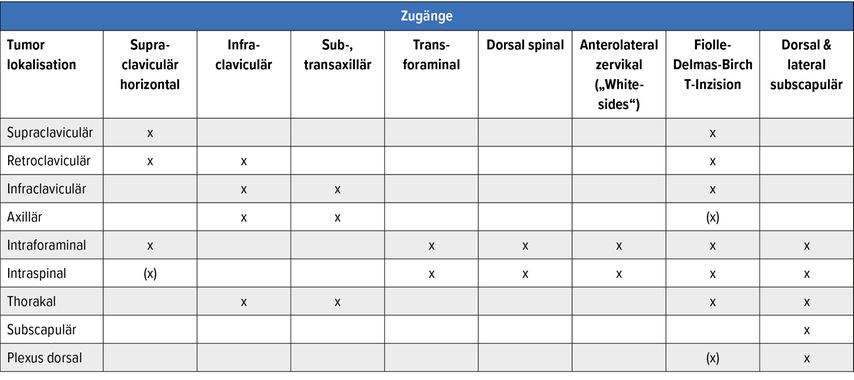
Der passende operative Zugang wird befundspezifisch ausgewählt und hängt von der Lokalisation im Plexus (Tab. 1), der Größenausdehnung und vor allem von der vermuteten Tumorentität ab. Er sollte in Abhängigkeit vom intraoperativen Befund problemlos erweiterbar sein und auch nachfolgende Operationen im Falle von Rezidiven nicht ausschließen.
Wir wählen bevorzugt Zugänge, welche die Eingriffsmorbidität minimieren und gleichzeitig genügend Exposition schaffen, um auch intrafaszikulär, d.h. unter Zuhilfenahme eines Operationsmikroskopes und im Bereich der Gefäße, sicher präparieren zu können. Hierzu sind neben der MRT-geführten Zugangsplanung in drei Ebenen (Abb. 5) die Kombination unterschiedlicher primärer Zugänge, ein OP-Mikroskop und die intraoperative elektrophysiologische Testung („intraoperatives Monitoring“) unabdingbar. Die Kombination all dessen ist über einzelne minimierte Hautschnitte erreichbar.
Abb. 5: Konventionelle kernspintomografische Darstellung eines extraossären Ewing-Sarkoms des Plexus brachialis in drei Ebenen zur Zugangsplanung; Nahebeziehung zur imprimierten Pleurakuppel und den supra- und infraclaviculären Gefäßen, somit Erfordernis, auch gute anteromediale Exposition zu erreichen. Resektion ohne Absetzen des M. sternocleidomastoideus, ohne Claviculadurchtrennung oder Manubriotomie
Die Plexustumoroperation schließt eine gaslose Narkose frei von Relaxanzien mit ein („total intravenöse Anästhesie“[TIVA]). Unter Gasnarkosen ist eine zuverlässige Ableitung von evozierten Potenzialen nicht möglich. Tabelle 1 gibt eine Übersicht über die durch unterschiedliche Zugänge erreichbaren Regionen, die für die Plexustumorchirurgie relevant sind. Erkennbar ist, welche Region mit welchem Zugang erreicht werden kann.
Tab. 1: Übersicht über die Zugänge zu Plexus-brachialis-Tumoren. Die Auswahl des Zugangs hängt vom Ausmaß der Tumorausdehnung in die möglichen unterschiedlichen Lokalisationen ab. Der von uns modifizierte Fiolle-Delmas-Birch-Zugang sticht aufgrund seiner Praktikabilität hervor und wird für komplexe Plexus-brachialis-Tumoren aufgrund seiner Anpassbarkeit, Erweiterbarkeit und der Möglichkeit, unterschiedlichste Lokalisationen freizulegen, bevorzugt. Modifiziert nach T. Kretschmer
Zugang nach Fiolle-Delmas-Birch
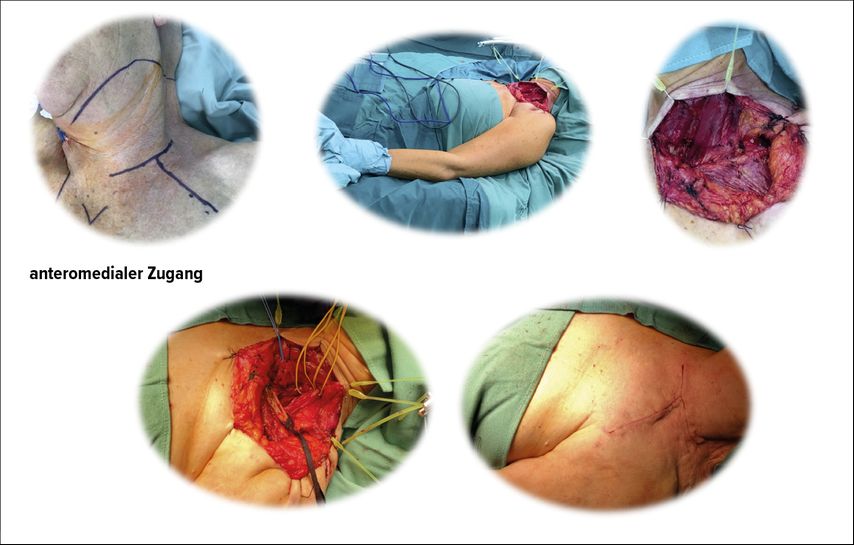
Ein vielseitig einsetzbarer Zugang, der große Exposition mit geringer Eingriffsmorbidität verbindet, ist der nach Fiolle-Delmas-Birch. Birch hat diesen aufgrund seiner profunden historischen Kenntnisse aus der vaskulären Literatur aufgegriffen und ihn für die Plexuschirurgie, insbesondere von Tumoren, eingebracht.12 Wir setzen ihn in von uns deutlich modifizierter Weise ein. Für uns dient er als „Lastenesel“ für die meisten Situationen mit größeren und unklaren Tumoren, bei denen eine komplexere und langstreckige Präparation mit höherem Risiko für eine Gefäßläsion absehbar ist (Abb. 6).
Abb. 6: Operationsschritte bei dem in Abbildung 5 gezeigten Tumor; bei erhaltener Clavicula und Nackenmuskulatur sehr gutes funktionelles und kosmetisches Resultat
In Abhängigkeit von der Platzierung des „T“-Schnittes, die wir variieren, und der Länge seiner Schenkel (Abb. 3 rechts) sind acht unterschiedliche Regionen exponierbar (Tab. 1). Im Gegensatz zur ersten Beschreibung durch Birch12 verzichten wir bei unseren Patienten auch bei stark medial und retroclaviculär gelegenen Befunden auf die Claviculadurchtrennung/Manubriotomie zur verbesserten Übersicht, da wir die Clavicula bei Bedarf in situ durch Halteschlingen anheben können. Der Einsatz von geeigneten (Halb-)Ringretraktor-Systemen reduziert die Eingriffsmorbidität zusätzlich: z.B. durch das Weghalten des mobilisierten M. sternocleidomastoideus mit breiten atraumatischen Hakenretraktoren anstatt seiner Desinsertion.
Auch für tiefer reichende Tumoren ist so für unsere Patienten nur noch sehr selten eine Teilsternotomie nötig (ab Brustwirbelkörper 2 und tiefer, z.B. bei zusätzlichem Wirbelkörperersatz). Für Sternotomien gäbe es etliche Varianten, auf die zurückgegriffen werden kann: von der Operation nach Grunenwald über Sternotomien mit Aufklappen und Rippendurchtrennung auf Höhe des Interkostalraums 3–4 bis zur türflügelartigen Teilmanubriotomie, wie sie bei den ventralen Operationen von Pancoast-Tumoren üblich ist.
Vollständige Entfernung unter Funktionserhalt
Ist von einem benignen Tumor auszugehen, zielt die operative Therapie auf vollständige Entfernung unter Funktionserhalt ab. Hierzu werden mikrochirurgische Techniken unter Nutzung eines Operationsmikroskops und des elektrophysiologischen Monitorings eingesetzt. So ist es möglich, zwischen den funktionstragenden Plexusanteilen und zwischen funktionierenden Faszikeln zu präparieren.
Insbesondere benigne PNST sind interfaszikulär zu präparieren, da bei diesen der Tumor aus einem funktionslosen Faszikel erwächst und dieser von den anderen Faszikeln zu separieren ist (Abb. 2). Dadurch kann die Funktion bei der Tumorexstirpation erhalten werden. Würde man die anderen Faszikel ebenfalls einfach heraus schneiden, wäre der betroffene Plexusanteil funktionslos und von nun an schmerzend.
Literatur:
1 Heinen C et al.: Nerventumoren. In: Kretschmer T et al.: Nervenchirurgie. Springer, 2014: 227-60 2 Ferner RE, Gutmann DH: International consensus statement on malignant peripheral nerve sheath tumors in neurofibromatosis. Cancer research 2002; 62: 1573-7 3 Ferner RE et al.: Evaluation of 18fluorodeoxyglucose positron emission tomography (18FDG PET) in the detection of malignant peripheral nerve sheath tumours arising from within plexiform neurofibromas in neurofibromatosis 1. J Neurol Neurosurg Psychiatry 2000; 68: 353 4 Ahlawat S et al.: Imaging biomarkers for malignant peripheral nerve sheath tumors in neurofibromatosis type 1. Neurology 2019; 93: e1076-84 5 Kim D H et al.: A series of 146 peripheral non-neural sheath nerve tumors: 30-year experience at Louisiana State University Health Sciences Center. J Neurosurg 2005; 102: 256-66 6 Lahr A: Weichteiltumore im Plexus brachialis - eine retrospektive Fallsammlung. Fälle von Prof. Dr. med. H. U. Steinau. Inaugural Dissertation Ruhr-Universität Bochum: 2004 7 Cohnen J et al.: Tumors provoke inflammation and perineural microlesions at adjacent peripheral nerves. Cells 2020; 9: 320 8 Martin E et al.: A nationwide cohort study on treatment and survival in patients with malignant peripheral nerve sheath tumours. Eur J Cancer 2020; 124: 77-87 9 Martin E et al.: Morbidity and function loss after resection of malignant peripheral nerve sheath tumors. Neurosurgery 2021: nyab342. Online ahead of print 10 Kretschmer T et al.: Nerve sheath tumor surgery: case-guided discussion of ambiguous findings, appropriateness of removal, repeated surgery, and nerve repairs. Neurosurg Focus 2007; 22(6): E19 11 Perez-Roman RJ et al.: The risk of peripheral nerve tumor biopsy in suspected benign etiologies. Neurosurgery 2020; 86: E326-32 12 Birch R et al.: Asurgical approach to the cervicothoracic spine. J Bone Joint Surg Br 1990; 72: 904-7 13Quellen auf Basis von Praxiserfahrungen beim Autor, Publikation ausstehend
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...