Onkologische Highlights – das Beste aus 2021
Autor:
Prim. Univ.-Prof. Dr. Andreas Petzer
Vorstand der Abteilungen Interne I für Hämatologie mit Stammzelltransplantation, Hämostaseologie und Medizinische Onkologie Ordensklinikum Linz
E-Mail: andreas.petzer@ordensklinikum.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz der bestehenden Pandemie wurden im Bereich der Onkologie im Jahr 2021 erfreulicherweise zahlreiche klinische Studien erfolgreich abgeschlossen, welche unser therapeutisches Handeln in Zukunft verändern werden. Nachfolgend finden Sie einen Überblick – von Checkpoint-Inhibitoren in verschiedenen Linien und Settings bis zu zielgerichteten Therapien wie Antikörper-Drug-Konjugaten beim Mammakarzinom.
Neue Daten zu Checkpoint-Inhibitoren
Die Dermatoonkologie ist Vorreiter bei den Checkpoint-Inhibitoren
Nach Etablierung der Immuntherapie im palliativen Setting mittels Checkpoint-Inhibitoren hielt der Vormarsch der Immuntherapie an und diese weist mittlerweile nicht nur in der frühen palliativen Linie, sondern auch im adjuvanten und neoadjuvanten Setting zunehmend Erfolge auf.
Nach dem Erfolg des gegen „cytotoxic T-lymphocyte-associated protein 4“ (CTLA-4) gerichteten Checkpoint-Inhibitors Ipilimumab in der Behandlung des metastasierten Melanoms wurden mittlerweile weitere Checkpoint-Inhibitoren beim Melanom und zahlreichen weiteren Tumorentitäten, hauptsächlich gerichtet gegen „programmed cell death protein 1“ (PD-1) sowie „programmed cell death 1 ligand 1“ (PD-L1), erfolgreich etabliert. Das 6,5-Jahres-Follow-up der CheckMate-067-Studie zeigte, dass die Rate an Patienten mit einer Langzeitüberlebensrate von ca. 20% unter Ipilimumab auf >40% unter Nivolumab gesteigert werden kann (zudem bei besserer Verträglichkeit). Bei Kombination von Ipilimumab und Nivolumab kann dieser Anteil auf knapp 50% erhöht werden, allerdings zum Preis einer erhöhten Toxizität.
Ein interessanter neuer Ansatz ist ein Antikörper gegen den Immun-Checkpoint Lymphozytenaktivierungsgen 3 (LAG-3), der auf T-Zellen exprimiert wird und den sich Tumorzellen zunutze machen, indem sie über diesen T-Zellen inaktivieren. Der gegen LAG-3gerichtete Antikörper Relatlimab in Kombination mit Nivolumab zeigte in präklinischen Modellen eine synergistische Antitumoraktivität, die heuer im Rahmen von klinischen Studien bestätigt werden konnte. In der RELATIVITY-067-Studie zeigte sich durch die Kombination von Nivolumab und Relatlimab ein signifikant verlängertes medianes progressionsfreies Überleben von 10,1 Monaten im Vergleich zu 4,6 Monaten bei Gabe von Nivolumab-Monotherapie in der Erstlinienbehandlung bei Patienten mit fortgeschrittenem, zuvor unbehandeltem metastasiertem oder nicht resezierbarem Melanom. Die Checkpoint-Antikörper-Kombination aus Relatlimab und Nivolumab wurde auch im neoadjuvanten Setting im Stadium 3 und im oligometastasierten Stadium 4 des Melanoms getestet. Dabei zeigte sich eine hohe Rate an kompletten (pCR; 59%) sowie beinahe kompletten pathologischen Remissionen (pCR und near pCR: 66%).
Checkpoint-Inhibitoren in der ersten palliativen Linie bei Tumoren des GI-Trakts
In der KEYNOTE-177-Studie wurde Pembrolizumab versus Chemotherapie bei Patienten mit Kolorektalkarzinom mit hoher Mikrosatelliteninstabilität (MSI-H) bzw. sogenannten Mismatch-repair-defizienten (dMMR) Patienten getestet. Bereits letztes Jahr konnte gezeigt werden, dass das progressionsfreie Überleben im Median hochsignifikant von 8,2 auf 16,5 Monate verdoppelt werden kann. Beim Meeting der American Society of Clinical Oncology (ASCO) 2021 wurden die finalen Gesamtüberlebensdaten vorgestellt. Es zeigte sich dabei ein verbessertes Gesamtüberleben (OS) zugunsten von Pembrolizumab (medianes OS noch nicht erreicht)versus 36,7 Monate unter Chemotherapie. Diese Daten sind statistisch nicht signifikant, jedoch klinisch hochrelevant, insbesondere unter dem Aspekt, dass 60% der Intent-to-treat-Population (ITT) im Anschluss an das Therapieversagen unter Chemotherapie ebenfalls Pembrolizumab erhalten haben. Die Therapie wurde deshalb mittlerweile auch von der Europäischen Arzneimittelbehörde (EMA) für diese Indikation zugelassen.
Bei Patienten mit Plattenepithelkarzinom des Ösophagus, deren Tumorzellen in ≥1% PD-L1-positiv sind, konnte in der CheckMate-648-Studie gezeigt werden, dass eine Kombination aus Nivolumab und Chemotherapie mit Cisplatin-5-Fluorouracil (FU) zu einem hochsignifikant verlängerten medianen Überleben von 9,1 Monaten versus 15,4 Monate führt. Diese Studie beinhaltete zudem einen Chemotherapie-freien Arm aus Nivolumab plus Ipilimumab im Vergleich zur Chemotherapie alleine. Auch hier zeigte sich bei den Patienten mit ≥1% PD-L1-positiven Tumorzellen eine signifikante Verbesserung des medianen OS von 9,1 auf 13,7 Monate. Es muss allerdings erwähnt werden, dass in den ersten sechs Monaten die Chemotherapie-freie Therapie unter Umständen einer Chemotherapie auch unterlegen sein kann. Beide Konstellationen sind derzeit bei der EMA unter Validierung.
In der CheckMate-649-Studie zeigt die Kombination aus Nivolumab plus Chemotherapie mit FOLFOX oder CapOx beim fortgeschrittenen Adenokarzinom des Magens, des gastroösophagealen Übergangs oder des distalen Ösophagus ebenfalls einen signifikanten medianen Überlebensvorteil von 13,8 Monaten versus 11,6 Monate im Vergleich zur alleinigen Chemotherapie. Bei Patienten mit einem PD-L1-„combined positive score“ (CPS) von ≥5 war der Überlebensvorteil mit 14,4 Monaten noch ausgeprägter undfür diese Patientengruppegilt die Kombinations-Therapie mittlerweile als Standard.
Checkpoint-Inhibitoren im adjuvanten Setting
Als Beispiel für die erfolgreiche Testung von Checkpoint-Inhibitoren im adjuvanten Setting sei der muskelinvasive Blasenkrebs in der CheckMate-274-Studie genannt. Patienten mit hohem Rückfallrisiko wie im pathologischen Stadium pT3, pT4a oder pN+ wurden mit Nivolumab oder Placebo behandelt. Eine Cisplatin-basierte neoadjuvante Therapie vor der Operation war erlaubt und wurde in ca. 50% der Fälle durchgeführt. Der primäre Endpunkt des krankheitsfreien Überlebens war für sogenannte „all-comers“ signifikant verbessert, aber noch deutlicher ausgeprägt war dieser Effekt bei Patienten mit einer PD-L1-Expression auf den Tumorzellen von ≥1%. Nachdem es sich hier um eine adjuvante Studie handelt, muss man in der Gesamtbeurteilung noch etwas zurückhaltend in der Interpretation sein, weil die OS-Daten noch fehlen, es zudem zwei behandlungsbezogene Todesfälle (Pneumonitis) gegeben hat und weil eine ähnliche Studie mit Atezolizumab (IMvigor010-Studie) in diesem Setting negativ verlaufen ist.
Ein weiteres erfolgreiches Beispiel für eine Checkpoint-Therapie im adjuvanten Setting stellt die IMpower010-Studie beim nichtkleinzelligen Bronchuskarzinom im Stadium IB–IIIA dar. Patienten wurden nach Lobektomie oder Pneumonektomie mit ein bis vier Zyklen einer Cisplatin-Doublette behandelt und im Anschluss daran entweder mit Atezolizumab oder Best Supportive Care (BSC). Der primäre Endpunkt eines krankheitsfreien Überlebens (DFS) war für Patienten im Stadium II–IIIA sowohl für „all-comers“ als auch für Patienten mit ≥1% PD-L1-positiven Tumorzellen signifikant verbessert (medianes DFS für Patienten mit ≥1%PD-L1-positiven Tumorzellen: noch nicht erreicht vs. 35,3%). Die Subgruppenanalyse zeigt, dass die Positivität in der „All-comers“-Population letzten Endes von der Population der Patienten mit ≥1% PD-L1 auf Tumorzellen getragen wird. Auch hier handelt es sich um eine Studie mit potenziell praxisverändernder Bedeutung.
Checkpoint-Inhibitoren im neoadjuvanten Setting
Als weiteres Beispiel für den Erfolg von Checkpoint-Inhibitoren im neoadjuvanten Setting sei neben der oben bereits erwähnten Studie beim Melanom mit Relatlimab und Nivolumab die CheckMate-816-Studie genannt. Hier wurden Patienten mit nichtkleinzelligem Lungenkarzinom im Stadium IB–IIIA mit Nivolumab plus Chemotherapie versus Chemotherapie alleine behandelt. Dabei zeigte sich eine signifikante Verbesserung im Erreichen einer pCR von 2% mit Chemotherapie auf 24% mit Chemotherapie und Nivolumab. Auch sogenannte Wasserfalldiagramme zeigen ein dramatisch höheres und besseres Ansprechen von Patienten unter der Kombination aus Nivolumab und Chemotherapie.
Neues zu zielgerichteten Therapien
Zielgerichtete Substanzen in der Adjuvanz
Auch zielgerichtete Substanzen wandern in die Adjuvanz. Beispielhaft sei die OlympiA-Studie bei HER2(„human epidermal growth factor receptor 2“)-negativen Patientinnen mit frühem Brustkrebs und einer in der Keimbahn nachgewiesenen BRCA(„breast cancer“)1/2-Mutation sowie mit hohem Risiko für einen Rückfall nach adjuvanter oder neoadjuvanter Chemotherapie genannt. Diese Patientinnen erhielten den Poly(ADP-Ribose)-Polymerase(PARP)-Inhibitor Olaparib adjuvant über ein Jahr versus Placebo.
Im primären Endpunkt des invasiven krankheitsfreien Überlebens zeigt sich nach drei Jahren ein signifikanter Unterschied von 8,8%, im fernmetastasierungsfreien Überleben ein signifikanter Unterschied von 7,1%. Das OS zeigt einen statistisch noch nicht signifikanten Unterschied von 3,7%. Diese Daten sind beeindruckend und werden unsere Praxis verändern. Zu beachten ist auch, dass diese Praxisänderung enorme Auswirkung auf die multigenomische Testung haben wird.
Die endokrine Therapie ist die älteste Form einer zielgerichteten Therapie
In den letzten Jahren konnte gezeigt werden, dass für Patientinnen mit Hormonrezeptor(HR)-positivem Brustkrebs mit höherem Rezidivrisiko eine verlängerte endokrine Therapie >5 Jahre bessere Ergebnisse hinsichtlich des krankheitsfreien Überlebens ermöglicht. Bislang war jedoch speziell bei Verwendung von Aromataseinhibitoren unklar, ob eine Verlängerung auf sieben oder zehn Jahre bessere Daten liefert.
Hier zeigte die Arbeit der Austrian Breast and Colorectal Cancer Study Group (ABCSG), dass bei postmenopausalen Frauen, die zuvor fünf Jahre eine adjuvante endokrine Therapie erhalten haben, das krankheitsfreie Überleben als auch das OS nach sieben bzw. zehn Jahren ident sind, dass aber bei einer Verlängerung über sieben Jahre hinaus Nebenwirkungen, vor allem das Frakturrisiko, zunehmen. Der „sweet spot“ scheint somit sieben Jahre zu betragen.
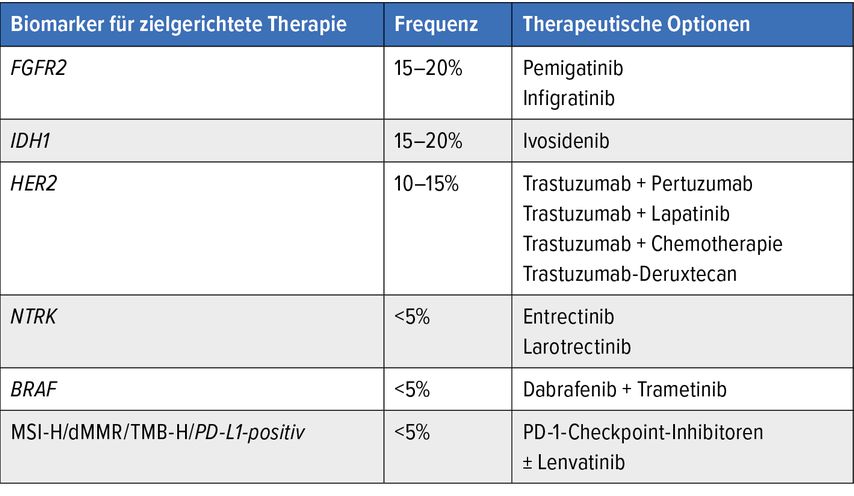
Die Behandlung des cholangiozellulären Karzinoms als Beispiel zahlreicher zielgerichteter Therapieoptionen
Ein schönes Beispiel für die Möglichkeit zielgerichteter Therapien stellt die Behandlung des cholangiozellulären Karzinoms dar. Hier ist erwähnenswert, dass im Jahr 2021 eine Phase-III-Studie publiziert wurde, die zeigen konnte, dass in der Zweitlinie die Gabe einer FOLFOX-Chemotherapie einen signifikanten Überlebensbenefit versus einer alleinigen aktiven Symptomkontrolle erzielt, wenngleich das mediane Überleben von 6,2 Monaten (Chemotherapie) versus 5,3 Monate (aktive Symptomkontrolle) nicht sehr beeindruckend verlängert wurde.
Mittlerweile konnten jedoch zahlreiche Daten belegen, dass beim cholangiozellulären Karzinom zahlreiche Mutationen auftreten, für die zielgerichtete Therapien zur Verfügung stehen (Tab. 1). Deshalb wird unter anderem von der European Society for Medical Oncology (ESMO) empfohlen, spätestens nach Versagen der Erstlinientherapie beim fortgeschrittenen cholangiozellulären Karzinom eine multigenomische Testung durchzuführen.
Tab. 1: Potenzielle Therapieoptionen in der Zweitlinientherapie beim cholangiozellulären Karzinom nach multigenomischer Testung. IDH1: Isozitratdehydrogenase 1; NTRK: neurotrophe Tyrosin-Rezeptor-Kinase; TMB-H: „tumor mutational burden-high“. Modifiziert nach Personeni M: Cancers 2020
Beispielhaft seien Tumoren mit FGFR2(„fibroblast growth factor receptor 2“)-Fusionen oder Rearrangements genannt. Hier konnte die Phase-II-Studie FIGHT-202bereits letztes Jahr zeigen, dass die Gabe von Pemigatinib zu einem medianen OS von 21 Monaten führt und aktuell im Jahr 2021 die Gabe von Infigratinib zu einem medianen Überleben von 12,2 Monaten. Es ist zu erwähnen, dass es sich hier um Phase-II-Daten handelt und dass der Anteil an Patienten in der Zweitlinientherapie bei Infigratinib niedriger war als in der FIGHT-202-Studie mit Pemigatinib.
Erfolg neuer Antikörper-Drug-Konjugate
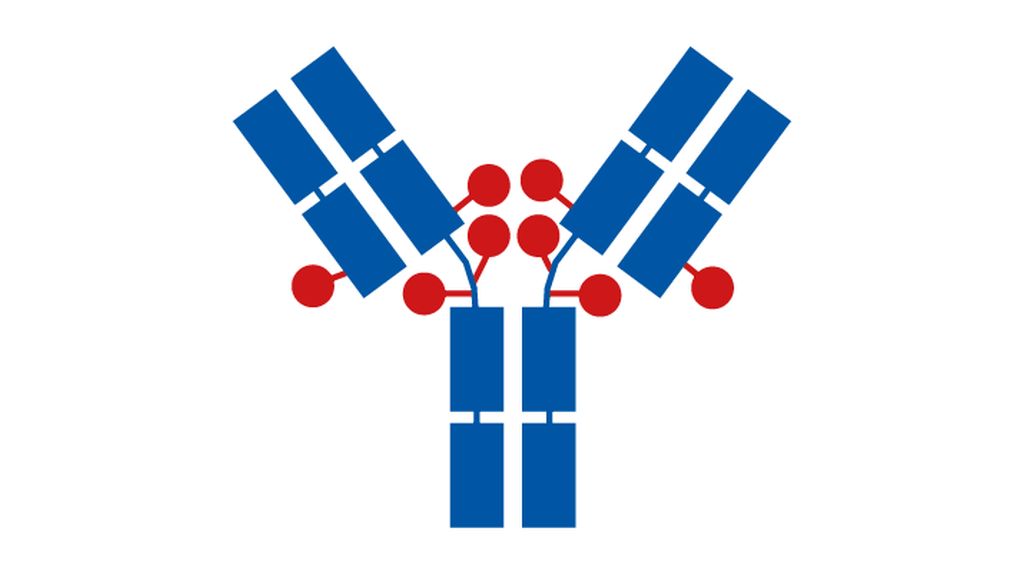
Ein weiteres bedeutendes Segment in der zielgerichteten Therapie stellen die neuen Generationen von sogenannten Antikörper-Drug-Konjugaten dar. Hier ist vor allem die Phase-III-StudieDESTINY Breast03 zu erwähnen, die HER2-positive Patientinnen mit nicht resektablem oder metastasiertem Brustkrebs nach Behandlung mit einem Taxan und Trastuzumab ab der zweiten Linie mit dem derzeitigen Standard mit Trastuzumab-Emtansin (TDM1; ebenfalls ein Antikörper-Drug-Konjugat) mit Trastuzumab-Deruxtecan (T-DXd) verglich. Dabei zeigte sich der primäre Endpunkt des progressionsfreien Überlebens hochsignifikant verbessert zugunsten von T-DXd mit einer Rate des zwölfmonatigen progressionsfreien Überlebens von 75,8% (T-DXd) vs. 34,1 (TDM1). Erfreulicherweise wirkt diese Substanz in allen Subgruppen (jeglicher Hormonrezeptorstatus, viszerale Erkrankung, Zahl der früheren Linien, Hirnmetastasen). Zudem zeigte sich in dieser Phase-III-Studie, dass die gefürchtete Nebenwirkung einer Pneumonitis bzw. einer interstitiellen Lungenerkrankung, die in einigen Fällen in der Phase-II-Studie auch zum Tod führte, in deutlich geringerem Maße aufgetreten ist und erfreulicherweise keine Grad-4- und Grad-5-Toxizitäten diesbezüglich zu beobachten waren. Dies wurde auf zwei Faktoren zurückgeführt, nämlich auf das bereits bestehende Bewusstsein für diese Nebenwirkung als auch auf die Verwendung der Substanz in früheren Linien im Vergleich zur Phase-II-Studie. Der Unterschied zwischen T-DXd und TDM1 besteht einerseits in der sogenannten Payload des Antikörpers (Topoisomerase-1-Inhibitor bei T-DXd versus einen Mikrotubulushemmer bei TDM1), einer zweifach höheren Payload von T-DXd, ca. 8:1 vs. 3,5:1, sowie einem bei T-DXd abspaltbaren Linker, wodurch der Topoisomerase-Inhibitor aus der Zelle hinausdiffundieren kann und einen sogenannten Bystander-Effekt in benachbarten Tumorzellen auslösen kann (Abb. 1). Diese beeindruckenden Daten werden wohl zu einer Änderung des Zweitlinienstandards beim metastasierten HER2-positiven Mammakarzinom führen.
Abb. 1: Unterschiede zwischen T-DM1 und T-DXd. Modifiziert nach Cortes J et al.: Präsentation LBA1; ESMO-Meeting 2021
Ein weiteres wichtiges Antikörper-Drug-Konjugat stellt Sacituzumab-Govitecan dar. Hier handelt es sich um einen monoklonalen Antikörper, der gegen das Trop-2-Antigen gerichtet wird, welches auf vielen Tumorzellen exprimiert wird. An diesen Antikörper ist über einen Linker ein Topoisomerasehemmer (SN-38) als Payload gebunden. Der Antikörper wurde in der Phase-III-StudieASCEND beim refraktären und relapsierten metastasierten tripelnegativen Brustkrebs bei Patientinnen getestet, die zumindest zwei vorangegangene Chemotherapien für die metastasierte Erkrankung erhalten hatten. Auch hier zeigte sich, dass nicht nur das progressionsfreie Überleben, sondern auch das OS signifikant von 6,7 Monaten (Chemotherapie nach Arztwahl) auf 12,1 Monate (Sacituzumab-Govitecan) verlängert werden konnte. Auch diese Substanz wird unser Armentarium in der Behandlung verschiedenster Tumoren bereichern.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...