Neues zu Klassifikation, Früherkennung und Therapie
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Sowohl virtuell als auch „on-site“ fand vom 9. bis 12. September 2023 die World Conference on Lung Cancer (WCLC) der International Association for the Study of Lung Cancer (IASLC) statt. Neben Studiendaten aus dem therapeutischen Setting besitzen unter anderem die Neuerungen in Bezug auf die kommende Aktualisierung der TNM-Klassifikation sowie Erkenntnisse zur Patient:innenselektion für das Screening klinische Relevanz.
Empfehlungen der 9. TNM-Klassifikation
Als Grundlage für die Einstufung von Lungenkarzinomen befindet sich seit 2017 die 8. Ausgabe der TNM-Klassifikation in Verwendung. Im Jänner 2024 wird die 9. Ausgabe in Kraft treten. Asamura H et al. präsentierten auf der WCLC 2023 die neuen Empfehlungen, die vom Staging and Prognostic Factors Committee der IASLC und der Non-Profit-Organisation Cancer Research and Biostatistics (CRAB®) auf der Basis der Daten von 87339 Patient:innen erarbeitet wurden.1
Im Bereich der T-Deskriptoren sehen die Vorschläge für die 9. Ausgabe keine Änderungen vor. Innerhalb der N-Kategorie ist eine Unterteilung des Stadiums N2 erfolgt. N2a bezeichnet künftig den Befall einer einzelnen N2-Lymphknotenstation und N2b die Beteiligung mehrerer Stationen. Auch auf dem Gebiet der M-Deskriptoren hat eine Subklassifikation stattgefunden. Während M1a und M1b unverändert bleiben, besteht M1c in Hinkunft aus den beiden Kategorien M1c1 (multiple extrathorakale Metastasen in einem Organsystem) und M1c2 (multiple extrathorakale Metastasen in mehreren Organsystemen).
Durch diese Modifikationen ergibt sich natürlich eine neue Gruppierung der Tumorstadien (IA1–IVB), wobei die Kaplan-Meier-Darstellung des Gesamtüberlebens (OS) je nach klinischen und pathologischen Stadien keine signifikanten Überlappungen der Kurvenverläufe zeigt.
Bedeutung der Familienanamnese für das Lungenkrebsrisiko
Eine Arbeit aus Taiwan weist auf die Bedeutung der Familienanamnese im Zusammenhang mit dem individuellen Lungenkrebsrisiko hin.2 Im Juli 2022 wurde in dem ostasiatischen Land ein Programm zur Früherkennung von Lungenkarzinomen mittels Niedrigdosis-CT (LDCT) implementiert. Für die Teilnahme kommen Personen infrage, die entweder starke Raucher:innen sind oder eine positive Familienanamnese im Hinblick auf Lungenkarzinome aufweisen.
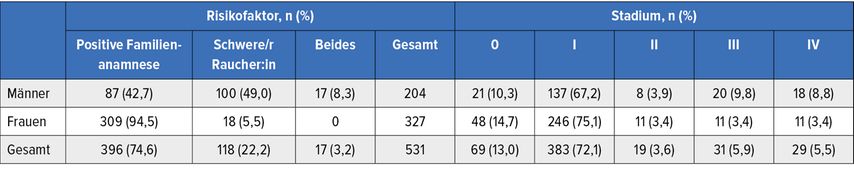
Innerhalb des ersten Jahres wurden fast 50000 Personen gescreent und 531 Lungenkarzinome identifiziert; dies entspricht einer Detektionsrate von 1,1%. In 85,1% der Fälle lag ein Stadium 0 oder 1 vor (Tab. 1). Die Familienanamnese erwies sich hier als dominanter Risikofaktor, den fast 75% der Patient:innen aufwiesen. Bei 22,2% handelte es sich um schwere Raucher:innen, während 3,2% beide Kriterien erfüllten. Dies schlug sich auch im positiven prädiktiven Wert nieder, der bei Lungenkrebspatient:innen mit einer einschlägigen Familienanamnese weitaus höher war (15,3) als bei schweren Raucher:innen (7,1) und Personen mit beiden Risikofaktoren (9,8).
Tab. 1: Risikofaktoren und Erkrankungsstadien bei Patient:innen im taiwanesischen Früherkennungsprogramm. Modifiziert nach Huang KP et al.2
Die Autor:innen ziehen den Schluss, dass eine aktive Einladung erstgradiger Verwandter von Lungenkrebspatient:innen zum Screening gerechtfertigt erscheint.
I-SABR: adjuvantes Nivolumab zusätzlich zur Bestrahlung
In der Therapie des operablen nichtkleinzelligen Lungenkarzinoms (NSCLC) im Stadium I (Tumordurchmesser ≤3cm, N0, M0) konnte eine einarmige prospektive Studie die Nichtunterlegenheit der stereotaktischen ablativen Radiotherapie (SABR) gegenüber dem operativen Vorgehen in Bezug auf das Langzeitüberleben demonstrieren.3
Allerdings waren die Rezidivraten nach fünf Jahren vergleichsweise höher, weshalb eine offene, randomisierte Phase-II-Studie den Effekt der Zugabe von vier Dosen Nivolumab zu SABR (I-SABR) im Vergleich zu SABR alleine bei Patient:innen im Stadium IA–IIB ohne Lymphknoten- und Fernmetastasen prüfte. Multiple Primärtumoren waren erlaubt, ebenso isolierte rezidivierte oder persistierende Lungenherde ohne Lymphknotenbefall. Chang JY et al. stellten auf der WCLC 2023 die Ergebnisse für 66 Patient:innen im Prüfarm und 75 im Kontrollarm vor.4
Tatsächlich konnte die Wirksamkeit der SABR durch die Kombination mit adjuvantem Nivolumab gesteigert werden. In Bezug auf das ereignisfreie Überleben nach vier Jahren resultierte eine signifikante Verbesserung mit 48-Monats-Raten von 77% vs. 53% (HR: 0,38; p=0,0056). Die Rate an Rezidiven und/oder Tod fiel im I-SABR-Arm deutlich niedriger aus als im Kontrollarm (12,1% vs. 36,0%). Ebenso nahm die Häufigkeit von Zweittumoren im Bereich der Lunge ab (3,0% vs. 8,0%), was auf einen präventiven Effekt der Immuntherapie-Kombination hindeuten könnte.
Das I-SABR-Regime erwies sich als tolerabel. Insgesamt entwickelten drei Patient:innen in den beiden Armen Pneumonitiden der Grade 2; Erkrankungen der Schweregrade 3–5 wurden nicht verzeichnet. In der gesamten Studie manifestierten sich keine Nebenwirkungen der Grade 4 und 5. Nach Einschätzung der Autor:innen kommt I-SABR als Therapieoption für Patient:innen mit NSCLC im Frühstadium oder auf das Lungenparenchym begrenzten Rezidiven ohne Lymphknotenbeteiligung infrage, wenngleich der Benefit erst in einer Phase-III-Studie bestätigt werden muss.
FLAURA2: Osimertinib plus Chemotherapie
Beim fortgeschrittenen EGFR-mutierten NSCLC stellen EGFR-Tyrosinkinaseinhibitoren wie Osimertinib bekanntermaßen den Erstlinien-Therapiestandard dar. Die im Laufen befindliche globale, offene, randomisierte FLAURA2-Studie prüft die Kombination aus Osimertinib 80mg/Tag und vier Zyklen einer Chemotherapie mit Pemetrexed und Carboplatin oder Cisplatin (n=279) im Vergleich zur etablierten Osimertinib-Monotherapie bis zur Progression als Erstlinienstrategie (n=278). Nach der Verabreichung der Doublette gelangt im Prüfarm eine Erhaltungstherapie mit Osimertinib plus Pemetrexed zum Einsatz. Als primärer Endpunkt gilt das progressionsfreie Überleben (PFS) laut Untersuchenden.
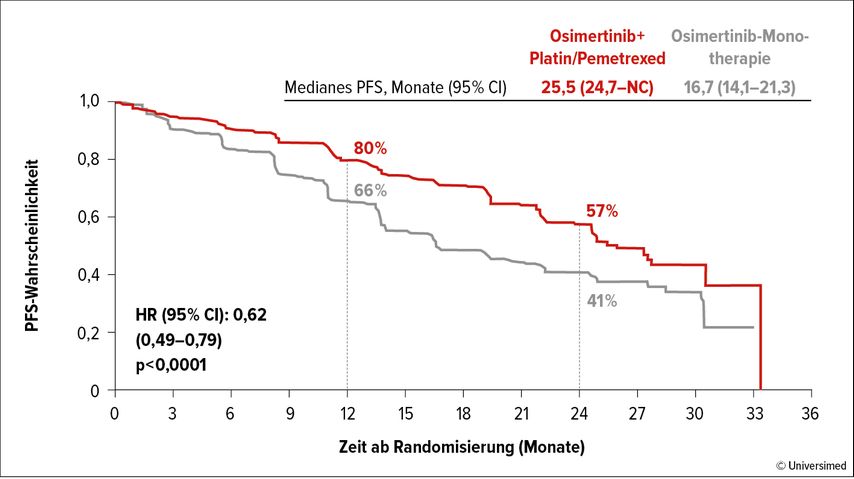
Gemäß der Primäranalyse, die auf der WCLC 2023 von Jänne PA et al. präsentiert wurde, konnte das PFS durch die Kombination von Osimertinib mit der Chemotherapie um 8,8 Monate verlängert werden (25,5 vs. 16,7 Monate; HR: 0,62; p<0,0001; Abb. 1).5 Die Analyse laut unabhängigem zentralem Review bestätigte dieses Ergebnis; hier erreichte der PFS-Unterschied 9,5 Monate (29,4 vs. 19,9 Monate; HR: 0,62; p=0,0002). Patient:innen aller Subgruppen profitierten im Hinblick auf das PFS von der Kombination. Die objektiven Ansprechraten lagen bei 83% vs. 76% und die mediane Dauer des Ansprechens war im Prüfarm verlängert (24,0 vs. 15,3 Monate).
Abb. 1: Verlängerung des progressionsfreien Überlebens durch die Zugabe von Chemotherapie zu Osimertinib. Modifiziert nach Jänne PA et al.5
Entsprechend den Toxizitätsprofilen der verwendeten Schemata traten im Kombinationsarm Zytopenien, Diarrhö sowie Übelkeit und im Monotherapiearm Diarrhö als häufigste Nebenwirkungen auf. Angesichts der statistisch signifikanten und klinisch relevanten PFS-Verlängerung stellt Osimertinib plus Platin/Pemetrexed beim fortgeschrittenen EGFR-mutierten NSCLC eine neue Erstlinienoption dar.
T-DXd beim HER2-mutierten Lungenkarzinom
Das Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan (T-DXd) wird im Rahmen der internationalen, nicht komparativen Phase-II-Studie DESTINY-Lung02 beim metastasierten HER2-mutierten Lungenkarzinom in den beiden Dosierungen 5,4mg/kg dreiwöchentlich (n=102) und 6,4mg/kg dreiwöchentlich (n=50) evaluiert. Die Patient:innen haben vor Studieneinschluss bereits ≥1 Therapielinie einschließlich einer platinbasierten Chemotherapie erhalten; in beiden Armen wurden im Median zwei Linien verabreicht. ZNS-Metastasen bestanden bei 34,3% (5,4mg/kg) bzw. 44,0% (6,4mg/kg).
Im Hinblick auf die als primärer Endpunkt definierte bestätigte Gesamtansprechrate (cORR) laut unabhängigem verblindetem Review erbrachte die primäre Analyse der DESTINY-Lung02-Studie für beide Dosierungen überzeugende Ergebnisse.6 Unter 5,4mg/kg betrug die cORR 49,0% und unter 6,4mg/kg 56,0%. Eine Krankheitskontrolle wurde bei 93,1% bzw. 92,0% erzielt. Die Patient:innen sprachen unabhängig von der Art der HER2-Mutation, dem HER2-Amplifikationsstatus sowie der Art und Anzahl der Vortherapien auf die Behandlung an.
Das mediane PFS belief sich auf 9,9 bzw. 15,4 Monate; das mediane OS betrug unter 5,4mg/kg 19,5 Monate und war in der 6,4mg/kg-Gruppe noch nicht erreicht worden. Nach zwölf Monaten lebten 73% bzw. 67% der Patient:innen und 53% bzw. 45% waren progressionsfrei.
Wie die Sicherheitsanalyse vor Augen führte, schnitt das mit 5,4mg/kg behandelte Kollektiv besser ab. Dies betraf therapiebedingte Nebenwirkungen der Grade ≥3 (38,6% bzw. 58,0%), schwerwiegende Nebenwirkungen (13,9% bzw. 24,0%) sowie Therapieabbrüche, Dosisreduktionen und Therapiepausen aufgrund von Toxizitäten. Interstitielle Lungenerkrankungen traten in der 5,4mg/kg-Dosisgruppe vergleichsweise seltener auf (12,9% vs. 28,0%).
In ihrer Gesamtheit sprechen die Resultate für den Einsatz von T-DXd 5,4mg/kg beim vortherapierten HER2-mutierten NSCLC.
5-Jahres-Überlebensdaten imSetting des ES-SCLC
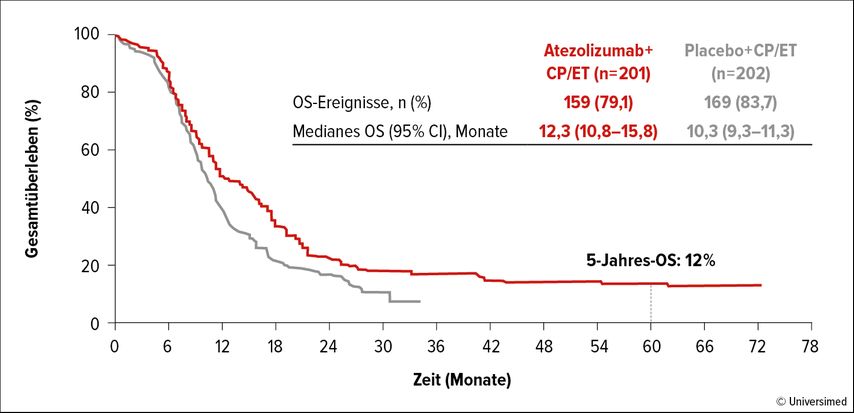
Die doppelblinde, placebokontrollierte Phase-III-Studie IMpower133 hat die Kombination aus Atezolizumab und Carboplatin/Etoposid als Erstlinien-Therapiestandard beim kleinzelligen Lungenkarzinom im ausgedehnten Stadium (ES-SCLC) etabliert.7 Patient:innen aus dem Prüfarm von IMpower133, die am Studienende nach wie vor unter Atezolizumab-Therapie standen oder sich im OS-Follow-up befanden, konnten in die offene, nicht randomisierte Phase-IV-Studie IMbrella A wechseln (n=18). Liu SV et al. präsentierten auf der WCLC 2023 eine gemeinsame Auswertung der Langzeitdaten aus IMpower133 und IMbrella A.8 Es handelt sich um die erste Analyse des 5-Jahres-Überlebens unter einer Erstlinienkombination aus Immun- und Chemotherapie beim ES-SCLC.
Nach fünf Jahren lebten 12% der mit Atezolizumab behandelten Patient:innen, wobei die Kaplan-Meier-Kurve ein Plateau zeigte (Abb. 2). Dieses Ergebnis entspricht einer relevanten Verbesserung gegenüber den mit Chemotherapie erreichten historischen 5-Jahres-OS-Resultaten, die sich im Bereich von ca. 2% bewegen.9–11 Die finale Analyse zur Sicherheit und Verträglichkeit entsprach den initialen Beobachtungen. Im Bereich der immunassoziierten Toxizitäten wurde eine Grad-2-Hypothyreose als einziges verzögertes Ereignis verzeichnet. Insgesamt unterstreichen die Daten das Potenzial der Kombination aus Atezolizumab und Chemotherapie im Hinblick auf ein mögliches Langzeitüberleben.
Frühes Mesotheliom: keine Vorteile der Pleurektomie
Beim resektablen Pleuramesotheliom wird die maximale Zytoreduktion empfohlen, wobei sich die lungenerhaltende Pleurektomie/Dekortikation weltweit als Standard durchgesetzt hat. Als erste randomisierte, kontrollierte Studie verglich MARS 2 diese Intervention mit der alleinigen Chemotherapie. Nach zwei Zyklen Platin plus Pemetrexed wurden die Patient:innen entweder der Pleurektomie gefolgt von vier weiteren Chemotherapiezyklen (n=169) oder vier Zyklen Platin plus Pemetrexed ohne Intervention (n=166) zugeordnet.
Wie sich zeigte, bewirkte die ausgedehnte Pleurektomie/Dekortikation keinerlei Vorteile gegenüber dem konservativen Vorgehen.12 Im Hinblick auf das OS (primärer Endpunkt) fand sich sogar eine 28%ige Mortalitätssteigerung. Das Risiko für Komplikationen der Grade ≥3 war um den Faktor 3,6 erhöht (p<0,001), wobei vor allem kardiale Ereignisse, Infektionen und neuerliche chirurgische Eingriffe ins Gewicht fielen. Auch nach einer Anpassung um Faktoren wie die Anzahl der Chemotherapiezyklen blieb der Unterschied bestehen.
Darüber hinaus sprachen Lebensqualitätsanalysen laut EORTC QLC-C30 und EQ-5D für das nicht chirurgische Vorgehen, und eine Kosteneffektivitätsanalyse erbrachte Mehrkosten von über 20000 US-Dollar. Wie die Autor:innen festhalten, würde der Abschied vom Konzept der Resektabilität beim Pleuramesotheliom den Weg für effektive systemische Therapien ebnen, die derzeit nur bei nicht resektabler Erkrankung zugelassen sind.
Quelle:
IASLC World Conference on Lung Cancer 2023, 9.–12. September 2023, Singapur + virtuell
Literatur:
1 Asamura H & Nishimura K: WCLC 2023; Abstr. #PL04.03 2 Huang KP et al.: WCLC 2023; Abstr. #PL03.04 3 Chang JY et al.: Lancet Oncol 2021; 22(10): 1448-57 4 Chang JY et al.: WCLC 2023, Abstr. #OA12.04 5 Jänne PA et al.: WCLC 2023; Abstr. #PL03.13 6 Jänne PA et al.: WCLC 2023; Abstr. #MA13.10 7 Horn L et al.: N Engl J Med 2018; 379(23): 2220-9 8 Liu SV et al.: WCLC 2023; Abstr. #OA01.04 9 Zhang S, Cheng Y: Front Oncol 2023; 13: 1142081 10 Arriola E et al.: JTO Clin Res Rep 2022; 3(1): 100266 11 Schabath MB et al.: Lung Cancer 2014; 86(1): 14-21 12 Lim E et al.: WCLC 2023; Abstr. #PL03.10
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...