Myelodysplastische Neoplasien: personalisierte therapeutische Strategien
Autorin:
Dr. med. Stefani Parmentier
Leitende Ärztin Hämatologie
St. Claraspital Basel
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Fortschritte im molekularen Verständnis der myelodysplastischen Neoplasien (MDS) haben die Entwicklung personalisierter Therapieansätze ermöglicht, die die Prognose der Patient:innen verbessern und die Lebensqualität erhöhen. Dieser Übersichtsartikel beleuchtet die neuesten therapeutischen Entwicklungen und Strategien für sowohl Niedrigrisiko- als auch Hochrisiko-MDS-Patient:innen und betont die Bedeutung individualisierter Behandlungspläne in der modernen Hämatologie.
Keypoints
-
Personalisierte Therapieansätze bei MDS haben einen signifikanten Einfluss auf das Überleben und die Lebensqualität der Patient:innen.
-
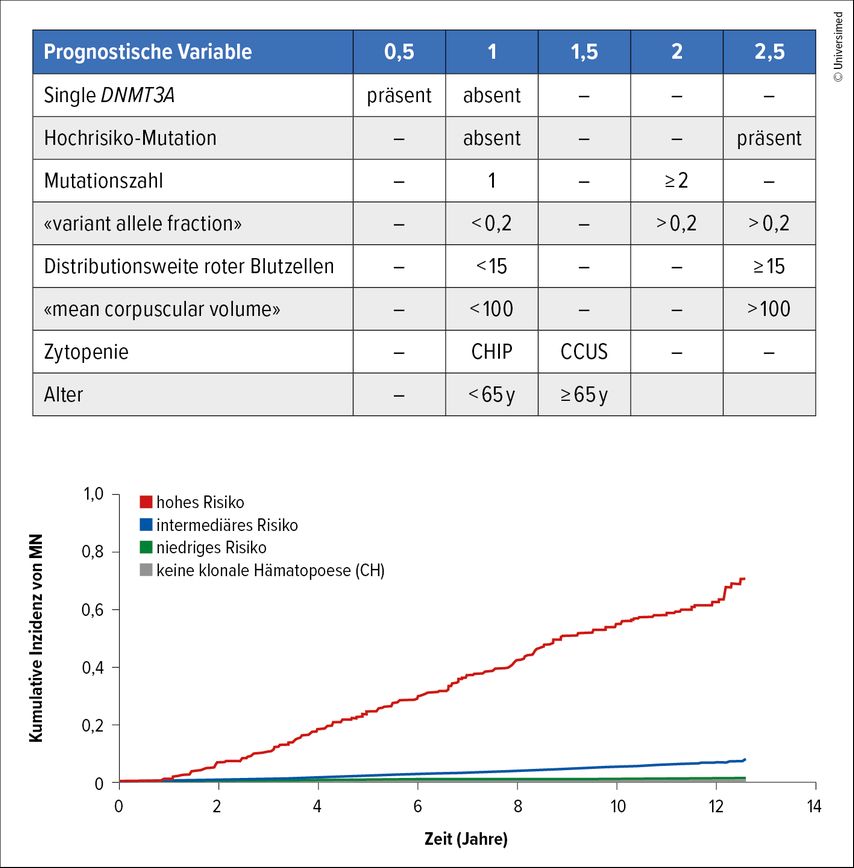
Umfassende Risikostratifizierungstools wie der IPSS-R und der IPSS-M, einschliesslich molekularer Profile und des Clonal Hematopoiesis Risk Score (CHRS), sind entscheidend für die Identifizierung von Patient:innen mit erhöhtem Progressionsrisiko.
-
Innovative Therapien, wie zielgerichtete Wirkstoffe und immunmodulatorische Medikamente, verändern das Management von MDS grundlegend.
-
Frühzeitige Interventionen bereits vor Diagnose eines manifesten MDS könnten möglicherweise den Krankheitsverlauf positiv beeinflussen («Prä-MDS» wie klonale Hämatopoese mit unbestimmtem Potenzial [CHIP] und klonale Zytopenie unbestimmter Signifikanz [CCUS]).
Seit der WHO-Klassifikation 2022 wird der Begriff «myelodysplastische Neoplasien» verwendet, allerdings die Abkürzung «MDS» beibehalten;1 in der ICC-Klassifikation wird aber noch immer von myelodysplastischen Syndromen gesprochen – die neuere Terminologie kann als «MyeloDysplaStische Neoplasien» gelesen werden, um noch mit der Abkürzung übereinzustimmen.
MDS sind eine heterogene Gruppe klonaler Erkrankungen der hämatopoetischen Stammzelle, die durch eine dysplastische und ineffektive Hämatopoese gekennzeichnet sind. Dies führt zu unterschiedlich ausgeprägten peripheren Zytopenien (mit meist Leitbefund einer Anämie) und einem erhöhten Risiko für eine Transformation in eine akute myeloische Leukämie (AML). Die personalisierte Medizin, gestützt auf molekulare Erkenntnisse, revolutioniert zunehmend die therapeutischen Möglichkeiten und ermöglicht personalisierte Therapieansätze.
Diagnose und Epidemiologie
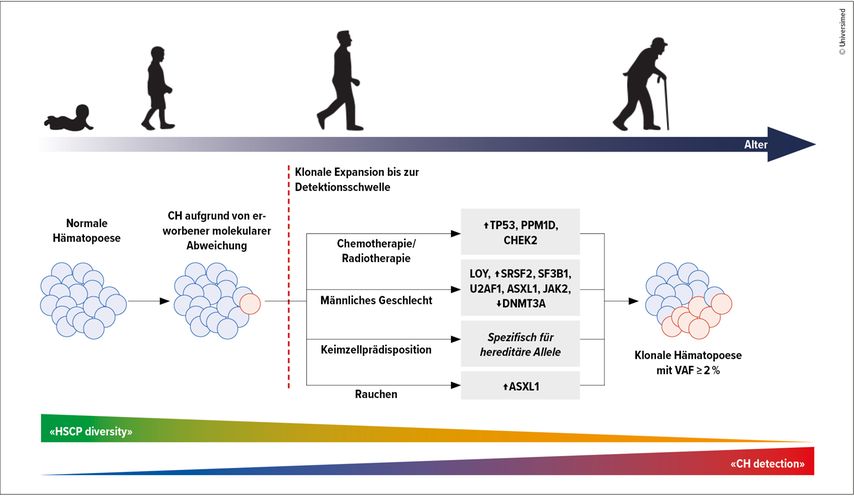
Epidemiologische Daten zeigen, dass etwa 60–70% der MDS-Fälle als Niedrigrisiko-MDS (LR-MDS) nach dem revidierten Internationalen Prognostischen Scoring-System (IPSS-R) eingestuft werden. Patient:innen mit LR-MDS weisen oft asymptomatische Zytopenien auf, benötigen jedoch eine engmaschige Überwachung aufgrund des Progressionspotenzials. Die molekulare Risikostratifizierung, einschliesslich somatischer Mutationen und des klonalen Hämatopoese-Risiko-Scores (CHRS), verbessert die prognostische Genauigkeit durch Identifizierung hochrisikoreicher genetischer Veränderungen. Diese Stratifizierung ist entscheidend für therapeutische Entscheidungen und frühzeitige Interventionen bei Patient:innen mit hoher Progressionswahrscheinlichkeit (Abb. 1 und 2).2,3
Aktuelle Therapielandschaft
Die Behandlung von MDS richtet sich neben dem Alter, dem Allgemeinzustand und Komorbiditäten nach Risiko-Scores, wobei sich die therapeutischen Ziele zwischen Niedrig- und Hochrisikopatient:innen unterscheiden.
Für LR-MDS wird empfohlen:
-
Verringerung der Zytopenien und Verminderung oder Vermeidung einer Transfusionsabhängigkeit
-
Steigerung der Lebensqualität durch supportive Massnahmen wie u.a. die Gabe von Erythrozytentransfusionen und die Eisenchelation
-
Einsatz von Erythropoese-stimulierenden Agenzien (ESA) zur Anämiekorrektur
Für Hochrisiko(HR)-MDS:
-
Fokus auf die Veränderung des Krankheitsverlaufs und Verhinderung der Progression zur AML
-
Hypomethylierende Substanzen (HMA) wie Azacitidin und Decitabin als Standard-Erstlinientherapie
-
Allogene Stammzelltransplantation als potenziell kurative Option, eingeschränkt durch Alter und Komorbiditäten der Patient:innen
Trotz dieser Behandlungen bleibt die Prognose für HR-MDS-Patient:innen ungünstig, mit einer medianen Gesamtüberlebenszeit von oft weniger als zwei Jahren nach HMA-Therapie, was den Bedarf an effektiveren und besser verträglichen Therapien unterstreicht.
Neue Therapien und Konzepte
Frühzeitige Intervention bei Prä-MDS
Die Identifizierung von Zuständen wie CHIP und CCUS eröffnet neue Interventionsmöglichkeiten.
Personen mit CHIP tragen somatische Mutationen ohne manifeste Zytopenien, während CCUS-Patient:innen ungeklärte Zytopenien mit klonalen Mutationen aufweisen, jedoch ohne Nachweis von morphologischen Dysplasien. Beide Zustände sind mit einem erhöhten Risiko für die Entwicklung von MDS, AML und kardiovaskulären Erkrankungen verbunden.
Aktuelle Studien untersuchen Überwachungsstrategien und frühzeitige therapeutische Interventionen, um den Krankheitsausbruch zu verzögern oder zu verhindern. Patient:innen mit einer Hochrisiko-CCUS haben einen ähnlichen Verlauf wie Patient:innen mit einem Niedrigrisiko-MDS.2,3
Hier werden aktuell Strategien wie die hoch dosierte Gabe von Vitamin C bei TET2-mutierten CCUS und MDS,4 der frühzeitige Einsatz von Enasidenib (Phase-I-Studie),5 Canakinumab (Phase-II-Studie)6 sowie Metformin untersucht, das möglicherweise eine Rolle bei CHIP/CCUS mit einer DNMT3A-R882-Mutation spielen könnte (Phase-II-Studie).7 Die Ergebnisse hierzu stehen aus.
NR-MDS: zielgerichtete Therapien
Luspatercept und ähnliche Substanzen
-
Luspatercept dient als «ligand trap» für Aktivin-Rezeptoren und moduliert die TGF-β-Signalgebung zur Förderung der Erythropoese.
-
Die Studien MEDALIST8 und COMMANDS9 zeigten eine signifikante Reduktion des Transfusionsbedarfs und eine Verbesserung des Hämoglobinspiegels bei Niedrigrisiko-MDS-Patient:innen mit Ringsideroblasten und/oder SF3B1-Mutation.
-
In der Phase-III-Studie ELEMENT-MDS wird der frühzeitige Einsatz von Luspatercept oder EPO vor Transfusionsabhängigkeit untersucht.10
-
Eine neuere Substanz ist Elritercept (KER-050). In der Phase-II-Studie KER050-MD-201 konnten sehr gute Ansprechraten bei LR-MDS auch mit hohem Transfusionsbedarf gezeigt werden.11
Lenalidomid
-
Immunmodulatorisches Medikament mit besonderer Wirksamkeit bei Patient:innen mit del(5q)-Mutation
-
In der MDS-004-Studie konnte ein hohe Rate an Transfusionsunabhängigkeit gezeigt werden.12
-
In der Phase-III-Studie SintraREV konnte auch eine Effektivität für einen frühen Einsatz von Lenalidomid gezeigt werden.13
Imetelstat
-
Imetelstat ist ein Telomerase-Inhibitor, der anhand der Daten der Phase-III-Studie IMerge14 in den USA bei Patient:innen mit NR-MDS und Transfusionsabhängigkeit zugelassen wurde, die auf ESA entweder kein Ansprechen zeigen oder im Therapieverlauf refraktär sind.
-
Auf der Jahrestagung 2024 der EHA wurden nun erweiterte Daten der Studie gezeigt, die auch noch nach einem Jahr bei immerhin noch 18% der Teilnehmenden (im Vergleich zu 2% bei Placebo) eine Transfusionsunabhängigkeit zeigten.
HR-MDS: innovative Ansätze
IDH-Inhibitoren
-
Bei etwa 3–12% der MDS-Patient:innen findet sich eine IDH-Mutation, die als Driver-Mutation für den Übergang in eine AML gilt und mit einer schlechten Prognose assoziiert ist.15–17 Ivosidenib (IDH1) und Enasidenib (IDH2) sind in den USA von der FDA zur Therapie bei AML zugelassen.
-
Wirkstoffe wie Ivosidenib (IDH1-Inhibitor) und Enasidenib (IDH2-Inhibitor) zeigen vielversprechende Ergebnisse und werden in weiteren Studien u.a. in Kombination mit HMA untersucht.18,19
RARA-gerichtete Therapien
-
Bei etwa 50% der MDS-Patient:innen findet sich eine RARA-Überexpression.
-
Aktuell wird der RARA-Agonist Tamibaroten in Kombination mit Azacitidin im Rahmen einer Phase-III-Studie bei neu diagnostiziertem HR-MDS untersucht.20 Die Ergebnisse hierzu stehen aus. In einer Phase-II-Studie bei Patient:innen mit AML konnte ein komplettes Ansprechen bei 61% der Patient:innen gezeigt werden.21
Eltanexor (KPT-8602) und«second generation» HMA
-
Eltanexor, ein selektiver Inhibitor des nuklearen Exports, zeigt Aktivität bei HMA-refraktärem MDS.22
-
Neue HMA mit verbesserten pharmakokinetischen Eigenschaften werden entwickelt, um Resistenzen zu überwinden und die Wirksamkeit zu steigern.23,24
CPX-351 (Vyxeos)
-
In einer Phase-II-Studie konnte bei transplantationsfähigen Patienten mit neu diagnostiziertem HR-MDS und CMML eine Ansprechrate von 87% erreicht werden, wobei 94% der Patient:innen eine allogene Stammzelltransplantation erhalten haben.25
-
Aktuell laufen weitere Studien bei neu diagnostiziertem MDS und bei MDS nach HMA-Versagen.26,27
BCL2-Inhibitoren
-
BCL2 wird in hämatologischen Neoplasien überexprimiert, was invers mit dem Ansprechen auf HMA und dem Überleben korreliert. Der überwiegende Anteil an Studien liegt hier bisher für die AML vor.28
-
Es erfolgen nun auch zunehmend Untersuchungen bei MDS und CMML.29,30 Weitere Phase-II/III-Studien laufen gerade.31,32
Zukünftige Perspektivenund Schlussfolgerung
Die Behandlung von MDS befindet sich im Wandel, angetrieben durch molekulare Diagnostik und zielgerichtete Therapien. Personalisierte Ansätze, basierend auf genetischen und epigenetischen Profilen, versprechen verbesserte Überlebensraten und eine höhere Lebensqualität für die Patient:innen.
Zukünftige Forschung sollte sich auf die Integration neuer Wirkstoffe in Standardtherapien, die Optimierung von Kombinationstherapien und die Identifikation prädiktiver Biomarker konzentrieren. Zudem könnten frühzeitige Interventionen bei Prä-MDS-Zuständen das Management myeloischer Neoplasien grundlegend verändern.
Literatur:
1 Khoury JD et al.: The 5th edition of the World Health Organization Classification of haematolymphoid tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia 2022; 36(7): 1703-19 2 Weeks LD, Ebert BL: Causes and consequences of clonal hematopoiesis. Blood 2023; 142(26): 2235-46 3 Weeks LD et al.: Prediction of risk for myeloid malignancy in clonal hematopoiesis. NEJM Evid 2023; 2(5): 10.1056/evidoa2200310 4 Mikkelsen SU et al.: EVITA/NCT03682029: Vitamin C supplementation in patients with clonal cytopenia of undetermined significance or low-risk myeloid malignancies: results from EVI-2, arandomized, placebo-controlled phase 2 study. EHA 2024; Abstr. #LB3444 5 NCT05102370: A pilot study of enasidenib in people with clonal cytopenia of undetermined significance and mutations in IDH2 6 IMPACT/NCT05641831: Canakinumab for the prevention of progression to cancer in patients with clonal cytopenias of unknown significance, IMPACT study 7 NCT04741945: Repurposing metformin as a leukemia-preventive drug in CCUS and LR-MDS 8 Germing U et al.: Improved benefit of continuing luspatercept therapy: sub-analysis of patients with lower-risk MDS in the MEDALIST study. Ann Hematol 2023; 102(2): 311-21 9 Platzbecker U et al.: Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet 2023; 402(10399): 373-85 10 Zeidan AM et al.: The ELEMENT-MDS Trial: a phase 3 randomized study evaluating luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, non-transfusion-dependent, lower-risk myelodysplastic syndromes. Blood 2023; 142(Suppl 1): 6503 11 Diéz Campelo M et al.: Durable clinical benefit with elritercept (KER-050) treatment: findings from an ongoing phase 2 trial in participants with lower-risk MDS. EHA 2024; Abstr. #S183 12 Fenaux P et al.: A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with low-/intermediate-1-risk myelodysplastic syndromes with del5q. Blood 2011; 118(14): 3765-76 13 Cadenas FLL, Gonzalez T: Evaluation of lenalidomide (len) vs placebo in non-transfusion dependent low risk del(5q) MDS patients. Final results of Sintra-REV phase III international multicenter clinical trial. Blood 2022; 140 14 Platzbecker U et al.: Imetelstat in patients with lower-risk myelodysplastic syndromes who have relapsed or are refractory to erythropoiesis-stimulating agents (IMerge): a multinational, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2024; 403(10423): 249-60 15 Patnaik MM et al.: WHO-defined ‚myelodysplastic syndrome with isolated del(5q)‘ in 88 consecutive patients: survival data, leukemic transformation rates and prevalence of JAK2, MPL and IDH mutations. Leukemia 2010; 24(7): 1283-9 16 Patnaik MM et al.: Differential prognostic effect of IDH1 versus IDH2 mutations in myelodysplastic syndromes: aMayo Clinic study of 277 patients. Leukemia 2012; 26(1): 101-5 17 Lin CC et al.: IDH mutations are closely associated with mutations of DNMT3A, ASXL1 and SRSF2 in patients with myelodysplastic syndromes and are stable during disease evolution. Am J Hematol 2014; 89(2): 137-44 18 DiNardo CD et al.: Targeted therapy with the mutant IDH2 inhibitor enasidenib for high-risk IDH2-mutant myelodysplastic syndrome. Blood Adv 2023; 7(11): 2378-87 19 Sébert M et al.: Ivosidenib monotherapy in IDH1 mutated myelodysplastic syndrome, final results of the idiome trial, a GFM study. EHA 2024; Abstr. #S182 20 Dezern AE et al.: A randomized, double-blind, placebo-controlled study of tamibarotene/azacitidine versus placebo/azacitidine in newly diagnosed adult patients selected for RARA+ HR-MDS (SELECT-MDS-1). J Clin Oncol 2022; 40(Suppl 16): Abstr. #TPS7075 21 De Botton S et al.: Targeting RARA overexpression with tamibarotene, a potent and selective RARalpha agonist, is a novel approach in AML. Blood Adv 2023; 7(9): 1858-70 22 Lee S et al.: Oral eltanexor treatment of patients with higher-risk myelodysplastic syndrome refractory to hypomethylating agents. J Hematol Oncol 2022; 15(1): 103 23 Garcia-Manero G et al.: Oral decitabine-cedazuridine versus intravenous decitabine for myelodysplastic syndromes and chronic myelomonocytic leukaemia (ASCERTAIN): a registrational, randomised, crossover, pharmacokinetics, phase 3 study. Lancet Haematol 2024; 11(1): e15-26 24 Garcia-Manero G et al.: Guadecitabine (SGI-110) in patients with intermediate or high-risk myelodysplastic syndromes: phase 2 results from a multicentre, open-label, randomised, phase 1/2 trial. Lancet Haematol 2019; 6(6): e317-27 25 Peterlin P et al.: CPX-351 in higher risk myelodysplastic syndrome and chronic myelomonocytic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Haematol 2023; 10(7): e521-9 26 PALOMA/NCT04061239: Primary comparison of liposomal anthracycline based treatment versus conventional care strategies before allogeneic stem cell transplantation in patients with higher risk MDS and oligoblastic AML – the PALOMA study 27 NCT03957876: CPX-351 therapy for MDS after hypomethylating agent failure 28 El-Cheikh J et al.: Venetoclax: a new partner in the novel treatment era for acute myeloid leukemia and myelodysplastic syndrome. Clin Hematol Int 2023; 5(2-3): 143-54 29 Zeidan AM et al.: A phase 1b study of venetoclax and azacitidine combination in patients with relapsed or refractory myelodysplastic syndromes. Am J Hematol 2023; 98(2): 272-81 30 Wei AH: Maintenance therapy for AML: are we there yet? Blood 2019; 133(13): 1390-2 31 NCT05782127: Oral azacitidine combined with venetoclax in previously untreated higher-risk myelodysplastic syndromes 32 NCT04401748: Study of venetoclax tablet with intravenous or subcutaneous azacitidine to assess change in disease activity in adult participants with newly diagnosed higher-risk myelodysplastic syndrome (Verona)
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...