Multiples Myelom und CAR-T-Zellen: limitierende neurologische Nebenwirkungen?
Autorin:
DDr. Anna Grisold
Univ.-Klinik für Neurologie
Medizinische Universität Wien
E-Mail: anna.grisold@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
CAR-T-Zell-Therapie markiert einen maßgeblichen Fortschritt in der Therapie des multiplen Myeloms. Doch unter den auftretenden Nebenwirkungen gibt es auch neurologische Symptome, die entsprechend erkannt, evaluiert und behandelt werden sollten.
In den vergangenen Jahren konnte die Therapielandschaft im Bereich der Hämatoonkologie maßgeblich erweitert werden. Beispielsweise kommen beim refraktären/rezidivierten multiplen Myelom neue Immuntherapien zum Einsatz, deren Wirkstoffe an BCMA andocken und zu einer Tumorlyse führen. Dazu zählen BCMA-Antikörper-Wirkstoff-Konjugate (BCM-ADC), BCMA-bispezifische Antikörper (BiTE) sowie die CAR-T-Zellen.1 Der vorliegende Artikel behandelt neurologische Nebenwirkungen (NW), die unter CAR-T-Zell-Therapie beim multiplen Myelom auftreten können. In Österreich zugelassen sind derzeit die beiden Substanzen Ide-Cel und Cilta-Cel.
Neurologische Nebenwirkungen
„Immune effector cell-associated neurotoxicity syndrome“
Durch die oben beschriebene Tumorlyse im Rahmen der Therapie kommt es zu einer Freisetzung von zahlreichen Zytokinen, die in die Blutbahn abgegeben werden und eine endotheliale Dysfunktion verursachen. Es kann dabei zu systemischen Effekten im Sinne eines CRS („cytokine release syndrome“) kommen.
Das CRS kann sich unterschiedlich manifestieren und von milden, grippalen Symptomen bis zu lebensgefährlichen Komplikationen aufgrund der inflammatorischen Antwort reichen. In selteneren Fällen kann es auch zu einer erhöhten Permeabilität der Blut-Hirn-Schranke kommen, woraus in weiterer Folge ein ICANS („immune effector cell-associated neurotoxicity syndrome“) resultieren kann.2
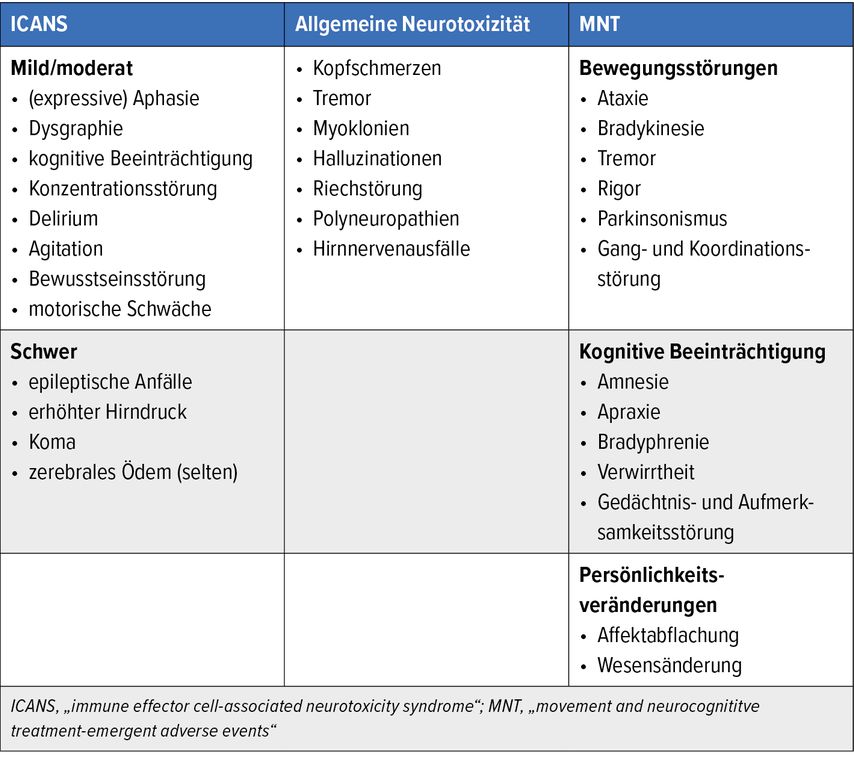
Das ICANS tritt meistens im Anschluss an ein CRS auf, kann aber auch gleichzeitig mit einem CRS oder seltener komplett unabhängig davon auftreten. Der Symptombeginn ist in den ersten Tagen nach Therapiestart zu erwarten, wobei die Beschwerden zumeist mild und reversibel sind; schwerwiegende Verläufe sind selten.3 Neurologische Symptome können vielgestaltig sein, charakteristisch ist eine initial mildere Ausprägung mit Schreib- oder Sprachstörung. Darüber hinaus sind kognitive Beeinträchtigungen, Konzentrationsstörungen, Delir, Agitiertheit, motorische Schwäche bzw. Bewusstseinsstörungen möglich. Als schwerwiegende Komplikationen wurden in der Literatur epileptische Anfälle, erhöhter Hirndruck, zerebrales Ödem bis hin zu Koma beschrieben.4 Die Symptomatik kann im Krankheitsverlauf undulieren (Tab. 1).
Es wurde versucht, Faktoren zu identifizieren, die mit der Entwicklung eines ICANS assoziiert sind. Patient:innenspezifisch wurden ein schweres CRS, ein jüngeres Alter oder neurologische Vorerkrankungen als Risikofaktoren identifiziert, wobei auch eine hohe Tumorlast bzw. die Intensität der Lymphodepletion bzw. die Art und Dosis der CAR-T-Zell-Therapie eine relevante Rolle spielen können.3,5
Allgemeine Neurotoxizität
In der Literatur werden (neben dem ICANS) auch weniger spezifische neurologische Symptome zusammengefasst, die meist einer symptomatischen Behandlung bedürfen. Zu dieser generellen Neurotoxizität zählen typischerweise Kopfschmerzen, Tremor, Myoklonien, Halluzinationen oder Riechstörungen.6,7 Unter CAR-T-Zell-Therapie beim multiplen Myelom wurden auch Polyneuropathien bzw. Hirnnervenläsionen beobachtet (Tab. 1).8
„Movement and neurocognitive treatment-emergent adverse events“
Als weitere, seltene Beobachtung in CAR-T-Zell-Studien beim multiplen Myelom sind verzögerte hypokinetische Bewegungsstörungen und neurokognitive Defizite („movement and neurocognitive treatment-emergent adverse events“ [MNT]) beschrieben. Dazu zählen die namensgebenden Bewegungsstörungen (darunter z.B. Ataxie, Parkinsonismus, Gang- und Koordinationsstörung), die kognitive Beeinträchtigung (z.B. Denkverlangsamung, Verwirrtheit, Gedächtnis- und Aufmerksamkeitsstörung) oder auch Persönlichkeitsveränderungen (z.B. Affektabflachung, Wesensveränderung).
In der Literatur wurden eine hohe Tumorlast, CRS≥2 und/oder ICANS und eine starke Expansion bzw. Persistenz von CAR-T-Zellen als relevante Risikofaktoren beschrieben (Tab. 1). Die Symptome traten verzögert auf (nach 14–108 Tagen). MNT zeigten kein Anprechen auf Therapien und waren durch progrediente Verläufe charakterisiert.9
Unter den Studien zu Cilta-Cel wurde in CARTITUDE-1 über fünf Patient:innen mit MNT berichtet, wobei sich in drei dieser Fälle ein letaler Ausgang zeigte. Es muss zum gegenwärtigen Zeitpunkt offenbleiben, inwieweit die MNT oder aber sekundäre Ursachen wie z.B. Sepsis für den Tod dieser Patient:innen ausschlaggebend waren.10,11
In einer der nachfolgenden Studien, CARTITUDE-4, wurde nach Optimierung der möglichen auslösenden Faktoren (u.a. Reduktion der Tumorlast, häufigeres Screening auf neurotoxische Nebenwirkungen) nur ein Patient mit MNT beschrieben.8 Ebenso wurde erstmalig ein einzelner Fall einer Remission der MNT unter Cilta-Cel-Therapie berichtet.12 Unter Ide-Cel fanden sich keine MNT in den Zulassungsstudien, wobei eine nicht näher bezeichnete Grad-3-Nebenwirkung in der Packungsbeilage angeführt wird (Abecma®, INN-idecabtagene vicleucel). Ein weiterer Fallbericht beschreibt einen letalen Ausgang mit MNT nach Ide-Cel-Therapie.13
Bis jetzt konnte noch keine ausreichende Erklärung für das Auftreten der Symptomatik gefunden werden. Bei den wenigen untersuchten Patient:innen waren im Vergleich zum idiopathischen Parkinsonsyndrom die Dopamin-Transporter in der Bildgebung normal, histopathologisch fand sich kein Verlust der Substantia nigra bzw. sprachen die Patient:innen nicht auf die Therapie mit Carbidopa/Levodopa an.14
Es wird vermutet, dass BCMA nicht nur im hämatopoetischen System, sondern auch in den Basalganglien exprimiert wird und eine „on-target off-tumor toxicity“ auslöst.2,14 Alternativ könnte es auch im Rahmen von CRS/ICANS zu einer Ischämie in den Basalganglien und durch eine Reorganisation von neuronalen Schaltkreisen zu einem „Late-onset-Parkinsonismus“ kommen.14
Klassifizierung von ICANS und allgemeiner Neurotoxizität
Zur näheren Einordnung des Schweregrades eines ICANS wurde der ICE-Score (Immune Effector Cell-associated Encephalopathy Score) entwickelt, in den kognitive Domänen wie Orientierung, Benennen, Aufforderungen befolgen, Schreiben und Aufmerksamkeit einfließen.4
Darüber hinaus lässt sich der CARTOX-10-Score anwenden, der neben dem ICE-Score auch die Beurteilung des Bewusstseinsniveaus, epileptischer Anfälle, von Paresen und des erhöhten Hirndrucks bzw. Vorliegens eines zerebralen Ödems sowie eine Einteilung in vier Grade ermöglicht.4 Die generelle Neurotoxizität bzw. MNT werden mittels CTCAE v5.0 eingeteilt.
Neurologische Nebenwirkungen in Studien zu Cilta-Cel und Ide-Cel
In den klinischen Studien zu Ide-Cel (KarMMa-2 und -3) trat eine Neurotoxizität mit vergleichbarer Häufigkeit auf (15–18%, jeweils nur 3% Grad-3/4-Nebenwirkungen). In diesen beiden Studien wurde jedoch das ICANS nicht spezifisch angeführt.6,7
In den Studien zu Cilta-Cel wurde ICANS in der Studie CARTITUDE-1 (Phase Ib/II) spezifisch kategorisiert (insgesamt 17%, 2% mit Grad 3/4). Das Auftreten lag im Mittel bei acht Tagen nach Therapieverabreichung und die mittlere Dauer betrug vier Tage. Die generelle Neurotoxizität trat mit einer Häufigkeit von 20% (9% Grad 3/4) auf und zeigte einen verspäteten Beginn (nach ca. 27 Tagen, mediane Remission nach 74,5 Tagen). Davon waren fünf Patient:innen von MNT und acht von ICANS und konkomitanter Neurotoxizität betroffen.10
Um das Auftreten von MNT zu vermeiden, wurden die zuvor genannten Maßnahmen gesetzt. In der Nachfolgestudie (CARTITUDE-4, Phase III) entwickelten deutlich weniger Patient:innen ein ICANS (4,5%, alle ≤Grad 2) mit einem Onset nach ca. 9,5 Tagen und einer Dauer von ca. zwei Tagen. Die generelle Neurotoxizität lag hier bei 20,5% (2,8% Grad 3/4) mit einem Auftreten nach ca. 21 Tagen. Erfreulicherweise entwickelte lediglich ein Patient ein MNT.8
Therapie von Neurotoxizität undICANS
Ganz allgemein sollten im Falle von neurologischen Symptomen potenzielle andere Ursachen (z.B. metabolisch, infektiös, medikamentös, neoplastisch) ausgeschlossen werden. Hierbei erfolgen in der Regel eine klinisch-neurologische Untersuchung und eine zerebrale Bildgebung (CCT/cMRT). Zum Ausschluss einer infektiösen bzw. meningealen Komponente kann in bestimmten Fällen eine Lumbalpunktion erforderlich sein. Bei epileptischen Anfällen bzw. bei unklaren Bewusstseinsstörungen ist möglicherweise eine EEG-Diagnostik sinnvoll. Eine Elektroneurografie sollte insbesondere bei V.a. Polyneuropathie erfolgen.15
Die Therapie der generellen Neurotoxizität und des ICANS besteht primär aus supportiven Maßnahmen, um neurologische Symptome zu verbessern. Zur Therapie des ICANS werden im Allgemeinen Kortikosteroide empfohlen (bei Grad 1 je nach individuellem Ermessen, ab Grad 2 in jedem Fall). Dabei wird angeraten, ab Grad 2/3 mit Dexamethason i.v. 10–20mg/6h oder Methylprednisolon 1–2mg/kg/12h für 1–3 Tage zu behandeln, bis sich die Symptome zurückbilden (≤Grad 1); in weiterer Folge sollte ein (rasches) Tapering erfolgen. Im Falle eines Grad-4-ICANS ist eine Hochdosis-Cortisonstoßtherapie indiziert (Methylprednisolon 1000–2000mg i.v. für 3 Tage, gefolgt von Tapering).
Sollte gleichzeitig ein CRS bestehen, wird Tocilizumab (erste Gabe immer mit Cortison) empfohlen. Bei isoliertem ICANS ist Tocilizumab nach momentanem Wissensstand nicht als Therapie zu empfehlen, da die Durchlässigkeit durch die Blut-HirnSchranke nicht ausreichend ist. Bei fehlender Wirksamkeit von Cortison kann auf andere Biologika bzw. Immunsuppressiva ausgewichen werden (z.B. Anakinra, Siltuximab oder Cyclophosphamid).
Bei epileptischen Anfällen ist eine anfallssuppressive Therapie indiziert, beispielsweise mit Levetiracetam. Im Falle eines erhöhten Hirndrucks ist eine symptomatische Therapie mit Acetazolamid, Mannitol und/oder hypertoner Kochsalzlösung zu erwägen.2,5
Zusammenfassung
Das ICANS tritt meistens nach einem CRS auf und ist in der Regel transient. Am häufigsten zeigen die Betroffenen enzephalopathische Symptome. Die frühe Neurotoxizität bzw. das ICANS sind zumeist durch einen milden Verlauf charakterisiert. Es wurden in selteneren Fällen jedoch auch schwere Verläufe beschrieben.
Eine mögliche klinische Manifestation unter CAR-T-Zell-Therapie beim multiplen Myelom ist eine späte Neurotoxizität im Sinne von hypokinetischen Bewegungsstörungen und neurokognitiven Defiziten. Diese Komplikation ist selten, jedoch mit einer schlechten Prognose vergesellschaftet.
Bei Auftreten von neurologischen Symptomen ist eine frühzeitige neurologische bzw. intensivmedizinische Überwachung indiziert. Die Therapie sollte supportiven Charakter haben bzw. in erster Linie aus Kortikosteroiden bestehen. Bei fehlender Wirksamkeit sind andere Immunsuppressiva bzw. Anfallssuppressiva indiziert.
Da neurologische Komplikationen auch nach Entlassung auftreten können, ist eine dahingehende Observanz bis zu 100 Tage nach Verabreichung sinnvoll. Es gilt auch, die Angehörigen und Betreuer:innen diesbezüglich zu informieren. Wenn neurologische Symptome tatsächlich auftreten, sollte eine umgehende Kontaktaufnahme mit dem Behandlungszentrum erfolgen.
Literatur:
1 Yang J et al.: BCMA-targeting chimeric antigen receptor T-cell therapy for multiple myeloma. Cancer Lett 2023; 553: 215949 2 Markouli M et al.: Toxicity profile of chimeric antigen receptor T-cell and bispecific antibody therapies in multiple myeloma: pathogenesis, prevention and management. Curr Oncol 2023; 30(7): 6330-52 3 Kim SJ et al.: Current challenges in chimeric antigen receptor T-cell therapy in patients with B-cell lymphoid malignancies. Ann Lab Med 2024; 44(3): 210-21 4 Lee DW et al.: ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Transplant 2019; 25(4): 625-38 5 Ludwig H et al.: Prevention and management of adverse events during treatment with bispecific antibodies and CAR T cells in multiple myeloma: a consensus report of the European Myeloma Network. Lancet Oncol 2023; 24(6): e255-69 6 Munshi NC et al.: Idecabtagene vicleucel in relapsed and refractory multiple myeloma. N Engl J Med 2021; 384(8): 705-16 7 Rodriguez-Otero P et al.: Ide-cel or standard regimens in relapsed and refractory multiple myeloma. N Engl J Med 2023; 388(11): 1002-14 8 San-Miguel J et al.: Cilta-cel or standard care in lenalidomide-refractory multiple myeloma. N Engl J Med 2023; 389(4): 335-47 9 Cohen AD et al.: Incidence and management of CAR-T neurotoxicity in patients with multiple myeloma treated with ciltacabtagene autoleucel in CARTITUDE studies. Blood Cancer J 2022; 12(2): 32 10 Berdeja JG et al.: Ciltacabtagene autoleucel, a B-cell maturation antigen-directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma (CARTITUDE-1): a phase 1b/2 open-label study. Lancet 2021; 398(10297): 314-24 11 Van Oekelen O et al.: Neurocognitive and hypokinetic movement disorder with features of parkinsonism after BCMA-targeting CAR-T cell therapy. Nat Med 2021; 27(12): 2099-103 12 Graham CE et al.: Chemotherapy-induced reversal of ciltacabtagene autoleucel-associated movement and neurocognitive toxicity. Blood 2023; 142(14): 1248-52 13 Karschnia P et al.: Neurologic toxicities following adoptive immunotherapy with BCMA-directed CAR T cells. Blood 2023; 142(14): 1243-8 14 Gust J: BCMA-CAR T-cell treatment-associated parkinsonism. Blood 2023; 142(14): 1181-3 15 Gust J et al.: Neurotoxicity associated with CD19-targeted CAR-T cell therapies. CNS Drugs 2018; 32(12): 1091-101
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...