Molekularpathologische Diagnostik 2020: Was, wie und wann?
Ruhr-Universität Bochum<br> Klinik für Hämatologie, Onkologie und Palliativmedizin<br> St. Josef-Hospital Bochum

Ruhr-Universität Bochum<br> Klinik für Hämatologie, Onkologie und Palliativmedizin<br> St. Josef-Hospital Bochum

Ruhr-Universität Bochum<br> Institut für Pathologie<br> St. Josef-Hospital Bochum<br>
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das kolorektale Karzinom (KRK) ist eine genetisch gut charakterisierte Erkrankung; die Tumorentstehung wird als sequenzieller Prozess der Akkumulation von Genalterationen und epigenetischen Veränderungen verstanden. Verluste von Tumorsuppressorgenen bzw. Mutation in bestimmten Onkogenen (z.B. BRAF, NRAF, KRAS und PIK3CA) gehen der histologisch sichtbaren Adenom-Karzinom-Sequenz voran. Liegen die Mutationen in den Genen des DNA-Reparatursystems, entstehen Fehler bei der DNA-Replikation, die nicht korrigiert werden können. Das KRK zeigt dann Mutationen, die durch einen Vergleich mit gesundem Gewebe als Mikrosatelliteninstabilität erkannt werden können. Neben den genetischen Aberrationen istdie Interaktion des Tumors mit der sogenannten Tumormikroumgebung (Microenvironment) von Bedeutung.
RAS- und BRAF-Mutationen
Die beiden Moleküle RAS und BRAF sind Komponenten des EGFR-Signalwegs. Vor über 10 Jahren wurde die Mutationsanalyse für Exon 2 von KRAS, seit 2013 die All-RAS-Analyse für KRAS und NRAS[Exon 2, 3, 4]) für die Therapie des metastasierten kolorektalen Karzinoms etabliert. Neuerdings gibt es gezielte Substanzen gegen bestimmte RAS-Mutationen wie G12C, die auch beim Kolonkarzinom in Studien zum Einsatz kommen.
Eine BRAF-Mutation ist ein starker negativer prognostischer Faktor, insbesondere beim metastasierten Kolonkarzinom, aber auch in der adjuvanten Therapiesituation. Bislang hat die Bestimmung einer RAS- oder BRAF-Mutation in der adjuvanten Therapiesituation keine therapeutische Konsequenz und wird daher auch nicht empfohlen. Die Mutationen von BRAF sind Stadium-abhängig. Die Mutationsrate liegt in frühen Stadien bei 8–10%, in fortgeschrittenen Stadien bei 4–5%. Eine BRAF-Mutation ist häufiger bei älteren Patienten nachzuweisen, Frauen sind häufiger betroffen. Proximale Karzinome, schlecht differenziert und mit starker peritumoröser Entzündungsreaktion, sind häufiger BRAF-mutiert.
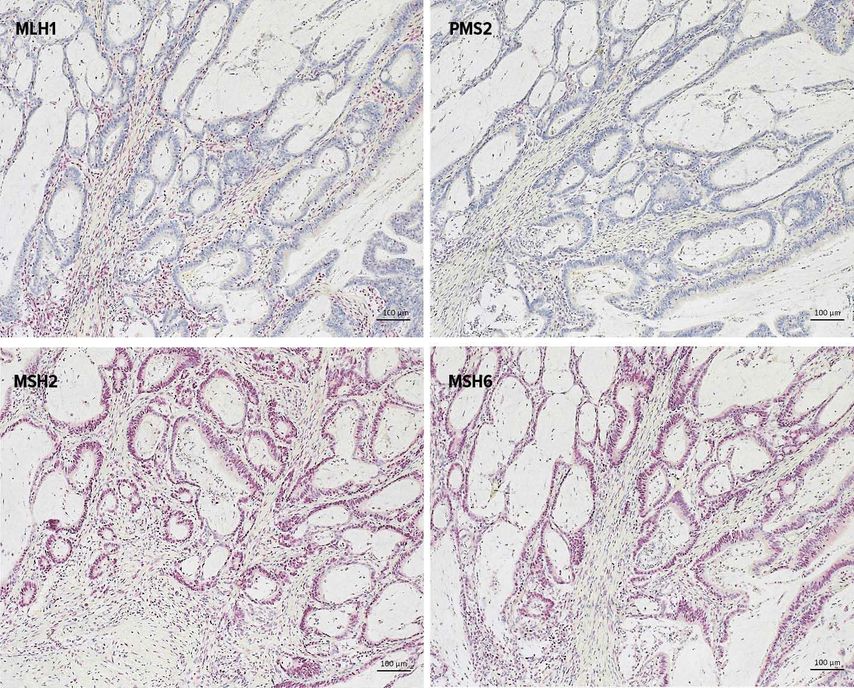
Abb. 1:Immunhistochemische Darstellung der Mikrosatellitenstabilitätanzeigenden Proteine: Ausfall von MLH1 und PMS als Hinweis auf hochgradige Mikrosatelliteninstabilität (MSI-high)
Mikrosatelliteninstabilität
15% aller (nicht hereditären) KRK zeigen eine Mikrosatelliteninstabilität (MSI-H).
Der Funktionsverlust von Mismatch-Reparatur(MMR)-Proteinen führt zu einer Akkumulation von Mutationen, die zu Tumorprogression und Metastasierung führen. Die Mikrosatelliteninstabilitättritt am häufigsten im Stadium II (22%), seltener im Stadium III (12%) und sehr selten im Stadium IV (3%) auf. Ältere Patienten zeigen ebenfalls häufiger MSI-Tumoren.
Mikrosatelliteninstabile Tumoren sind häufiger im rechten Hemikolon lokalisiert und zeigen eine typische Histologie: Sie sind schlecht differenziert und weisen eine starke Infiltration der Tumorumgebung mit Zellen des Immunsystems auf. Diese Entzündung wird durch „Hypermutationen“ und die damit assoziierte Präsentation von Neoantigenen erklärt. Eine Subgruppe von Patienten mit immunaktivierten MSS-Tumoren weist ebenfalls hohe Immun-Scores und ein längeres Überleben auf. Abbildung 1 zeigt die Immunhistochemie der vier MMR-Proteine.
HER2/neu
Zwischen 2 und 6% aller fortgeschrittenen oder metastasierten KRK weisen eine Überexpression von HER2 auf. In mehr als 90% der Fälle ist die Überexpression durch eine Amplifikation von ERBB2, seltener durch aktivierende Varianten in ERBB2 begründet. Diese geht mit einer erworbenen primären und sekundären Resistenz gegenüber einer Anti-EGFR-Therapie einher. Während die Behandlung dieser Tumoren mit einer Anti-HER2-Monotherapie in präklinischen Versuchen kaum Aktivität gezeigt hatte, wurde zum Beispiel bei Kombinationstherapien aus einem HER2-Antikörper und dem Kinaseinhibitor Lapatinib oder zwei Antikörpern (Trastuzumab und Pertuzumab) eine Wirksamkeit gefunden. HER2-positive Tumoren finden sich häufiger im linken Hemikolon. HER2-positive Tumoren zeigen häufiger keine RAS-Mutation, sind RAS-Wildtyp.
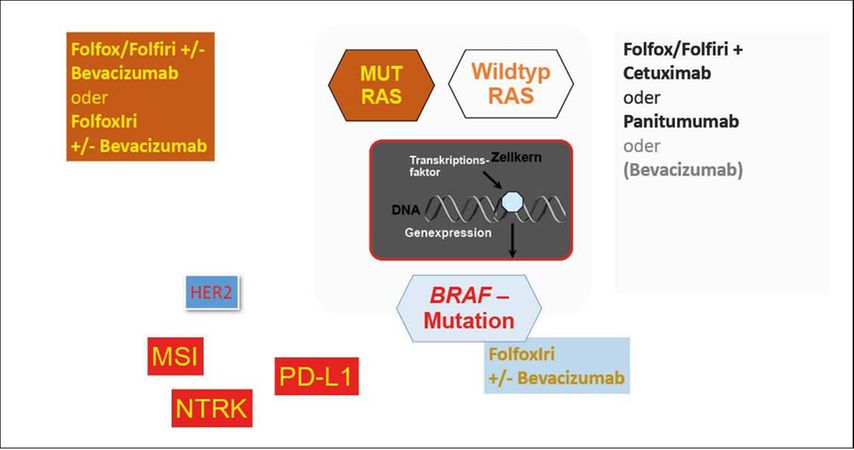
Abb. 2:Molekulare Therapiesteuerung beim kolorektalen Karzinom (KRK). Die Analyse von Biomarkern im Tumorgewebe von Patienten mit KRK erfolgt stadiumabhängig. Die Analysezeitpunkte sind in den entsprechenden Leitlinien empfohlen. Liegt ein Stadium IV (metastasiertes KRK) vor, sollen zur Einleitung der TherapieRAS-, BRAF-Mutationen und MSI bestimmt werden,in zweiter Linie Genalterationen wie HER2 und NTRK, die in Folgetherapien individuell eine zielgerichtete Therapie ermöglichen
PIK3CA (Phosphoinositid-3-Kinase)
PIK3CA ist eine Komponente des EGFR-Signalweges und in ca. 20 bis 25% der KRK mutiert. In zwei großen retrospektiven Analysen gab es Hinweise darauf, dass die gleichzeitige Einnahme von ASS bei Patienten mit einer PI3K-Mutation mit einem signifikant längeren Überleben in der adjuvanten Therapiesituation assoziiert ist. Die Daten werden derzeit prospektiv durch die SAKK und auch hierzulande überprüft.
„Neurotrophe Tyrosin-Rezeptor-Kinase“ (NTRK)-Genfusionen
Bisher wurden verschiedene Formen der NTRK-Genfusionen (Genfusionen von NTRK1, NTRK2 oder NTRK3 mit verschiedenen anderen Genen) in mehr als 30 Tumorentitäten nachgewiesen. Bei Kolonkarzinomen werden Positivitätsraten bis etwa 7% beschrieben, was aufgrund initialer eigener Erfahrungen zu hoch erscheint.
Da die Analyse von Genfusionen aufwendig ist, kann eine immunhistochemische Analyse unter Anwendung des TRK-Antikörpers als Screeningmethode durchgeführt werden. Lässt sich das Fusionsprotein immunhistochemisch nachweisen, sollte eine Multipanel-NGS-Analyse auf RNA-Basis erfolgen.
Tumormutationslast
Eine MSI stellt einen prädiktiven Biomarker für eine Immuntherapie mit Checkpoint-Inhibitoren (ICI) dar. Mikrosatelliteninstabilität führt zu einer Akkumulation von Mutationen und damit zu einer hohen Tumormutationslast (TMB). Allerdings ist MSI nicht gleichbedeutend mit einer hohen Tumormutationslast. Diese kann jedoch auch unabhängig entstehen, z.B. durch Varianten in POLE. Daher scheint eine hohe TMB ein geeigneterer Marker für das Ansprechen einer Immuntherapie mit Checkpoint-Inhibitoren zu sein. Die Analyse der Tumormutationslast ist kompliziert, Grenzwerte müssen für jede Tumorentität definiert werden.
Zirkulierende Tumor-DNA
Zirkulierende Tumor-DNA (ctDNA) kann durch sensitive Methoden im peripheren Blut (Liquid Biopsy) bei Patienten mit Kolonkarzinom bestimmt werden. Bei einer kurzen Halbwertszeit von ctDNA ist der postoperative Nachweis ein Marker für eine minimale Resterkrankung (MRD) und geht mit einem erhöhten Risiko für Erkrankungsrezidive einher. Die longitudinale ctDNA-Messung lässt Rückschlüsse auf das Ansprechen bzw. die Resistenz gegenüber einer adjuvanten Therapie zu und könnte perspektivisch zur Optimierung adjuvanter Behandlungs- und Nachsorgestrategien herangezogen werden. Der prädiktive Wert der ctDNA nach Resektion eines Kolonkarzinoms im Stadium II wird derzeit in der CIRCULATE-Studie überprüft.
Next-Generation Sequencing
Die Prävalenz neuer Genalterationen, die eine zielgerichtete Therapie erfolgreich erscheinen lassen, ist gering. Während RAS-Mutationen in bis zu 50% der kolorektalen Karzinomen nachweisbar sind, finden sich Veränderungen mit großer therapeutischer Relevanz, wie z.B. HER2, in sehr viel weniger Tumoren. Somit müssen Analyseverfahren angewandt werden, die alle Genveränderungen präzise, schnell und auch mit geringer Prävalenz nachweisen. Das Next-GenerationSequencing (NGS)ist eine neue Hochdurchsatz-Methode zur gleichzeitigen Untersuchung mehrerer Gene mit hoher Effizienz, Kosteneffektivität und Schnelligkeit.
Literatur:
bei den Verfasserinnen
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...