Metastasiertes tripelnegatives Mammakarzinom – zielgerichtete Therapien
Autor:innen:
Priv.-Doz. Dr. Elena Laakmann
Prof. Volkmar Müller
Dr. Kerstin Riecke
Klinik und Poliklinik für Gynäkologie
Universitätsklinikum Hamburg-Eppendorf
Korrespondenz:
E-Mail: e.laakmann@uke.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Durch die Einführung von zielgerichteten Therapien in der Behandlung des metastasierten tripelnegativen Brustkrebses ist es zu einer erheblichen Überlebensverlängerung gekommen. Jedoch stellen die neuen zielgerichteten Therapien auch eine neue Herausforderung im Bereich des Nebenwirkungsmanagements dar, mit der Notwendigkeit einer interdisziplinären Behandlung.
Keypoints
-
Zielgerichtete Therapien sind bereits im Behandlungsalltag der Senologie etabliert.
-
Verbesserte Überlebensraten bei Patient:innen mit mTNBC durch zielgerichtete Therapien
-
Neues Nebenswirkungsprofil mit einer Notwendigkeit einer engmaschigen und interdisziplinären Betreuung
-
Weitere zielgerichtete Substanzen sind notwendig, insbesondere in den fortgeschrittenen Therapielinien.
Das Mammakarzinom ist mit knapp 70000 Neuerkrankungen pro Jahr weiterhin die häufigste Krebserkrankung und auch Krebstodesursache der biologischen Frau.1 Die Tumorbiologie der Brustkrebserkrankungen unterscheidet sich und wird in unterschiedliche Subtypen unterteilt. 15–20% aller Brustkrebserkrankungen werden dem tripelnegativen Subtyp zugeordnet.2
Der tripelnegative Brustkrebs (TNBC) ist eine heterogene Gruppe an Tumoren, die sich, vereinfacht gesagt, dadurch auszeichnet, keine Östrogen- (ER) und Progesteronrezeptoren (PR) oder „Human epidermal growth factor“-Rezeptoren 2 (HER2) zu exprimieren. Zudem sind häufiger jüngere Frauen betroffen. TNBC ist in der Regel hochinvasiv und tendiert dazu, frühzeitig zu metastasieren. TNBC geht demnach mit einer schlechteren Prognose als andere Mammakarzinomsubtypen einher.3 Die 5-Jahres-Mortalitätsrate nach Diagnosestellung liegt bei 40%.4
Aufgrund der fehlenden ER-, PR- und HER2-Expression ist der TNBC nicht sensitiv für eine endokrine oder die meisten anti-HER2-gerichteten Therapien. Die aggressive Tumorbiologie und Heterogenität sowie die fehlenden standardisierten und effektiven Behandlungsstrategien für TNBC stellen nach wie vor eine große Herausforderung dar.5 Insbesondere in der metastasierten Situation fehlt es an langfristigen effektiven Therapiestrategien.
In den letzten Jahren wurden insbesondere zielgerichtete Therapien etabliert, die neben der Standard-Chemotherapie eine Verlängerung des Überlebens bei metastasiertem tripelnegativem Brustkrebs (mTNBC) versprechen.
Die folgende Zusammenfassung soll einen Überblick über bereits etablierte zielgerichtete Therapien geben, die u.a Immuntherapien und Antikörper-Wirkstoff-Konjugate beinhalten.
Immuncheckpoint- und PARP-Inhibitoren
TNBC unterscheiden sich von anderen Tumorsubtypen durch eine höhere Immunogenität, eine stärkere Ausprägung von tumorinfilitrierenden Lymphozyten (TIL) sowie durch höhere Expression von programmierten „Cell death“-Liganden (PD-L1). Sie sind daher für eine Immuncheckpoint-Therapie besser geeignet.6
Das Transmembranprotein programmiertes „Cell death“-Protein 1 (PD-1) befindet sich auf den T-Zellen und fördert bei Aktivierung die immunologische Eigentoleranz mit Aktivitätshemmung von zytotoxischen T-Zellen. Bei einer Hemmung des PD-1-Rezeptors hingegen kommt es zu einer erhöhten Aktivität des Immunsystems gegen körpereigenes (Tumor-)Gewebe.
Pembrolizumab ist ein PD-1-Inhibitor. Die Kombination von Pembrolizumab und einer Chemotherapie wurde 2022 durch die U.S. Food and Drug Administration (FDA) zur Behandlung im neoadjuvanten Setting von TNBC und fortgeschrittenem TNBC mit Expression von PD-L1 („combined positive score“ (CPS) >10) zugelassen.7
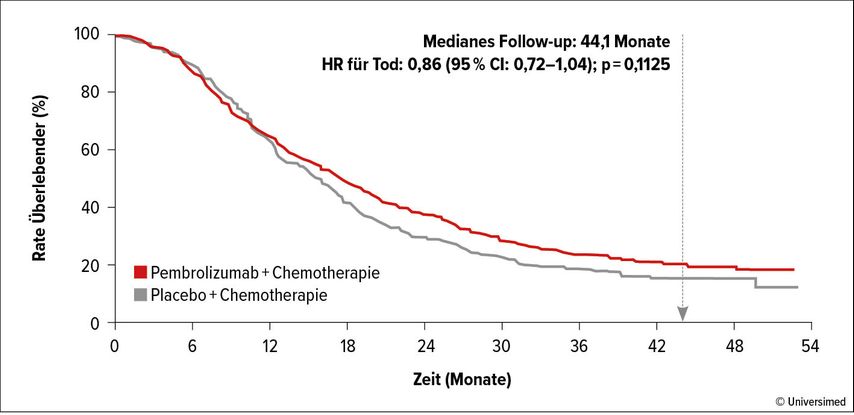
Grundlage dieser Zulassung war die KEYNOTE-355-Studie, eine randomisierte, placebokontrollierte, doppelblinde, klinische Phase-III-Studie, die die Kombination von Pembrolizumab in Kombination mit einer Chemotherapie vs. Placebo+Chemotherapie für bisher unbehandelte, lokal rezidivierte, inoperable oder metastasierte TNBC testete.8
Die Ergebnisse der Studie zeigten eine signifikante Verlängerung des medianen progressionsfreien Überlebens (mPFS) und auch eine signifikante Verlängerung des Gesamtüberlebens (OS) in der Gruppe mit Pembrolizumab und einem CPS-Score >10 (Abb. 1; mPFS: 10 vs. 6 Monate; mOS: 23 vs. 16 Monate).8
KEYNOTE-119: Pembrolizumab in Zweit- oder Drittlinie – negativ
Die KEYNOTE-119-Studie, eine randomisierte, „open-label“ Phase-III-Studie untersuchte daraufhin die Wirksamkeit von Pembrolizumab vs. Chemotherapie alleine als Zweit- oder Drittlinientherapie bei Patient:innen mit mTNBC.9 Die Ergebnisse der Studie zeigten jedoch keinen signifikanten Überlebensvorteil für Pembrolizumab vs. Chemotherapie.9 Auch Agostinetto E et al. konnten keine Verlängerung des Gesamtüberlebens durch Pembrolizumab in der fortgeschrittenen Therapielinie des mTNBC erkennen.7
Atezolizumab ist ein PD-L1-Inhibitor und somit ein weiterer Immuncheckpoint-Inhibitor. Im Rahmen der IMpassion130-Studie wurde die Wirksamkeit von Atezolizumab in Kombination mit Nab-Paclitaxel für mTNBC untersucht.10 Hierbei wurden ein verlängertes progressionsfreies Überleben und ein längeres, jedoch statistisch nicht signifikant verlängertes OS bei Patient:innen mit mTNBC erkannt, die mit Atezolizumab behandelt wurden.11
Die PD-L1-Testung erfolgte anhand von tumorinfiltrierenden Immunzellen (IC-Score: <1% PD-L1- vs. ≥1% PD-L1+). Die Europäische Arzneimittel-Agentur (EMA) erwirkte 2019 eine Zulassung für Atezolizumab in Kombination mit Nab-Paclitaxel zur Behandlung von Patient:innen mit lokal fortgeschrittenem oder metastasiertem TNBC, deren Tumoren eine PD-L1-Expression von ≥1% zeigten und die keine vorhergegangene Chemotherapie erhalten hatten.
Nebenwirkungsprofil
Die Behandlung mit Immuncheckpoint-Inhibitoren hat nicht nur zu einer Verlängerung des Überlebens bei mTNBC geführt, sondern auch zu einer Veränderung des Nebenwirkungsprofils in der Behandlung von mTNBC. Dieses veränderte Nebenwirkungsprofil stellt eine neue Herausforderung im Management dar.
So kommen bei Pembrolizumab zu den häufigsten allgemeinen Nebenwirkungen wie Anämie, Neutropenie und Übelkeit immunologische Nebenwirkungen wie Hypothyreoidismus (16% vs. 3%), Hyperthyreoidismus (4% vs. 1%) und Pneumonitis (3% vs. 0%) dazu.8 Die Behandlung der immunologischen Nebenwirkungen bedarf einer interdisziplinären Zusammenarbeit und einer prätherapeutischen Risikoprofileinschätzung und Auswahl der geeigneten Patient:innen für die jeweiligen Therapien.
OlympiAD: PARP-Inhibition mit Olaparib
Eine weitere zielgerichtete Therapie stellt die PARP-Inhibition dar. Im Rahmen der OlympiAD-Studie, einer randomisierten, kontrollierten, „open-label“ Phase-III-Studie, wurde bei Patient:innen mit Keimbahn-BRCA1- oder Keimbahn-BRCA2-Mutation (BRCAm) und HER2-negativem metastasiertem Brustkrebs (mBC) mit ≤2 Linien Chemotherapie die Wirksamkeit von Olaparib vs. Chemotherapie nach Wahl der Ärzt:innen getestet.12 Hierbei konnte festgestellt werden, dass insbesondere Patient:innen, die keine Vortherapie in der metastasierten Situation erhalten hatten, von der Olaparib-Gabe profitierten (OS: 7 vs. 4 Monate).12
Daraufhin erfolgte eine EMA-Zulassung für Olaparib als Monotherapie bei Patient:innen mit BRCAm und HER2-negativem, lokal fortgeschrittenem oder metastasiertem Brustkrebs. Die Patient:innen sollten zuvor mit einem Anthrazyklin und einem Taxan im (neo)adjuvanten oder metastasierten Setting behandelt worden sein.
Identische Zulassung gibt es für einen weiteren PARP-Inhibitor, Talazoparib, der aufgrund der EMBRACA-Studie zugelassen worden ist.13
Antikörper-Wirkstoff-Konjugate
Antikörper-Wirkstoff-Konjugate (ADC) stellen ebenfalls eine wirksame zielgerichtete Therapie dar.
Sacituzumab Govitecan: Überlebensvorteil
Sacituzumab Govitecan (SG) ist ein ADC, das das Trophoblasten-Oberflächen-Antigen-2 (Trop-2), ein transmembranäres Glykoprotein, als Target hat. Hierbei setzt sich die Substanz aus dem gegen Trop-2 gerichteten rekombinanten IgG1κ-AK Sacituzumab und einem zytotoxischen Topoisomerase-I-Inhibitor SN-38 (Govitecan) zusammen. Die Bindung von SG erfolgt an den Trop-2-Rezeptor, woraufhin es zur Internalisierung in die Tumorzelle kommt, SN38 freigesetzt wird und der Prozess zu einer Apoptose der Tumorzelle führt.
Bardia A et al. verglichen 2001 die Wirksamkeit von SG alleine im Vergleich zu einer Chemotherapie nach Wahl miteinander.14 Hierbei konnten bei SG sowohl eine Verlängerung des progressionsfreien Überlebens (5,6 vs. 1,7 Monate) als auch ein signifikanter Überlebensvorteil (12,1 vs. 6,7 Monate) festgestellt werden.14
Diese Ergebnisse führten 2021 zu einer Zulassung durch die EMA für die Monotherapie bei nichtresezierbarem oder metastasiertem TNBC bei Patient:innen, die zuvor zwei oder mehr systemische Therapien erhalten hatten.
Trastuzumab Deruxtecan bei HER2-low
Ein weiteres ADC in der Behandlung des TNBC ist Trastuzumab Deruxtecan (TDXd), das den monoklonalen anti-HER2-gerichteten Antikörper Trastuzumab über einen Linker an den zytotoxischen Topoisomerase-I-Inhibitor Deruxtecan bindet. Nachdem die Wirksamkeit von TDXd bei Patient:innen mit HER2-positivem metatasiertem Brustkrebs nachgewiesen worden war,15 erfolgte im Rahmen der DESTINY-Breast04-Studie die Testung von TDXd bei HER2-low-exprimierenden mBC-Patient:innen, die eine oder zwei vorhergegangene Chemotherapien erhalten hatten.16
Zugrunde liegend war hierbei die Annahme, dass es innerhalb der großen Gruppe der bisher als HER2-negativ klassifizierten, ER-/PR-positiven oder -negativen Subtypen eine neue Untergruppe mit niedriger HER2-Expression gibt, die von einer anti-HER2-gerichteten Therapie profitieren könnte. Hierbei wurde „HER2-low“ definiert als „HER2 1+“ oder „HER2 2+“ in der Immunhistochemie (IHC), jedoch negativ in der In-situ-Hybridisierung (ISH).16 Im Rahmen dieser Studie konnten ein verlängertes progressionsfreies und Gesamtüberleben bei Patient:innen mit HER2-low mBC durch die Therapie mit TDXd gezeigt werden (HR-negativ/HER2-low mOS: 18,2 vs. 8,3 Monate; HR-positiv und HR-negativ/HER2-low PFS: 9,9 vs. 5,1 Monate).16
Zu den häufigsten Nebenwirkungen zählen Neutropenie, Nausea, Fatigue, Alopezie, verminderte linksventrikuläre Ejektionsfraktion (LVEF) und Pneumonitis/interstitielle Lungenerkrankung (ILD). Im Rahmen der Therapie mit TDXd steht jedoch als die klinisch relevanteste Nebenwirkung hauptsächlich die therapieinduzierte ILD im Vordergrund. Modi S et al.berichteten von einem Anteil von 12,1% der Patient:innen, die eine ILD oder Pneumonitis im Rahmen der Therapie erlitten.16 Im Rahmen der Therapie mit TDXd sind somit eine engmaschige Kontrolle und niederschwellige Diagnostik bei Anzeichen einer ILD notwendig.
Die EMA hat im März 2023 eine Zulassung von TDXd als Monotherapie bei Patient:innen mit HER2-low mBC erwirkt, die bereits eine Chemotherapie in der metastasierten Situation erhalten haben oder bei denen innerhalb von sechs Monaten nach Ende der adjuvanten Therapie ein Rezidiv aufgetreten ist.
BEGONIA: ADC+Immuncheckpoint-Inhibition
Eine Kombination von ADC mit Immuncheckpoint-Inhibition wird aktuell in klinischen Studien weiter untersucht. Die präliminären Ergebnisse aus der BEGONIA-Studie wurden auf dem ESMO-Kongress 2023 vorgestellt.
Die Kombination aus Datopotamab Deruxtecan und Durvalumab in der Erstlinienbehandlung beim metastasierten TNBC zeigte robuste Ansprechraten. Weitere, detailliertere Studienauswertungen folgen.17
Fazit
Zusammenfassend lässt sich festhalten, dass es aufgrund der neuen zielgerichteten Therapien zu einer Verlängerung des Überlebens bei Patient:innen mit mTNBC gekommen ist. Die neuen zielgerichteten Therapien haben bereits Eingang in den Behandlungsalltag der Senologie gefunden.
Die unter diesen Therapien auftretenden neuartigen Nebenwirkungen stellen eine Herausforderung im Behandlungsalltag dar und erfordern eine engmaschige und interdisziplinäre Zusammenarbeit. Einen kompletten Überblick über die Behandlungsmöglichkeiten inklusive zielgerichteter und nicht zielgerichteter Therapien bietet die ESMO-Leitlinie.18
Weitere zielgerichtete Therapien, insbesondere für fortgeschrittene Therapielinien beim mTNBC, sind weiterhin notwendig und wichtig für die Verlängerung des Überlebens der Patient:innen.
Literatur:
1 Robert-Koch-Institut Berlin: Krebs in Deutschland für 2017/2018. Online unter https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2021/krebs_in_deutschland_2021.pdf?__blob=publicationFile. Stand: 4.4.2022 2 Keenan TE, Tolaney SM: Role of immunotherapy in tripelnegative breast cancer. JNatl Compr Canc Netw 2020; 18(4): 479-89 3 Bergin ART, Loi S: Triple-negative breast cancer: recent treatment advances. F1000 Res 2019; 2: 8: F1000 Faculty Rev-1342 4 Lin NU et al.: Sites of distant recurrence and clinical outcomes in patients with metastatic tripelnegative breast cancer: high incidence of central nervous system metastases. Cancer 2008; 113(10): 2638-45 5 O´Saughnessy J et al.: Analysis of patients without and with an initial tripelnegative breast cancer diagnosis in the phase 3 randomized ASCENT study of sacituzumab govitecan in metastatic tripelnegative breast cancer. Breast Cancer Res Treat 2022; 195(2): 127-39 6 Kwapisz D: Pembrolizumab and atezolizumab in tripelnegative breast cancer. Cancer Immunol Immunother 2021; 70(3): 607-17 7 Agostinetto E et al.: Progress and pitfalls in the use of immunotherapy for patients with triple negative breast cancer. Expert Opin Investig Drugs 2022; 31(6): 567-91 8 Cortes J et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic tripelnegative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265): 1817-28 9 Winer EP et al.: Pembrolizumab versus investigator-choice chemotherapy for metastatic tripelnegative breast cancer (KEYNOTE-119): arandomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(4): 499-511 10 Emens LA et al.: First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic tripelnegative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol 2021; 32(8): 983-93 11 Schmid P et al.: Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic tripelnegative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21(1): 44-59 12 Robson ME et al.: OlympiAD final overall survival and tolerability results: olaparib versus chemotherapy treatment of physician‘s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer. Ann Oncol 2019; 30(4): 558-66 13 Litton JK et al.: Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N Engl J Med 2018; 379(8): 753-63 14 Bardia A et al.: Sacituzumab govitecan in metastatic tripelnegative breast cancer. NEngl J Med 2021; 384(16): 1529-41 15 Modi S et al.: DESTINY-Breast01 investigators. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7): 610-21 16 Modi S et al.: DESTINY-Breast04 trial investigators. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. NEngl J Med 2022; 387(1): 9-20 17 Schmid P et al.: Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic tripelnegative breast cancer (a/mTNBC): initial results from BEGONIA, a phase 1b/2 study. ESMO 2023; Abstr. #166MO 18 Gennari A et al.: ESMO Guidelines Committee: ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol 2021; 32(12): 1475-95
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...