Mammakarzinom – Eine Herausforderung an die interdisziplinäre Therapie
Autoren:
Dr. med. Sonja Ebner1,3
PD Dr. med. Marcus Vetter2,4
1Frauenklinik Baselland, Brustchirurgie, Kantonsspital Baselland, Liestal
2Abteilung Hämatologie,
Onkologie & Immuntherapie,
Medizinische Universitätsklinik, Liestal
3Brustzentrum, Universitätsspital Basel
4Abteilung Medizinische Onkologie, Universitätsspital Basel
Korrespondenz:
E-Mail: sonja.ebner@ksbl.ch
Eine erfolgreiche Behandlung des Mammakarzinoms beruht auf einem interdisziplinären Diagnostik- und Therapiemanagement, das immer enger auf die individuelle Patientin zugeschnitten wird. Dadurch hat sich die Prognose des Mammakarzinoms in den letzten Jahrzehnten deutlich verbessert und rund 85% aller Patientinnen können heute geheilt werden. Gynäkologische Chirurgen und Onkologen arbeiten eng zusammen, um jeder Patientin ein passendes Therapiekonzept anzubieten – zusammen mit Radiologen, Pathologen, Radioonkologen, plastischen Chirurgen, Humangenetikern und Psychoonkologen.1 Dieser Artikel soll anhand ausgewählter Themen die damit verbundenen Herausforderungen und immer komplexeren Anforderungen an die behandelnden Ärzte aufzeigen.
Keypoints
-
Die Brust- und Axillachirurgie ist in den letzten Jahrzehnten von zunehmender Deeskalation geprägt.
-
Die brusterhaltende Therapie (Tumorektomie mit Radiotherapie) weist im Vergleich zur Mastektomie eine äquivalente Überlebensrate auf.
-
Unter anderem hat auch die Systemtherapie des Mammakarzinoms zu einer deutlichen Verbesserung der Prognose beigetragen.
-
Im palliativen Setting sollte eine Re-Biopsie erfolgen, um eine optimale Therapie zu planen, die sich an der Biologie und dem Tumor-Load orientiert.
-
Die Behandlung des Mammakarzinoms sollte in einem interprofessionellen Team erfolgen.
Das operative Management
Im Zentrum der kurativen Therapie steht die Operation mit dem Ziel der Exstirpation des Tumors mit einem tumorfreien Resektionsrand (R0). Heutzutage wird eine brusterhaltende Therapie mit anschliessender Radiotherapie angestrebt, oft als onkoplastisches Operationsverfahren. Falls dies nicht möglich oder von der Patientin nicht gewünscht ist, ist die Mastektomie prognostisch gleichwertig. Weiterentwicklungen der chirurgischen Techniken wie die Skin-Sparing- oder Nipple-Sparing-Mastektomie verbessern das kosmetische Ergebnis und die Akzeptanz seitens der Patientin. Eine weitere operative Aufgabe ist die Evaluation der axillären Lymphknoten.2 Dieser erste Abschnitt gibt einen Überblick über das operative Management.
Das Sentinelverfahren
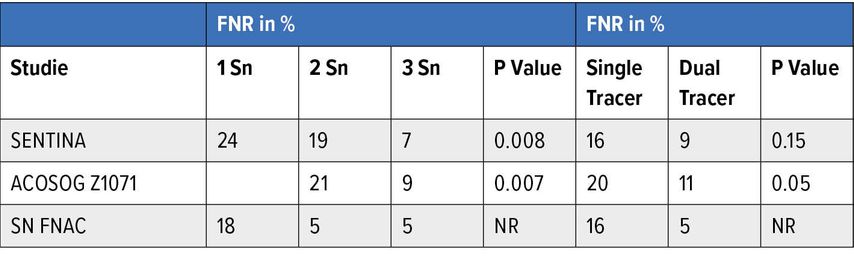
Das Sentinelverfahren ist eine seit vielen Jahren etablierte Operationsmethode und führte zu einer Deeskalation in der Axillachirurgie. Beim frühen Mammakarzinom cT1,2 cN0 wird standardmässig eine Sentinellymphknotenbiopsie durchgeführt. Zeigt sich der Sentinellymphknoten als tumorfrei, sind keine weiteren Therapien axillär erforderlich. Bei 1–2 positiven Lymphknoten im Rahmen einer brusterhaltenden Therapie erfolgt im Anschluss eine zusätzliche Radiotherapie der Lymphabflusswege.3–5 Bei präoperativem Verdacht auf eine axilläre Lymphknotenmetastase sollte dieser Lymphknoten vor einer neoadjuvanten Chemotherapie stanzbioptisch gesichert und markiert werden, sodass er bei der späteren Operation wiedergefunden werden kann. Kommt es durch die neoadjuvante Chemotherapie zu einer Konversion cN1→cN0, ist auch hier eine Sentinellymphknotenbiopsie indiziert. Zu beachten ist dann, dass die Sentinelmarkierung präoperativ mit zwei Substanzen erfolgen soll (z.B. mit Technetium und Patentblau) und mindestens 3 Lymphknoten entfernt werden sollten. Dadurch lässt sich die Falsch-negativ-Rate (FNR) deutlich senken (Tab. 1).6 Zusätzlich soll der ehemals positive markierte Lymphknoten im Rahmen einer sogenannten «targeted axillary dissection» ebenfalls mitentfernt werden. Sind alle entnommenen Lymphknoten tumorfrei, ist auch hier keine weitere axilläre Behandlung nötig.7–10
Tab. 1: Falsch-negativ-Raten (FNR) je nach Sentinellymphknotenanzahl (Sn) und der Tracer-Methode (Single vs. Dual Tracer) in 3 Studien; NR = not rated (adaptiert nach Pilewskie et al.)6
Trotz der zunehmenden Deeskalation im Bereich der axillären Chirurgie bestehen auch weiterhin Indikationen für eine Axilladissektion. Diese sind:
-
Positive axilläre Lymphknoten – entweder klinisch oder bildgebend; Einschluss in die TAXIS-Studie möglich (GBG 101, www.gbg.de )
-
Keine adjuvante Radiotherapie möglich, Patientinnen mit Mastektomie ohne Radiotherapie, grosse Tumoren T3/4 (nicht den Z0011-Kriterien entsprechend)
-
≥3 positive Sentinellymphknoten mit Makromestastasen (>2mm)
-
cN1→ycN1 mit Makrometastasen (>2mm)
Bei Makrometastasen nach Chemotherapie ist eine Axilladissektion absolut indiziert. Bei Mikrometastasen oder isolierten Tumorzellen kann im Einzelfall ggf. die Axilladissektion durch eine Radiotherapie ersetzt werden, gemäss dem Consensus der 17th St. Gallen International Breast Cancer Conference 2021.
In der Zukunft wird sicher eine weitere Deeskalation der Axillachirurgie verfolgt. Vielleicht ist nach neoadjuvanter Chemotherapie bei pathologischer Komplettremission des Brusttumors und cN0 keine Sentinellymphknotenbiopsie mehr notwendig. Möglicherweise ist bei einer gesicherten Lymphknotenmetastase auch eine gezielte Exzision derselben ausreichend. Es stellt sich insgesamt die Frage, ob der diagnostische Wert des Sentinellymphknotens in Zukunft relevant bleiben wird.
Brusterhaltung vs. Mastektomie
Über die letzten Jahrzehnte hat sich die Brustchirurgie weg von der Mastektomie hin zur Brusterhaltung entwickelt.
Dazu beigetragen hat die zunehmende Reduktion des erforderlichen Resektionsrandes. Bei der Tumorchirurgie werden tumorfreie Resektionsränder gefordert, aber «no ink on tumor» ist mittlerweile ausreichend. Dies konnte eine Metaanalyse im Rahmen des SSO-ASTRO Consensus 2014 belegen: ein freier Schnittrand («no ink on tumor») minimiert das Lokalrezidiv-Risiko, ein breiterer Schnittrand senkt das Risiko nicht signifikant. Somit können unnötig grosse Eingriffe und auch Nachresektionen vermieden werden.11
Eine sekundäre Nachresektion ist erforderlich, wenn der invasive Tumorausläufer bis in den Resektionsrand (Paraffinrand) reicht. Um eine vollständige Resektion intraoperativ zu überprüfen, bietet sich eine Präparate-Radiografie oder -Sonografie an.12 Vor einer geplanten neoadjuvanten Chemotherapie ist es wichtig, dass der Tumor frühzeitig markiert wird. Nach der Chemotherapie darf in den neuen Tumorgrenzen operiert werden, mit gleichsam freien Resektionsrändern.12
Ausserdem zeigte sich, dass die brusterhaltende Therapie (Tumorektomie mit Radiotherapie) eine äquivalente Überlebensrate im Vergleich zur Mastektomie aufweist.12 Dennoch gibt es auch weiterhin Gründe, die eine Mastektomie erforderlich machen:13
-
Inkomplette Entfernung des Tumors (inklusive intraduktaler Komponente), auch nach Nachresektionen
-
Inflammatorisches Mammakarzinom (i.d.R. auch bei pathologischer Komplettremission)
-
Kontraindikationen zur Nachbestrahlung nach brusterhaltender Therapie bei absoluter Indikation zur Bestrahlung
-
Wunsch der aufgeklärten Patientin
Neu ist, dass Multizentrizität keine absolute Indikation für eine Mastektomie mehr ist. Der Brusterhalt ist möglich, Voraussetzung ist aber die R0-Resektion aller Herde.12
Präoperativ soll sowohl über die Möglichkeiten der Brusterhaltung, ggf. mit onkoplastischer Rekonstruktion, als auch über die Option einer Mastektomie mit sofortiger oder späterer Brustrekonstruktion aufgeklärt werden. Unter Berücksichtigung von tumorfreien Resektionsrändern kann die Mastektomie aber auch hautsparend mit oder ohne Erhalt des Nippel-Areola-Komplexes durchgeführt werden.13 Wird eine Mastektomie geplant, weist die Skin-/Nipple-Sparing-Mastektomie gegenüber der konventionellen Mastektomie Vorteile auf: Mastektomie und Rekonstruktion erfolgen in einem, Haut und gegebenenfalls Mamille können erhalten werden, und es entstehen weniger störende Narben an der Brust. Aber ist diese Operationsmethode onkologisch auch genauso sicher? Und wie sieht es mit der Lebensqualität aus?
Der Vergleich zwischen der Skin-Sparing- und der konventionellen Mastektomie zeigt keinen signifikanten Unterschied bei der Lokalrezidivrate, der Fernmetastasenrate und den Komplikationen.14 Der Vergleich der Nipple-Sparing- mit der konventionellen Mastektomie weist ebenfalls keinen signifikanten Unterschied beim Gesamtübereben, beim erkrankungsfreien Überleben und in der Lokalrezidivrate nach.15 In der Gesamt- und Brustzufriedenheit besteht auch kein signifikanter Unterschied. Dafür fällt die Beurteilung des psychosozialen und sexuellen Wohlbefindens aber doch zugunsten der Nipple-Sparing-Mastektomie aus.16
Onkoplastische Operationsmethoden
Onkoplastische Operationsmethoden führten – analog zum Sentinelverfahren in der Axillachirurgie – zu einer weiteren Deeskalation in der Brustchirurgie.
Vorteile gegenüber der konventionellen Technik:17
-
Grössere Tumoren können brusterhaltend operiert werden
-
Reduktion der Mastektomierate
-
Reduktion der Nachresektionsrate, da im Vergleich zur reinen Tumorektomie mehr Volumen reduziert wird
-
Bessere ästhetische Resultate steigern die Zufriedenheit und Lebensqualität der Patientinnen
Mögliche Nachteile der onkoplastischen Chirurgie sind:18
-
Grösserer chirurgischer Eingriff mit längerer Erholungsdauer
-
Häufiger Komplikationen wie Wundinfektionen, Wundheilungsstörungen, Hautnekrosen, Serome und Nachblutungen
Die onkologische Sicherheit entspricht der der konventionellen Brustchirurgie. Die Rezidivraten sowohl in der Brust als auch in der Achselhöhle sind gleich, und auch die Überlebensraten (Gesamtüberleben, rezidivfreies Überleben, krankheitsfreies Überleben) unterscheiden sich nicht.19
Zu einer weiteren Deeskalation könnte in Zukunft der komplette Verzicht auf eine Operation nach neoadjuvanter Chemotherapie und vakuumbioptisch gesicherter pathologischer Komplettremission des Brusttumors führen.
Systemtherapie
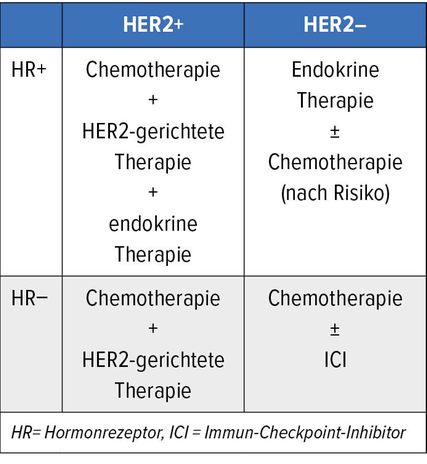
Tab. 2: Wichtigste Schritte der systemischen Behandlung für die unterschiedlichen Subtypen des Mammakarzinoms
Seit der Etablierung der Chemotherapie beim frühen Mammakarzinom in den 1970er- und 1980er-Jahren hat sich die Prognose deutlich verbessert. Mit der Einführung der CMF-Chemotherapie haben vor allem Patientinnen mit High-Risk-Tumoren (hohe Anzahl an betroffenen lokoregionären Lymphknoten) deutlich profitiert.20 Im heutigen Chemotherapie-Setting mit verfügbaren Drittgenerations-Regimen geht es vor allem auch um die Frage der Deeskalation der Chemotherapie im Bereich der HER2-positiven Mammakarzinome und luminalen Mammakarzinome. Beim tripel-negativen Mammakarzinom (TNBC) ist und bleibt die anthrazyklin- und taxanhaltige Chemotherapie der Standard. Dabei bietet der neoadjuvante Ansatz der Therapie deutliche Vorteile bzgl. Operabilität und Prognosemanagement, auch besteht ein Zeitvorteil bezüglich der Biomarkerbestimmungen und der genetischen Beratung und der damit verbundenen Radikalität der Operation. Der folgende zweite Abschnitt und Tabelle 2 geben einen Überblick über die Subtypen-abhängige Therapie des Mammakarzinoms.
Systemische Behandlung des frühen Mammakarzinoms nach Subgruppe
Luminales (Hormonrezeptor-positives) Mammakarzinom
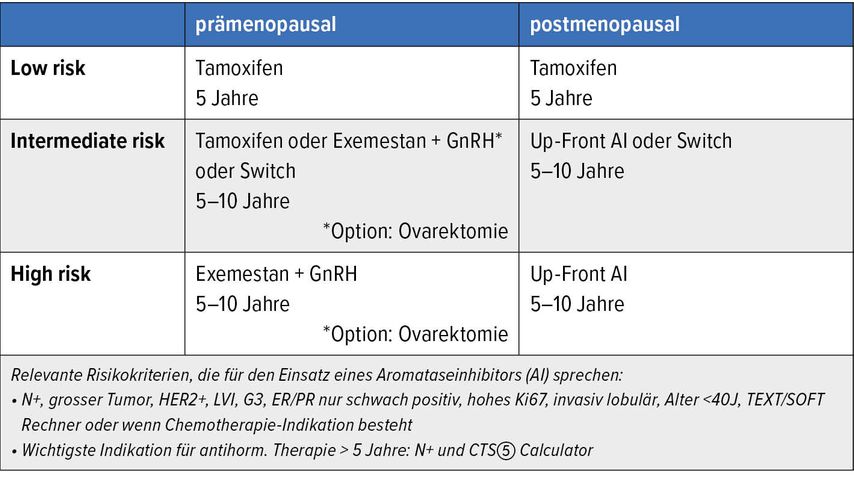
Das frühe luminale Mammakarzinom wird in der Regel mit einer antihormonellen Therapie über fünf Jahre behandelt. Standard bei der postmenopausalen Patientin sind die Aromatasehemmer. Aromatasehemmer blockieren die Östrogensynthese im peripheren Gewebe wie Fettgewebe, Nebenniere, Leber und Muskulatur und haben gegenüber den klassischen SERM (Tamoxifen) einen Benefit bezüglich einerRezidivrisiko-Reduktion von rund 3%.21 Tamoxifen wiederum hat eine Risikoreduktion von rund 30–40% gezeigt und auch eine Reduktion der Sterblichkeit durch das Mammakarzinom.22 Bei Patientinnen mit einem erhöhten Risiko, wie z.B. bei nodal-positivem Mammakarzinom, wird die Therapie über 10 Jahre gegeben. Der wichtigste Entscheidungsfaktor ist der Befall der Lymphknoten. Das klinische Risiko kann mit dem CTS5-Calculator® abgeschätzt werden (Tab. 3).23 Mittlerweile sind zahlreiche Studien publiziert worden, die anhand genetischer Signaturen wie OncotypeDX®, MammaPrint®, BreastCancerIndex® und anderer die Prädikation wie auch die Prognose abschätzen.24
Für prämenopausale Patientinnen mit Niedrigrisikotumoren wird normalerweise fünf Jahre Tamoxifen empfohlen. Für Patientinnen mit Hochrisikotumoren, einem Alter unter 40 Jahren und Chemotherapie-Indikation wird die Behandlung mit einem GnRH-Analogon (alternativ Ovarektomie beidseits) und Aromatasehemmer empfohlen, basierend auf den Daten der SOFT/TEXT-Studie.25
Beim luminalen Mammakarzinom ist in der Regel immer eine endokrine Therapie indiziert, nur bei sehr kleinen Tumoren (<5mm) mit niedrigem Grading (G1) oder bei Patientinnen mit sehr kurzer Lebenserwartung kann auf die Therapie auch verzichtet werden. Was die Chemotherapie betrifft, so erhalten rund 25% aller Patientinnen mit einem luminalen Tumor eine taxan- und/oder anthrazyklinbasierte Chemotherapie. Nach dem aktuellen St. Gallen Consensus kann die Therapieentscheidung anhand histologischer und anatomischer Kriterien gefällt werden: ER/PR-Status, Ki67, Grading, Tumorgrösse, Anzahl der Lymphknoten und andere Kriterien.26 Seit einigen Jahren kann anhand prognostischer Signaturen eine Einschätzung des Chemotherapiebenefits präziser getroffen werden als durch eine alleinige Abschätzung der histologischen/klinischen Faktoren.24 Der wichtigste Faktor bleibt der Wunsch der Patientin nach Aufklärung. Es sollen auch immer das Alter, die Lebenserwartung und die Komorbiditäten berücksichtigt werden. Ein geriatrisches Screening und dann Assessment scheinen hier sinnvoll zu sein, vor allem bei betagten und fragilen Patientinnen.
Tripel-negatives Mammakarzinom
Das TNBC ist gekennzeichnet durch das Fehlen der ER-/PR-/HER2-Marker sowie einen aggressiven Verlauf. Es ist zudem häufiger mit Mutationen für das BRCA1- oder BRCA2-Gen assoziiert. Bis zu 20% der Patientinnen mit einem TNBC haben eine BRCA1/2-Mutation oder auch andere Mutationen im Bereich der anderen Reparatur-Gene.27 In der Regel sollten alle Patientinnen mit einem TNBC in der genetischen Sprechstunde vorgestellt werden. Molekulargenetisch kann man sechs Subtypen des TNBC unterscheiden: basal-like 1 (BL1), basal-like 2 (BL2), mesenchymal (M), mesenchymal stem-like (MSL), immunomodulatory (IM), luminal androgen receptor (LAR) und unspezifische Tumoren (UNS).28 Zurzeit werden im adjuvanten Setting alle Tumoren noch gleich behandelt. Standard ist hier die neoadjuvante Chemotherapie, welche in der Regel Anthrazykline und Taxane beinhaltet. Poly-Chemotherapien mit platinhaltigen Regimen werden vor allem bei Patientinnen mit einer BRCA-Mutation empfohlen. Nach Durchführen der Chemotherapie besteht normalerweise eine gute Prognose mit einer Langzeitüberlebensrate um 90%, wenn eine komplette pathologische Remission (pCR) erreicht werden kann.29 Für Patientinnen mit einer nicht kompletten pathologischen Remission sollte eine Therapie mit Capecitabin für sechs Monate erfolgen, basierend auf dem CreatX-Trial und einer Metaanalyse.30
Neuere Studien untersuchen die Rolle der Immun-Checkpoint-Inhibitoren (ImPassion031, KEYNOTE-522, GeparNuevo [GBG 89]).13 Bei diesen Studien konnte vor allem gezeigt werden, dass die pCR-Rate um 10–15 Prozentpunkte gesteigert werden konnte. In der GBG-89-Studie konnte am Jahreskongress der American Society of Clinical Oncology (ASCO) 2021 auch erstmals ein besseres Outcome beim ereignisfreien Überleben und beim Gesamtüberleben (OS) gezeigt werden.
Bei Patientinnen mit einer BRCA-Mutation und einem Hochrisiko-TNBC (non-pCR) kann seit dem ASCO-Kongress 2021 eine adjuvante einjährige Behandlung mit Olaparib empfohlen werden. Olaparib ist ein PARP-Inhibitor, der seit vielen Jahren beim Ovarialkarzinom eingesetzt wird. In der OlympiA-Studie wurden vor allem Patientinnen mit Karzinomen mit High-Risk-Merkmalen wie einer non-pCR (für luminale Mammakarzinome) und befallenen axillären Lymphknoten eingeschlossen. Die Rate des krankheitsfreien Überlebens (DFS) nach drei Jahren lag in der Olaparib-Gruppe bei 85,9% und in der Placebogruppe bei 77,1% (HR: 0,58; 95% CI: 0,41–0,82; p<0,0001).34 Alle Patientinnen mit Hochrisiko-Tumoren und einer Keimbahnmutation für BRCA sollten diese neue Therapie erhalten.
HER2-positives Mammakarzinom
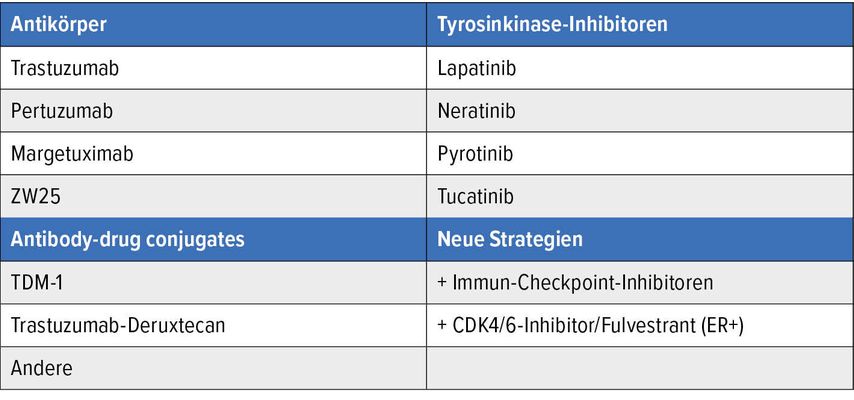
Mit dem HER2-positiven Mammakarzinom war sehr lange eine schlechtere Prognose mit häufigen Rezidiven verbunden. Dies traf vor allem auf die Ära vor der HER2-gerichteten Therapie zu. Seit der Einführung von Trastuzumab im palliativen sowie im frühen Therapiesetting hat sich die Prognose deutlich verbessert. Zwischenzeitlich sind mehrere neue Medikamente dazu gekommen: Pertuzumab, Lapatinib, Tucatinib, Pyrotinib, Trastuzumab-Emtansin, Trastuzumab-Deruxtecan und andere (Tab. 4). Die Behandlung erfolgt beim frühen Mammakarzinom in der Regel mit einem taxan-/platinbasierten Regime und einer dualen HER2-Blockade mit Trastuzumab und Pertuzumab.35 Nach Abschluss der Chemotherapie erfolgt die Operation. Bei komplettem Ansprechen wird die Trastuzumab-Therapie auf ein Jahr vervollständigt. Bei einem unvollständigen Ansprechen wird nach den Daten der KATHERINE-Studie 14x Trastuzumab-Emtansin (TDM-1) appliziert.36 Die Studie zeigte ein deutlich besseres Outcome (DFS/OS) bei guter Verträglichkeit und handhabbaren Nebenwirkungen, wie Knochenmarkstoxizität, gastrointestinaler Toxizität und Polyneuropathie. Hormonrezeptor-positive, HER2-positive Tumoren sollten zusätzlich nach den Empfehlungen bei luminalem Brustkrebs behandelt werden.
Palliative Behandlung des Mammakarzinoms
Leider kommt es trotz optimaler Therapie bei rund 15–20% der Patientinnen mit Mammakarzinom zu einem Rezidiv mit Metastasen. Risikofaktoren hierfür sind ein fortgeschrittenes anatomisches Stadium, das Grading, ein hoher Recurrence-Score der genetischen Signatur, die Biologie des Tumors und weitere Faktoren. Bezüglich des Follow-ups und der Detektion von Metastasen gibt es keine bildgebenden oder laborchemischen Standards oder Empfehlungen. Ältere Studien aus den 1980er- und 1990er-Jahren haben randomisiert untersucht, ob ein intensives Follow-up mit Bildgebung wie Knochenszintigrafie und Thoraxröntgen oder auch mit Tumormarkerbestimmung einen Überlebensvorteil bringt. Diese Studien waren allesamt negativ, sodass sich nach den aktuellen Guidelines (ESMO, NCCN, St. Gallen) ein rein symptomorientiertes Follow-up etabliert hat. Ob neue Technologien wie ctDNA, Immunsystem-Messungen, Messung der zirkulierenden Tumorzellen oder neue Imaging-Methoden die Prognose verbessern, wird in klinischen Studien untersucht.
Kommt es zu einer Metastasierung, sollte in der Regel eine Re-Biopsie erfolgen, da es zu einer Rezeptorkonversion kommen kann.37 In den meisten Fällen verliert der Tumor bzw. die Metastase die ER-/PR-Expression und HER2-Expression. Dann sollte, wann immer möglich, auch ein Next-Generation Sequencing (NGS) mit einem Cancer-Panel erfolgen, da es mittlerweile einige zielgerichtete Optionen beim Mammakarzinom gibt. Die wichtigsten prädiktiven Faktoren bleiben ER/PR und HER2. Neue Faktoren umfassen PIK3CA-Mutationen, ESR1-Mutationen, BRCA-Mutationen, PALB-B2-Mutationen, AKT-Mutationen und Instabilität in den Mikrosatelliten (MSI).38
Bei den metastasierten luminalen Mammakarzinomen ist der 1st- und 2nd-Line- Standard die Behandlung mit einer endokrinen Therapie (Aromatasehemmer oder Fulvestrant) in Kombination mit einem Zellzyklus-Inhibitor (CDK4/6-Inhibitor: Abemaciclib, Palbociclib oder Ribociclib).39 Die Folgetherapien können dann ebenfalls Kombinationen mit endokriner Therapie und PIK3CA-Inhibitoren, AKT-Inhibitoren oder mTOR-Inhibitoren sein. Nach 2–3 Linien muss in der Regel bei endokriner Resistenz auf eine Chemotherapie umgestellt werden.
Für das TNBC wird für die 1st Line eine Analyse auf den PD-L1-Status empfohlen, da hier eine Kombination auf Nab-Paclitaxel und Atezolizumab bei PD-L1 positiven Tumoren mit einer deutlichen Verlängerung des Gesamtüberlebens gegenüber der alleinigen Chemotherapie einhergeht.40 Bei Patientinnen mit BRCA-Mutationen können eine Later-Line-Therapie oder eine Maintenance-Therapie mit den PARP-Inhibitoren Olaparib oder Talazoparib erfolgen.41,42 Chemotherapeutisch werden Substanzen wie Carboplatin, Gemcitabin, Navelbin, Taxane, pegyliertes Doxorubicin, Eribulin, Capecitabin und andere eingesetzt. Ein neues Medikament ist das «antibody-drug conjugate» (ADC) Sacituzumab-Govitecan.43 Es ist ein neues Medikament mit einem Antikörper gegen Trop-2, ein auf TNBC hoch exprimiertes Antigen, einem Linker und dem SN38, einem aktiven Metaboliten von Irinotecan. Das Medikament zeigte gegenüber Standardchemotherapien in der 2nd oder 3rd Line eine Verdopplung des Überlebens in dieser doch schwierigen und refraktären Behandlungssituation. Die Verträglichkeit war durch Diarrhö und Knochenmarkstoxizität inklusive febriler Neutropenie eingeschränkt.
Für das HER2-positive metastasierte Mammakarzinom gibt es heute eine breite Palette an Behandlungsoptionen. In der ersten Behandlungslinie erhalten die Patientinnen nach dem CLEOPATRA-Schema eine taxanhaltige Chemotherapie mit der dualen Blockade gegen HER2 mit Trastuzumab und Pertuzumab.44 Damit konnte eine deutliche Prognoseverbesserung erreicht werden, sodass viele Patientinnen heute deutlich länger als fünf Jahre die metastasierte Erkrankung überleben. Die grössten Neuerungen in den letzten Jahren gab es bei den ADC, z.B. TDM-145 oder Trastuzumab-Deruxtecan46, und bei den Tyrosinkinase-Inhibitoren, z.B. Lapatinib, Neratinib, Pyrotinib und Tucatinib. Tabelle 4 gibt einen Überblick über die wichtigsten Substanzen.
Tab. 4: Wichtigste Substanzen im Bereich des HER2-positiven Mammakarzinoms, die bereits im klinischen Einsatz sind bzw. sich in Zulassung oder in klinischer Erprobung befinden
Supportive Therapien –Knochengesundheit
Neben der rein systemischen Chemotherapie, zielgerichteter Therapie und Immuntherapie spielen auch die ossär gerichteten Therapien im adjuvanten wie palliativen Therapiesetting eine wichtige Rolle. Die Knochengesundheit und Vermeidung von «skelettal related events» (SRE) steht dabei im Vordergrund. Bei postmenopausalen Patientinnen konnte eine Bisphosphonatherapie auch einen adjuvanten Nutzen bezüglich des Rezidivrisiko durch das Mammakarzinom aufweisen.47 Denosumab kann im palliativen Setting SRE effektiver vermeiden als Bisphosphonate und ist daher ein Standardmedikament bei Patientinnen zur Behandlung von Knochenmetastasen.48
Fazit
Die Behandlung des Mammakarzinoms erfolgt operativ, systemtherapeutisch und radioonkologisch. Die besten Behandlungserfolge sind durch ein multidisziplinäres Team zu verzeichnen. Diesem gehören an: Radioonkologie, Radiologie inkl. spezialisierter Brustradiologie, Genetik, Pathologie, molekulare Therapie, Brustchirurgie, Gynäkologie, gynäkologische Onkologie, medizinische Onkologie, Palliativmedizin, Breast Care Nurse, Physiotherapie, Ernährungsberatung, Psychoonkologie, klinische Pharmakologie und Seelsorge. Nur durch eine gute Zusammenarbeit dieser Disziplinen kann das bestmögliche Ergebnis für die Patientinnen erzielt werden.
Literatur:
1 Brucker SY et al.: Interdisziplinäre Behandlung von Mammakarzinomen: Das Brustzentrum der Zukunft. Dtsch Arztebl 2016; 113(37): A 1590-3 2 Onkopedia Guidelines Mammakarzinom. Online unter: https://www.onkopedia.com/de/onkopedia/guidelines/mammakarzinom-der-frau/@@guideline/html/index.html 3 Krag DN et al.: Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010; 11(10): 927-33 4 Guliano AE et al.: Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis. The ACOSOG Z0011 (Alliance) randomized clinical trial. JAMA 2017; 318(10): 918-26 5 Donker M et al.: Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): arandomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014. 15(12): 1303-10 6 Pilewskie M et al.: Axillary nodal management following neoadjuvant chemotherapy. Areview. JAMA 2017; 3(4): 549-55 7 Boughey JC et al.: Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer The ACOSOG Z1071 (Alliance) Clinical Trial. JAMA 2013; 310(14): 1455-61 8 Kühn T et al.: Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort. Lancet Oncol 2013; 14(7) 609-18 9 Donker M et al.: Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure. Ann Surg 2015; 261(2): 378-82 10 Caudle AS et al.: Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: implementation of targeted axillary dissection. J Clin Oncol 2016; 34(10): 1072-8 11 Moran S et al.: SSO-ASTRO Consensus Guideline on margins for breast-conserving surgery with whole breast irradiation in stage I and II invasive breast cancer. Int J Radiat Oncol Biol Phys 2014; 88(3): 533-64 12 AGO e.V.: Guidline Breast Version 2021.1D. Online unter: https://www.ago-online.de/en/leitlinien-empfehlungen/leitlinien-empfehlungen/kommission-mamma 13 Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms, Kurzversion 4.2 – Februar 2020. Online unter: https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/ Mammakarzinom_4_0/Version_4.3/LL_Mammakarzinom_Kurzversion_ 4.2pdf 14 Lanitis S et al.: Comparison of skin-sparing mastectomy versus non-skin-sparing mastectomy for breast cancer: a meta-analysis of observational studies. Ann Surg 2010; 251(4): 632-9 15 De La Cruz L et al.: Overall survival, disease-free survival, local recurrence and nipple-areolar recurrence in the setting of nipple-sparing mastectomy: a meta-analysis and systematic review. Ann Surg Oncol 2015; 22(10): 3241-9 16 Romanoff A et al.: A comparison of patient-reported outcomes after nipple-sparing mastectomy and conventional mastectomy with reconstruction. Ann Surg Oncol 2018; 25(10): 2909-16 17 Weber WP: Aktuelle Standards in der onkoplastischen Brustchirurgie. Leading Opinions Hämatologie & Onlokogie 2017. Online unter: https://www.universimed.com/ch/article/onkologie/aktuelle-standards-in-der-onkoplastischen-brustchirurgie-2123045#! 18 Haloua MH et al.: A systematic review of oncoplastic breast-conserving surgery: current weaknesses and future prospects. Ann Surg 2013; 257(4): 609-20 19 De La Cruz et al.: Outcomes after oncoplastic breast-conserving surgery in breast cancer patients: a systematic literature review. Ann Surg Oncol 2016; 23(10): 3247-58 20 Bonadonna G et al.: Combination chemotherapy as an adjuvant treatment in operable breast cancer. N Engl J Med 1976; 294: 405-10 21 Early Breast Cancer Trialists‘ Collaborative Group (EBCTCG): Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015; 386(10001): 1341-52 22 Early Breast Cancer Trialists‘ Collaborative Group (EBCTCG): Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 365(9472): 1687-717 23 Cts5-Calculator. Online unter: https://cts5-calculator.com/ 24 Vallon-Christersson J et al.: Cross comparison and prognostic assessment of breast cancer multigene signatures in a large population-based contemporary clinical series. Sci Rep 2019; 9: 12184 25 Francis PA et al.: Tailoring adjuvant endocrine therapy for premenopausal breast cancer. N Engl J Med 2018; 379: 122-37 26 Thomssen C et al.: St. Gallen/Vienna 2021: Abrief summary of the consensus discussion on customizing therapies for women with early breast cancer. Breast Care 2021; 16: 135-43 27 Foulkes WD et al.: Triple-negative breast cancer. N Engl J Med 2010; 363: 1938-48 28 Lehmann BD et al.: Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies. J Clin Invest. 2011; 121(7): 2750-67 29 Spring LM et al.: Pathologic complete response after neoadjuvant chemotherapy and impact on breast cancer recurrence and survival: a comprehensive meta-analysis. Clin Cancer Res 2020; 26(12): 2838-48 30 Masuda N et al.: Adjuvant capecitabine for breast cancer after preoperative chemotherapy. N Engl J Med 2017; 376(22): 2147-59 31 Mittendorf EA et al.: Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (IMpassion031): a randomised, double-blind, phase 3 trial. Lancet 2020; 396(10257): 1090-100 32 Schmid P et al.: KEYNOTE-522 investigators: pembrolizumab for early triple-negative breast cancer. N Engl J Med 2020; 382(9): 810-21 33 Loibl S et al.: A randomised phase II study investigating durvalumab in addition to an anthracycline taxane-based neoadjuvant therapy in early triple-negative breast cancer: clinical results and biomarker analysis of GeparNuevo study. Ann Oncol 2019; 30(8): 1279-88 34 Tutt ANJ et al.: OlympiA clinical trial steering committee and investigators: adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. NEngl J Med 2021; 384(25): 2394-405 35 Gianni L et al.: 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): amulticentre, open-label, phase 2 randomised trial. Lancet Oncol 2016; 17(6): 791-800 36 von Minckwitz G eta al.: KATHERINE Investigators: Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019; 380(7): 617-28 37 Schrijver WAME et al.: Receptor conversion in distant breast cancer metastases: a systematic review and meta-analysis. J Natl Cancer Inst 2018; 110(6): 568-80 38 van Geelen CT et al.: Clinical implications of prospective genomic profiling of metastatic breast cancer patients. Breast Cancer Res 2020; 22(1): 91 39 Schettini F et al.: Overall survival of CDK4/6-inhibitor-based treatments in clinically relevant subgroups of metastatic breast cancer: systematic review and meta-analysis. J Natl Cancer Inst 2020; 112(11): 1089-97 40 Schmid P et al.: IMpassion130 Trial Investigators: Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med 2018; 379(22): 2108-21 41 Robson M et al.: Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med 2017; 377(6): 523-33 42 Litton JK et al.: Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. NEngl J Med 2018; 379(8): 753-63 43 Bardia A et al.: Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer. N Engl J Med 2019; 380(8): 741-51 44 Swain SM et al.: Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2013; 14(6): 461-71 45 Verma S et al.: EMILIA Study Group: Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367(19): 1783-91 46 Modi S et al.: DESTINY-Breast01 investigators: trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7): 610-21 47 Early Breast Cancer Trialists‘ Collaborative Group (EBCTCG): Adjuvant bisphosphonate treatment in early breast cancer: meta-analyses of individual patient data from randomised trials. Lancet 2015; 386(10001): 1353-61 48 Stopeck AT et al.: Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: arandomized, double-blind study. J Clin Oncol 2010; 28(35): 5132-9
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...