Möglichkeiten und Limitationen der modernen Radioonkologie
Autorin:
Prim. Dr. Andrea Reim
Zentrum für Radioonkologie und Strahlentherapie
Klinik Donaustadt, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Radioonkologie hat sich im letzten Jahrzehnt deutlich gewandelt, von (unpräzisen) Einzel- oder Mehrfeldbestrahlungen zur Hochpräzisionsradiotherapie. Wo früher vor allem die zu applizierende Einzel- und Gesamtherddosis im Vordergrund standen, spielen heute auch die genaue Zielgebietsdefinition, die angewandte Bestrahlungstechnik sowie das verwendete Equipment eine maßgebliche Rolle.
Keypoints
-
Neue Bestrahlungstechniken (VMAT, dCAT, DIBH) minimieren die Bestrahlungsdosis an den Risikoorganen und senken wahrscheinlich die Nebenwirkungs- sowie die Zweitkarzinomrate deutlich.
-
Das für die Bestrahlung verwendete Equipment und die Bestrahlungstechnik spielen eine entscheidende Rolle beim Behandlungserfolg.Neben der Gesamtherddosis sollte auch die Bestrahlungstechnik bei Studien berücksichtigt bzw. angegeben werden.
-
Bestrahlungspläne sollten bezüglich der Durchführbarkeit und der technischen Möglichkeiten immer im Team von Ärzten, Medizinphysikern und MTDs besprochen werden.
In den aktuellen Guidelines des National Comprehensive Cancer Network (NCCN; Stand März 2021) findet sich in den Prinzipien für die Radiotherapie (RT) von Lymphomen folgende Information: „Advanced RT technologies such as intensity modulated RT (IMRT)/volumetric modulated arc therapy (VMAT), breath hold or respiratory gating, and/or image-guided RT (IGRT), or proton therapy may offer significant and clinically relevant advantages.“1 Welche gerätetechnischen Voraussetzungen müssen an den radioonkologischen Kliniken vorhanden sein, um diese Techniken anwenden zu können, welche Vorteile im Detail bieten sie, und für welchen Patienten eignet sich welche Technik?
IMRT/VMAT/dCAT
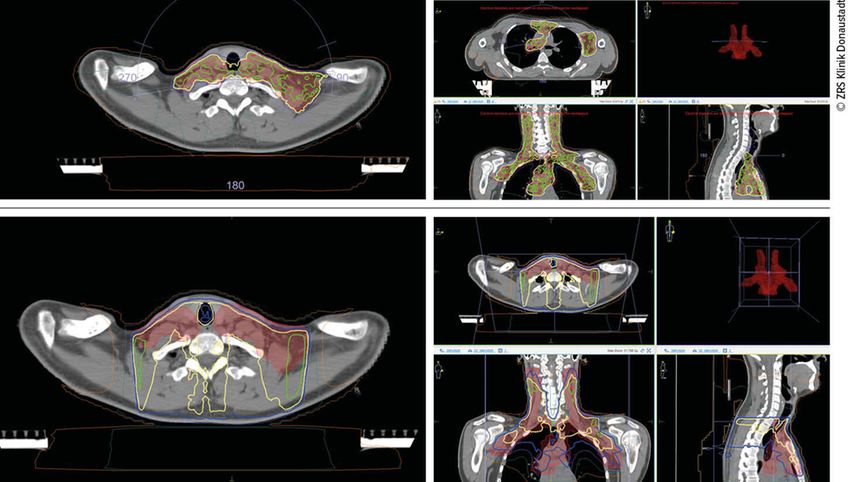
Eine Weiterentwicklung der IMRT ist die volumenmodulierte Strahlentherapie (VMAT). Bei dieser Bestrahlungstechnik rotiert der Strahlerkopf des Linearbeschleunigers während des Bestrahlens mit variabler Geschwindigkeit rund um den Patienten, gleichzeitig bewegen sich die Bleilamellen zur Feldformierung und die Strahlintensität kann variiert werden. Dadurch kann die Dosis im Zielgebiet gebündelt werden, d.h., die Dosisverteilung passt sich an das zu behandelnde Tumorvolumen an und gesundes Gewebe kann geschont werden. Abbildung 1 stellt die Vergleichspläne einer VMAT und einer „3D conformal“ RT dar.
Diese Art der Bestrahlung ist in den letzten Jahren in den meisten radioonkologischen Instituten etabliert worden und stellt mittlerweile eine Standardtherapie dar. Oft wird von Zuweisern oder Patienten auch explizit nach dieser Technik verlangt. Aber trotz aller Vorteile gibt es Indikationen, die sich nicht für eine VMAT-Bestrahlung eignen. Dies betrifft z.B. bewegliche (atemabhängige) Zielgebiete, hier kann es bei kleinen Feldformierungen und starken Bewegungen des Tumors zu einem „target miss“ – einer Unterdosierung im Zielgebiet – bzw. zu einer Änderung der Dosisverteilung kommen. Deshalb sollte für solche Indikationen eine andere Spezialtechnik, z.B. die dCAT(„dynamic conformal arc therapy“)-Bestrahlungsplanung, angewandt werden. Auch für sehr kleine Zielgebiete (<2cm, z.B. „involved node“ RT bei Lymphomen oder RT kleiner solider Tumoren) gibt es Limitationen, sofern nicht ein Beam-Modell für kleine Felder im Planungssystem hinterlegt ist.
Aufgrund der Komplexität der Auswahl der optimalen Bestrahlungstechnik sollte diese vom Radioonkologen in Rücksprache mit der Medizinphysik des Instituts festgelegt werden. Sie kann nämlich auch bei gleicher Indikation und zu applizierender Dosis aufgrund der technischen Möglichkeiten einer Klinik, der Konstitution des Patienten oder der Lage des Tumors/der Risikoorgane variieren.
Atemtriggerung: DIBH („deep inspiration breath hold“)
Bei Bestrahlungen in der Nähe des Herzens oder im Bereich der Lunge (z.B. mediastinale Bulks bei Lymphomen, linksseitige N. mammae) findet meist eine DIBHTechnik Anwendung. Hier wird während der Planungscomputertomografie auch die Oberfläche des Patienten gescannt und die Untersuchung in einer bestimmten Atemlage (meist tiefes Einatmen) durchgeführt. Mittels eines Feedback-Systems (Raumlicht oder Brille oder Tablet) kann der Patient dahingehend geschult werden, dass er die gleiche Atemlage auch während der Bestrahlung wieder einnimmt. Diese wird dann während der laufenden Therapie online mit dem Oberflächenscanning-System überwacht, und bei Überschreiten der erlaubten Abweichungen erfolgt ein automatischer „beam hold“ (Stopp der Strahlung). Somit können eine Fehlbestrahlung oder auch nur eine geringfügige Abweichung des Bestrahlungsareals verhindert werden.
Limitationen bestehen durch die Compliance der Patienten, manche können trotz intensiver Schulung ein tiefes Einatmen nicht stabil reproduzieren. Hier ist vor allem die Kommunikation mit dem die Bestrahlung durchführenden medizinisch-technischen Dienst (MTD) wichtig, um sich gegebenenfalls frühzeitig für eine andere Bestrahlungstechnik entscheiden zu können.
Mithilfe des Einsatzes einer Atemtriggerung oder DIBH und der dadurch möglichen Reduktion der Sicherheitssäume sowie der exakten Planung mit Minimierung der Dosis an den konturierten Risikoorganen können die in der Literatur beschriebenen Langzeitfolgeschäden, wie Pneumonitis2 und koronare Herzkrankheit3, wahrscheinlich deutlich reduziert werden. Diesbezügliche Langzeitstudien sind aufgrund des erst kurzen klinischen Einsatzes der Systeme aber noch ausständig.
Bildgeführte Strahlentherapie: IGRT („image-guided radiotherapy“)
IGRT bedeutet eine direkt vor oder während der Bestrahlung durchgeführte Lagekontrolle des Tumors oder Zielgebietes durch eine Bildgebung. Hierfür muss der Linearbeschleuniger mit einem zusätzlichen „Cone beam“-Computertomografen (CT) ausgerüstet sein (Abb. 2) oder ein vom Linearbeschleuniger (LINAC) unabhängiges System (kV Röhren) im Raum installiert werden. Es handelt sich nicht um eine Lagekontrolle der Oberfläche des Patienten, wie bei Oberflächenscanning-Systemen, sondern um eine direkte Bildgebung des Tumors oder dort implantierter Goldclip-Marker. Wenn diese zusätzlichen Systeme zur Verfügung stehen, können einerseits die Sicherheitssäume um den Tumor weiter reduziert werden, andererseits können ein Ansprechen des Tumors auf die Behandlung oder andere Änderungen im Zielgebiet (Harnblasen- oder Darmfüllung, Gewichtsabnahme, Pleuraerguss usw.) detektiert werden. Bei klinischer Relevanz können sofortige (tagesaktuelle) Anpassungen, wie z.B. bei Hinterlegung verschiedener Bestrahlungspläne für einen Patienten je Füllungszustand der Harnblase, erfolgen. Oder es kann ein neuer Bestrahlungsplan erstellt werden, wenn eine relevante Gewichts- oder Tumorreduktion beim Patienten entstanden ist. Diese Adaptierungen wurden früher nicht durchgeführt, es wurde der gleiche Bestrahlungsplan vom Anfang bis zum Ende der Therapie verwendet.
Schlussfolgerung
All diese Verbesserungen und Entwicklungen in der modernen Radioonkologie tragen zur Reduktion der Spätnebenwirkungen einer Strahlentherapie und zur Verminderung des Zweitkarzinomrisikos bei. Wie bereits Nimwegen (et al.) 20163 publizierte, besteht eine lineare Beziehung zwischen der Dosis am Herzen und der späteren Entwicklung einer koronaren Herzkrankheit, jedes Gy mehr bedeutet eine Risikoerhöhung um 7%. Auch das Risiko für Zweitmalignome ist dosis- und volumenabhängig.4 Ob in ausgewählten Fällen durch eine Protonen- anstelle der Photonentherapie eine weitere sinnvolle Dosisreduktion an den Risikoorganen ohne Erhöhung des Lokalrezidivrisikos erzielt werden kann, werden zukünftige Studien klären. Erste Planungsvergleichsstudien wurden bereits publiziert.5 Zur Reduktion jedes (unnötigen) Grays an Risikoorganen bei gleicher Abdeckung des Zielgebietes sollten alle gerätetechnischen und planungstechnischen Möglichkeiten sowie alle Strahlenqualitäten ausgeschöpft werden, um im Sinne des ALARA-Prinzips („as low as reasonably achievable“) das Beste für unsere Patienten zu erreichen.
Literatur:
1 NCCN: Guidelines Lymphome. März 2021. Online unter www.nccn.org. Abgerufen am 28. Mai 2021 2 Pinnix CC et al.: Int J Radiat Oncol Biol Phys 2015; 92(1): 175-182 3 van Nimwegen FA et al.: J Clin Oncol 2016; 34(3): 235-43 4 Travis LB et al.: JAMA 2003; 290: 465-75 5 Baues et al.: Radiat Oncol 2018; 13(1): 122
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...