Lutetium177-PSMA-Therapie: Wer, Wann, Wie?
Autor:
Assoc. Prof. Dr. Alexander Haug
Stellvertretender Leiter der Klinischen Abteilung für Nuklearmedizin am Universitätsklinikum AKH Wien
E-Mail: alexander.haug @meduniwien.ac.at
Die Therapie mit Lutetium177-PSMA steht kurz vor der Zulassung für das metastasierte kastrationsrefraktäre Prostatakarzinom. Es handelt sich um eine effektive und relativ nebenwirkungsarme Therapie, eine gute Patientenselektion ist jedoch essenziell für den Therapieerfolg.
Keypoints
-
Bei Patienten mit einem metastasierten kastrationsrefraktären Prostatakarzinom sollte an eine Therapie mit [177Lu]-PSMA gedacht werden.
-
Diese Therapie hat vergleichsweise hohe Ansprechraten bei relativ guter Verträglichkeit.
-
Studien für einen Einsatz im früheren Krankheitsstadium laufen.
Die Mehrzahl der Prostatakarzinome zeichnet sich durch eine sehr hohe Expression von PSMA, einem Enzym an der Zelloberfläche, aus. Diese Eigenschaft wird bereits für die Bildgebung mit der Positronen-Emissions-Tomografie (PET) ausgenutzt, indem ein PSMA-Derivat, das an dieses Enzym bindet, mit einem diagnostischen radioaktiven Strahler markiert wird.
Diese sogenannte [68Ga]-PSMA-PET ist in der Lage, auch kleinste Rezidive zu lokalisieren, und hat zu einem Paradigmenwechsel in der Diagnostik des biochemischen Rezidivs geführt, da auch bei sehr niedrigen PSA-Spiegeln <0,5µg/l in bis zu 50% der Fälle eine Lokalisierung des Rezidivs gelingt.1 Diese spezifische Eigenschaft des Prostatakarzinoms lässt sich jedoch nicht nur diagnostisch, sondern auch therapeutisch ausnutzen.
Das theranostische Prinzip
Anstelle eines diagnostischen Radionuklids (zum Beispiel Gallium68) wird hierzu ein therapeutisches (Lutetium177,[177Lu]) verwendet. Lutetium177 ist ein radioaktives Nuklid, dass Beta-Strahlung emittiert, die im Gewebe eine mittlere Reichweite von ca. 0,3mm aufweist, lokal hohe Strahlendosen erreicht und somit eine sehr präzise zielgerichtete Bestrahlung erlaubt.
Eine Besonderheit dieses theranostischen Prinzips ist, dass bereits vor der Therapie nachgewiesen werden kann, ob die therapeutische Zielstruktur in allen Metastasen ausreichend exprimiert wird. Eine Therapie mit [177Lu]-PSMA ist nur erfolgversprechend, wenn tatsächlich alle Metastasen eine ausreichende Speicherung in der [68Ga]-PSMA-PET aufweisen.
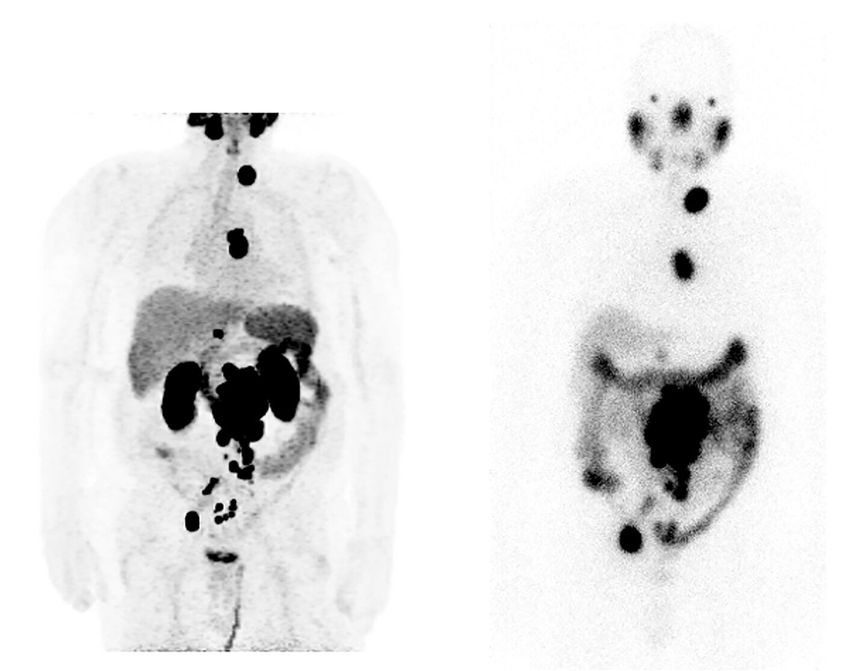
Abb. 1: Auf dem linken Bild ist eine [68Ga]-PSMA-PET eines Patienten mit ausgedehnten nodalen Metastasen eines mCRPC. Auf dem rechten Bild ist ein Post-Therapie-Scan nach einer [177Lu]-PSMA-Therapie zu sehen. Gut zu erkennen ist die Übereinstimmung einer gleich hohen Speicherung in der PET und im Post-Therapie-Scan, was das theranostische Konzept verdeutlicht
Nebenwirkungen und Kontraindikationen
Für diese Radioligandentherapie wird [177Lu]-PSMA intravenös verabreicht und von der Mehrzahl der Patienten akut sehr gut toleriert. Eine ausreichende Hämatopoese muss für diese Therapie aufgrund der möglichen Hämatotoxizität vorausgesetzt werden. Aufgrund von strahlenschutzrechtlichen Erwägungen wird diese Therapie meist stationär auf nuklearmedizinischen Therapiestationen durchgeführt.
Nachdem bereits viele Patienten unter einer Schmerzsymptomatik leiden, kann zur Prävention einer therapiebedingten Exazerbation durch ein Anschwellen der Metastasen durch die Bestrahlung eine begleitende Medikation mit Kortikosteroiden notwendig sein. Ein Großteil des [177Lu]-PSMA wird renal ausgeschieden, was den Ausschluss einer relevanten obstruktiven Harnabflussstörung sinnvoll macht.
Evidenz aus der VISION-Studie
Nachdem bereits mehrere Jahre klinische Erfahrung im Rahmen individueller Heilversuche gesammelt werden konnte, liegen nun Evidenzdaten vor. In der prospektiven, randomisierten Phase-III-Studie VISION mit 831 Patienten mit metastasiertem kastrationsrefraktärem Prostatakarzinom (mCRPC) wurden die Effektivität und die Nebenwirkungsrate dieser Therapie untersucht. Die Patienten wurden mit 7,4GBq [177Lu]-PSMA-617 alle 4 Wochen insgesamt 4- bis 6-mal therapiert, als Kontrollarm diente „best supportive care“.
Das Überleben konnte im Therapiearm signifikant um 4 Monate auf 15,3 Monate verlängert werden, und auch das radiologische progressionsfreie Überleben wurde von 3,4 auf 8,7 Monate verlängert. Als weiterer wichtiger Endpunkt dauerte es signifikant länger bis zum Auftreten eines symptomatischen Knochenevents (11,5 versus 6,8 Monate).
Neben dieser hohen Effektivität zeichnet sich die Radioligandentherapie mit [177Lu]-PSMA durch eine vergleichsweise gute Verträglichkeit aus. Höhergradige Toxizitäten ≥Grad 3 traten bei 53% aller Patienten auf im Vergleich zu 38% im Kontrollarm. Am häufigsten waren dies eine Hämatotoxizität (Anämie 13%, Thrombozytämie 8%, Lymphopenie 8%, Leukopenie 2,5%) und Fatigue (6%). Als typische geringgradige Nebenwirkung trat bei 39% eine Mundtrockenheit auf, die bedingt ist durch die hohe Speicherung von [177Lu]-PSMA in den Speicheldrüsen. Bei 7% musste die Therapie aufgrund der Nebenwirkungen abgebrochen werden und bei 8% zumindest pausiert werden.2
Aufgrund der überzeugenden Ergebnisse wurde die Zulassung von [177Lu]-PSMA-617 beantragt.
Vergleich mit etablierter Therapie
Nachdem die Wirksamkeit bei mCRPC nachgewiesen wurde, stellt sich die Frage nach der Effektivität im Vergleich zu etablierten Therapien. Die prospektive Phase-III-Studie TheraP hat untersucht, wie sich die Effektivität und die Toxizität im Vergleich zu einer Chemotherapie mit Cabazitaxel (20mg/m2 alle 3 Wochen bis zu 10 Zyklen) verhalten.
Das Therapieschema sah deeskalierende Aktivitäten vor: Im ersten Zyklus wurden 8,5GBq [177Lu]-PSMA verabreicht, in jedem der 6 folgenden 0,5GBq weniger, sodass die Aktivität beim 6. Zyklus 6,0GBq betrug. Der primäre Endpunkt PSA-Ansprechen ≥50% wurde mit 66% der Patienten signifikant öfter mit [177Lu]-PSMA erreicht als mit Cabazitaxel mit 37%.
Auch das progressionsfreie Überleben wurde mit einer Hazard-Ratio von 0,63 signifikant verlängert. Neben der höheren Effektivität zeichnete sich die Therapie auch durch eine geringere Rate an höhergradigen Nebenwirkungen aus (33% versus 53%).3
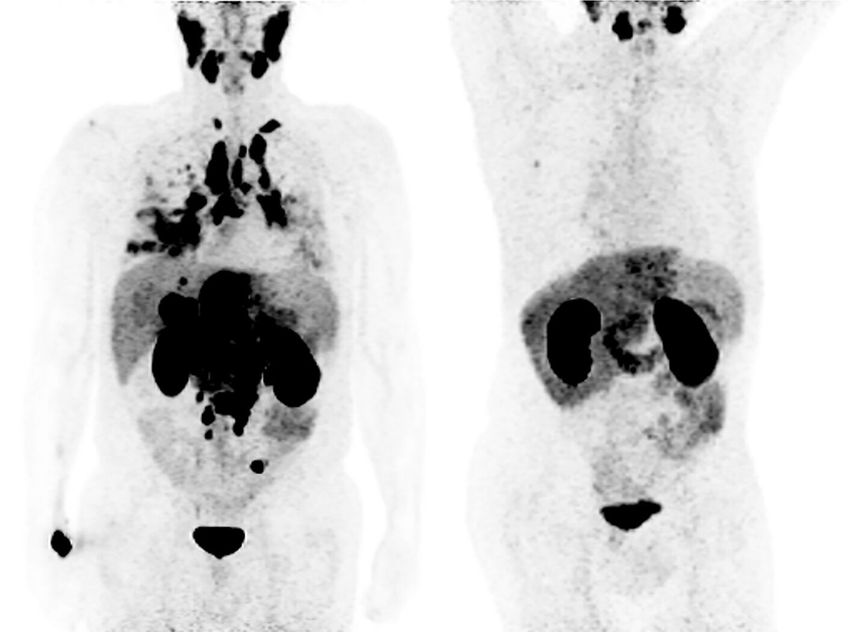
Abb. 2: Beispiel eines Patienten mit Lungen- und Lymphknotenmetastasen eines mCRPC. Nachdem der Patient mit Docetaxel, Cabazitaxel und Enzalutamid behandelt wurde, stellte er sich mit einem PSA von 32ng/ml zur Therapie mit [177Lu]-PSMA vor. Nach einer Therapie mit 6 Zyklen mit je 7,4GBq zeigt sich ein gutes Therapieansprechen mit einem Abfall des PSA auf 0,14ng/ml
Ausblick und Fazit
Aufgrund dieser hohen Effektivität und vergleichsweise guten Verträglichkeit wird die Wirksamkeit der [177Lu]-PSMA-Therapie aktuell in früheren Krankheitsstadien evaluiert. Die PSMAfore-Studie schließt geplante 450 Chemotherapie-naive Patienten mit mCRPC ein. Noch früher im Krankheitsverlauf setzt die PSMAddition-Studie an. Hier sollen 1126 Patienten mit hormonsensitivem Prostatakarzinom therapiert werden.
Zusammenfassend ist die Therapie mit [177Lu]-PSMA bei einer sorgfältigen Selektion der Patienten eine effektive Therapie für das mCRPC mit einem überschaubaren Nebenwirkungsprofil. Die Zulassung wird für 2022 erwartet, was die begrenzten Kapazitäten der nuklearmedizinischen Therapiestationen vor eine Herausforderung stellen könnte. Ein Einsatz in früheren Erkrankungsstadien wird momentan in Studien evaluiert.
Literatur:
1 Afshar-Oromieh A et al.: Performance of [(68)Ga]Ga-PSMA-11 PET/CT in patients with recurrent prostate cancer after prostatectomy-a multi-centre evaluation of 2533 patients. Eur J Nucl Med Mol Imaging 2021; 48(9): 2925-34 2 Sartor O et al.: Lutetium-177-PSMA-617 for prostate cancer. Reply. N Engl J Med 2021; 385(26): 2495-6 3 Hofman MS et al.: [(177)Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet 2021; 397(10276): 797-804
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...