Limitationen und Pitfalls aus Perspektive der Viszeralchirurgie
Autor:
Priv.-Doz. DDr. Philipp Horvath
Oberarzt
Abteilung für Allgemeine, Viszeral- und Thoraxchirurgie
Schwerpunktkrankenhaus Feldkirch
E-Mail: philipp.horvath@lkhf.at
Die Therapieoptionen bei kolorektalen Lebermetastasen sind mannigfaltig und bestehen aus drei Säulen: Chirurgie – nichtoperative Therapie – medikamentöse Therapie. Ein Konsens über die bestmögliche Therapieabfolge besteht aktuell nicht. Dieser Artikel beleuchtet die Therapie aus der Sicht eines Viszeralchirurgen mit Fokus auf die Strategie und die Limitationen der chirurgischen Vorgehensweise.
Keypoints
-
Mehr als 15% der Patient:innen mit primär nicht resektablen kolorektalen Lebermetastasen sind im Verlauf operabel.
-
Operative und interventionelle Augmentationsverfahren erhöhen die Rate an resektablen Patient:innen weiter.
-
Die präoperative Restleberfunktionseinschätzung kann das Risiko für ein postoperatives Leberversagen weiter reduzieren.
-
Minimalinvasive Resektionsstrategien senken die Morbidität, und dies ohne Erhöhung der Mortalität auch bei Major-Resektionen.
Präoperative Evaluation und Patient:innenselektion
Der Blickwinkel darauf, ob sich Patient:innen für eine Leberresektion bei kolorektalen Lebermetastasen eignen bzw. onkologisch davon profitieren, hat sich seit Mitte der 1980er-Jahre grundlegend geändert. Die strikt ausgelegten Kriterien (<4 hepatische Metastasen, keine extrahepatischen Manifestationen und ein Sicherheitsabstand von mindestens 1cm)1 haben heutzutage in einem multimodalen Therapiekonzept keine alleinige Daseinsberechtigung mehr. Diese Konzepte erlauben uns heute, ca. 15% der Patient:innen mit initial nicht resektablen Lebermetastasen in einen resektablen Zustand zu überführen.2,3
Mithilfe modernster Bildgebungstechnologie können das Ausmaß der hepatischen Erkrankungssituation (solitär vs. unilobär vs. bilobär) und die damit einhergehende Resektabilität eingeschätzt werden. Hier scheint die MRT der CT sowohl in der primären als auch in der Response-Evaluation nach neoadjuvanter Chemotherapie überlegen zu sein.4 Die Einschätzung der Resektabilität unterliegt jedoch einer hohen Interobserver-Variabilität und in bis zu 50% der Fälle ergeben sich seitens der Chirurg:innen unterschiedliche Einschätzungen zur Resektabilität.5,6 Das Volumen und die Funktion der Restleber („future liver remnant“, FLR), der Allgemeinzustand der Patient:innen und ein Ansprechen auf eine etwaige neoadjuvante Chemotherapie sind hier als Hauptentscheidungskriterien zu nennen.
„Future liver remnant“ und „Small for size“-Syndrom alslimitierende Faktoren
Nicht erweiterte Leberresektionen (Hemihepatektomie rechts oder links) sind in aller Regel nicht risikobehaftet, da genügend Leberrestvolumen zurückbleibt. Herausfordernd hingegen sind die hepatischen Befallsmuster, welche mit einer erweiterten Hemihepatektomie rechts adressiert werden müssen.
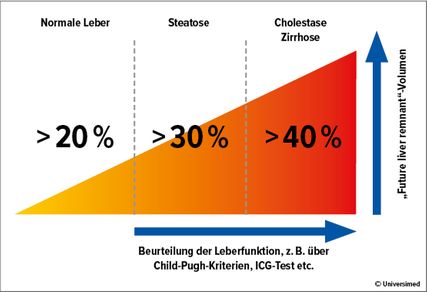
Abb. 1: Der prozentuale Anteil des FLR („future liver remnant“) am Gesamtlebervolumen variiert je nach Zustand der Leber. (modifiziert nach Guglielmi A et al.)18
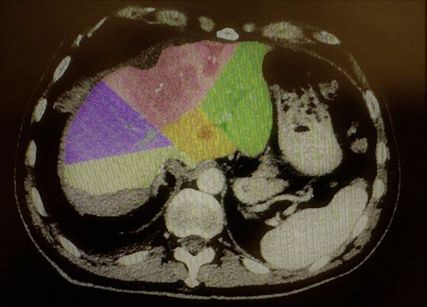
Abb. 2: Große zentrale Metastase eines Rektumkarzinoms (rosa Bereich) sowie sehr kleine linkslaterale Segmente (grüner Bereich)
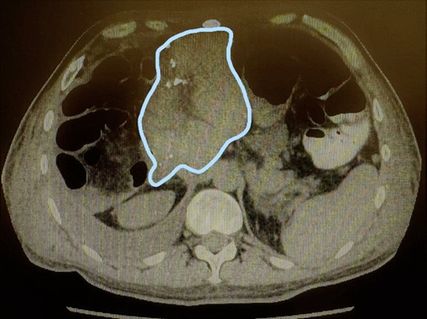
Abb. 3: Z.n. Resektion i.S. einer erweiterten Hemihepatektomie rechts mit augmentierten linkslateralen Segmenten (blau umrandet)
Die häufig vortherapierten Patient:innen mit einem geringen Volumen des FLR (=Volumensegmente 2 und 3) können häufig nicht primär operiert werden, sondern benötigen Augmentationsverfahren. Hier steht einerseits die interventionell-radiologische Herangehensweise zur Verfügung, im Sinne einer Pfortaderembolisation (PVE) mit oder ohne gleichzeitige Outflow-Modulierung, oder andererseits die zweizeitige Leberresektion nach dem ALPPS(„Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy“)-Verfahren.
Der prozentuale Anteil des FLR am Gesamtlebervolumen, der als ausreichend erachtet wird, um ein postoperatives „Small for size“-Syndrom gefolgt von einem postoperativen Leberversagen zu vermeiden, variiert je nach Zustand der Leber (Abb. 1). Die Restleberfunktion kann durch Funktionstests (LiMAx-Atemtest, HIDA-Szintigrafie oder ICG-Clearence) weiter objektiviert werden.
Welches Verfahren zur Augmentation des FLR genutzt werden sollte, ist aktuell nicht klar festgelegt. Sparrelid E et al. haben die PVE mit dem ALPPS-Verfahren bei kolorektalen Lebermetastasen verglichen und konnten zeigen, dass der Hypertrophieeffekt des ALPPS-Verfahrens (Abb. 2 und Abb. 3) signifikant besser war (66,7% vs. 46,3%; p=0,001).7 Den besten Hypertrophieeffekt hatte jedoch die primäre PVE gepaart mit einer Rescue-ALPPS. Die Rate der erfolgreichen Resektionen war ebenso im ALPPS-Arm höher, jedoch statistisch nicht signifikant (84,5% vs. 73,2%; p=0,08).
Als Kriterium für die Entscheidung, welches der beiden Verfahren zum Einsatz kommt, kann der sFLR („standardized FLR“) vor einer Intervention herangezogen werden. Patient:innen mit einem sFLR <15% brauchten statistisch signifikant häufiger eine Rescue-ALPPS nach primärer PVE als jene mit einem sFLR >25% (p=0,02).
Synchrones oder metachrones Vorgehen
Das „Liver first“-Konzept ist in der chirurgischen Gesellschaft breit akzeptiert, jedoch ist bis dato nicht klar, welche Patient:innen am meisten von dem einen oder dem anderen Konzept („primary first“ oder simultanes Vorgehen) profitieren.
Das LiverMetSurvey-Register hat 7360 Patient:innen analysiert und gezeigt, dass bei Patient:innen mit einer solitären Lebermetastase oder einem unilobären Befall die zeitliche Abfolge („liver first“ vs. „primary first“ vs. simultanes Vorgehen) keinen Effekt auf das Gesamtüberleben hatte, wohingegen Patient:innen mit einem bilobären Befall statistisch signifikant vom „Liver first“-Konzept profitierten.8
Somit kann die hepatische Tumorlast als Entscheidungskriterium herangezogen werden, um die zeitliche Therapieabfolge zu strukturieren.
Vorgehen bei primär nicht resektablen Lebermetastasen
Bei Erstdiagnose kolorektaler Lebermetastasen sind lediglich 20–30% der Patient:innen resektabel.9 Durch aggressive chemotherapeutische Vorbehandlung können gute Ansprechraten zwischen 31% und 72% und Raten an kompletter Resektion von knapp 40% erreicht werden.10 Der Tumor-Burden-Score (TBS), eine Summe aus größtem Tumordurchmesser in Zentimetern und der Tumoranzahl, kann die Konversionsrate nach Induktionschemotherapie verlässlich vorhersagen. Patient:innen mit einem niedrigen Score hatten eine dreimal so hohe Konversionsrate wie Patient:innen mit einem hohen Score (Cut-off-Wert 14,3; p<0,001).11
Die aktuell publizierte CAIRO5-Studie gibt einen guten Überblick über die aktuell effektivsten Substanzen zur Vorbehandlung, angelehnt an die Lateralität des Primärtumors und den Mutationsstatus.12
Zusammenfassend ist festzuhalten, dass diese Patient:innen nicht alternativlos der palliativen Systemtherapie überlassen werden sollten, sondern vielmehr muss nach aggressiver Induktionschemotherapie im Zuge des Re-Stagings die Operabilität erneut beurteilt werden.
Resektionsstatus und Anzahl der Lebermetastasen
Die R1-Resektion bei der chirurgischen Therapie kolorektaler Lebermetastasen wurde im klinischen Alltag häufig als Therapieversagen abgestempelt. Jedoch haben bereits seit Längerem publizierte Daten gezeigt, dass es keine signifikanten Unterschiede im Gesamt- und rezidivfreien Überleben über fünf Jahre zwischen der R0- und der R1-Gruppe gab (61% vs. 57%, p=0,27; 29% vs. 20%, p=0,12).13
Interessanterweise erlitten R1-resezierte Patient:innen nicht, wie zu erwarten, häufiger Rezidive an der Resektionsfläche, sondern an einer anderen intrahepatischen Lokalisation. Die Anzahl der kolorektalen Lebermetastasen (1–3 vs. 4–9 vs. >10) ist ein hochsignifikanter Prädiktor für das Gesamt- und rezidivfreie Überleben, das schlechteste Outcome dabei haben Patient:innen mit >10 Metastasen.
Dennoch stellt die schiere Anzahl keine absolute Kontraindikation für eine kurativ intendierte Chirurgie dar. Eingebettet in eine perioperative Systemtherapie kann bei Patient:innen mit >10 Lebermetastasen eine 3-Jahres-Gesamtüberlebensrate von 52% erreicht werden. Hoch interessant ist eine Subgruppenanalyse von Patient:innen mit insgesamt vier erfüllten Kriterien (R0/R1-Resektion, präoperatives MRT, maximaler Tumordurchmesser <40mm und adjuvante Chemotherapie), die eine 3- und 5-Jahres-Gesamtüberlebensrate von 82% bzw. 69% ergab.14
Operativer Zugangsweg und Strategie
Der Wandel hin zu minimalinvasiven und vor allem robotischen Operationen durchzieht nahezu alle Subspezialitäten der Viszeralchirurgie. Eine rezente NSQIP-Analyse verglich in Summe 1561 Patient:innen mit offener und minimalinvasiver Resektion kolorektaler Lebermetastasen und konnte zeigen, dass es durch ein laparoskopisches und robotisches Vorgehen zu einer hochsignifikanten Reduktion der höhergradigen Morbidität kam (10,8% vs. 24,7%; p<0,001).15
Hervorzuheben ist, dass in der Gruppe mit minimalinvasivem Eingriff auch Major-Resektionen durchgeführt wurden und es hierdurch zu keiner Erhöhung der Mortalität gekommen ist (1,1% vs. 1,6%; p=0,602).
Eine andere relevante Thematik in Hinblick auf die chirurgische Strategie ist der Vergleich der anatomischen mit der nicht-anatomischen Resektion. Eine Propensity-Score-Analyse von 358 Patient:innen zeigte, dass die nichtanatomische Resektion onkologisch nicht unterlegen und vor allem mit einer niedrigeren Morbidität verbunden war.16 Die noch ausstehende ARMANI-Studie beleuchtet diesen Umstand an geplanten 240 Patient:innen. Die Rekrutierung soll Ende 2024 abgeschlossen sein.17
Literatur:
1 Ekberg H et al.: Determinants of survival in liver resection for colorectal secondaries. Br J Surg 1986; 73(9): 727-31 2 Bismuth H et al.: Resection of nonresectable liver metastases from colorectal cancer after neoadjuvant chemotherapy. Ann Surg 1996; 224(4): 509-20 3 Lam VW et al.: A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases. Ann Surg Oncol 2012; 19(4): 1292-301 4 Granata V et al.: Diagnostic performance of gadoxetic acid-enhanced liver MRI vs. multidetector CT in the assessment of colorectal liver metastases compared to hepatic resection. BMC Gastroenterol 2019; 19(1): 129 5 Mohammad WM et al.: Evaluating agreement regarding the resectability of colorectal liver metastases: a national case-based survey of hepatic surgeons. HPB (Oxford) 2012; 14(5): 291-7 6 Bechstein WO et al.: Resectability and agreement between surgeons: review of CT and MR scan of the CELIM study: multicenter randomized trial of cetuximab/FOLFOX vs. cetuximab/FOLFIRI in unresectable liver metastases. J Clin Oncol 2009; 27(Suppl. 15): 4091 7 Sparrelid E et al.: How should liver hypertrophy be stimulated? A comparison of upfront associating liver partition and portal vein ligation for staged hepatectomy (ALPPS) and portal vein embolization (PVE) with rescue possibility. Hepatobiliary Surg Nutr 2021; 10(1): 1-8 8 Giuliante F et al.: Liver-first approach for synchronous colorectal metastases: analysis of 7360 patients from the LiverMetSurvey Registry. Ann Surg Oncol 2021; 28(13): 8198-208 9 Adam R et al.: Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: amodel to predict long-term survival. Ann Surg 2004; 240(4): 644-57 10 Kemeny N et al.: The management of resectable and unresectable liver metastases from colorectal cancer. Curr Opin Oncol 2010; 22(4): 364-73 11 Peng J et al.: Application of Tumor Burden Score for predicting conversion outcome in patients with initially unresectable colorectal liver metastases after first-line systemic therapy. Ther Adv Gastroenterol 2021; 19:14: 17562848211066206 12 Bond MJG et al.: First-line systemic treatment strategies in patients with initially unresectable colorectal cancer liver metastases (CAIRO5): an open-label, multicentre, randomised, controlled, phase 3 study from the Dutch Colorectal Cancer Group. Lancet Oncol 2023; 24(7): 757-71 13 De Haas RJ et al.: R1 resection by necessity for colorectal liver metastases: is it still a contraindication to surgery? Ann Surg 2008; 248(4): 626-37 14 Allard MA et al.: Long-term outcomes of patients with 10 or more colorectal liver metastases. Br J Cancer 2017; 117(5): 604-11 15 Lund CM et al.: Minimally invasive vs. open synchronous colorectal and hepatic resection for metastatic colorectal cancer: American College of Surgeons National Surgical Quality Improvement Program (ACS NSQIP) analysis. BJS Open 2023; 7(6): zrad149 16 Brown KM et al.: Propensity score analysis of non-anatomical vs. anatomical resection of colorectal liver metastases. BJS Open 2019; 3(4): 521-31 17 Anatomical Resection of Liver MetAstases iN patIents With RAS-mutated Colorectal Cancer (ARMANI). ClinicalTrials.gov-ID: NCT04678583 18 Guglielmi A et al.: How much remnant is enough in liver resection? Dig Surg 2012; 29: 6-17
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...