Kurative Strahlentherapie beim NSCLC im Frühstadium
Autor:
Ao. Univ.-Prof. Dr. Meinhard Nevinny-Stickel
Stellvertretender Direktor
Universitätsklinik für Strahlentherapie – Radioonkologie, Innsbruck
E-Mail: meinhard.nevinny@i-med.ac.at
Die extrakranielle stereotaktische Strahlentherapie ist eine kurative Therapieoption für Patienten mit einem nicht kleinzelligen Bronchialkarzinom (NSCLC) im frühen Stadium, für die ein erhöhtes Risiko bei Operation besteht. Sie ist durch eine exzellente lokale Kontrolle bei niedriger Nebenwirkungsrate gekennzeichnet.
Für Patienten mit einem nicht kleinzelligen Bronchialkarzinom (NSCLC) im Stadium I, die aus internistischer und chirurgischer Sicht operabel sind, wird derzeit noch die Lobektomie mit hilärer und mediastinaler Lymphknotendissektion empfohlen. Etwa ein Viertel aller Patienten kann aber wegen bestehender Komorbiditäten nicht operiert werden. Der Anteil an inoperablen Patienten mit einem NSCLC im Frühstadium hat in den letzten Jahren zugenommen.1
Die extrakranielle stereotaktische Strahlentherapie („stereotactic body radiotherapy“ [SBRT/SABR]) wurde Mitte der 1990er-Jahre erstmals als Weiterentwicklung der kraniellen Stereotaxie vorgestellt2 und hat sich anfangs hauptsächlich in universitären Strahlentherapieeinrichtungen durchgesetzt. Bei der SBRT werden modernste Techniken zum Erreichen einer maximalen Präzision angewandt. Das betrifft die Zielvolumendefinition unter Berücksichtigung der Atembeweglichkeit, die Bestrahlungsplanung zur Konzentration der Bestrahlungsdosis auf den Tumor bei gleichzeitiger Schonung des benachbarten Normalgewebes und die Strahlenapplikation zur punktgenauen Bestrahlung des Tumors.
Diese Präzision ermöglicht die Behandlung mit ablativen Bestrahlungsdosen des Tumors bei optimaler Schonung von gesundem Lungengewebe.
Ablauf der SBRT an der MedUni Innsbruck
In unserer Abteilung werden die Patienten in einem für die SBRT entwickelten Vakuummatratzensystem gelagert und fixiert.3 Danach wird in dieser Bestrahlungsposition eine Planungs-Computertomografie (CT) durchgeführt, wobei mit einer 4D-CT die Atembeweglichkeit des Tumors erfasst wird. Der CT-Datensatz wird in ein Bestrahlungsplanungsprogramm eingelesen. Nach Konturierung des Zielvolumens unter Berücksichtigung der gemessenen Atembeweglichkeit und Konturierung der jeweiligen Risikoorgane wird ein 3D-Bestrahlungsplan erstellt. Dabei kommen entweder multiple einzelne überlagernde Bestrahlungsfelder oder dynamische Rotationstechniken zur Anwendung, um eine hohe Dosis im Zielvolumen mit einem steilen Dosisabfall in der Umgebung zu erreichen. Bei den einzelnen Bestrahlungssitzungen wird unmittelbar vor der Bestrahlung mit einer Onboard-CT, welche am Linearbeschleuniger montiert ist, eine Cone-Beam-CT erstellt, die mit der Bestrahlungsplanungs-CT fusioniert wird, um so die korrekte Positionierung des Patienten und die Lage des Tumors zu überprüfen und gegebenenfalls mithilfe der Behandlungstischsteuerung zu korrigieren. Abhängig von der Größe des Tumors und seiner Lagebeziehung zu kritischen Strukturen werden die Patienten in drei bis zehn Therapiesitzungen behandelt, wobei die biologisch effektive Dosis der gesamten Behandlung über 100Gy liegen sollte, um eine möglichst optimale Rate an lokaler Kontrolle zu erreichen.
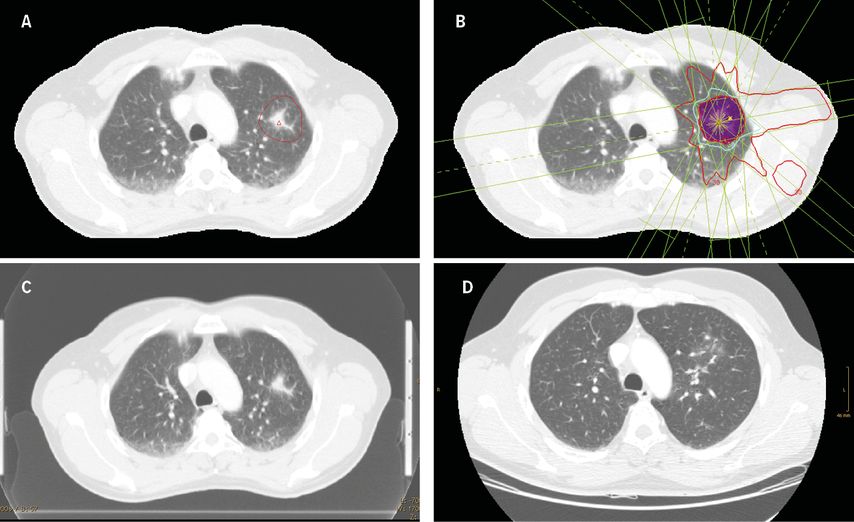
Abb. 1: A: Planungs-Computertomografie mit Zielvolumen (rot), B: Bestrahlungsplan mit Dosisverteilung, C: Kontrolle 3 Monate nach SBRT, D: Kontrolle 9 Monate nach SBRT
Voraussetzungen für eine SBRT
Da bei der SBRT nur der Primärtumor behandelt wird, ist ein korrektes Staging mit zeitnaher FDG-Positronen-Emissionstomografie(PET)-CT und eventueller Abklärung verdächtiger Lymphknoten mit einem endobronchialen Ultraschall (EBUS) unbedingte Voraussetzung. Dennoch wurden bei korrektem Staging bis zu 10% regionäre Rezidive in den mediastinalen und hilären Lymphknoten beobachtet. Diese regionären Rezidive können aber mitunter wiederum mit einer SBRT behandelt werden.
Ob die alleinige Bestrahlung des Tumors im Gegensatz zur Lobektomie mit hilärer und mediastinaler Lymphknotendissektion von prognostischer Relevanz ist, wird kontrovers diskutiert. Die Lymphknotendissektion hat wohl eher diagnostischen als therapeutischen Charakter. So zeigte eine randomisierte Studie, dass eine systematische Lymphknotendissektion im Vergleich zu einem Lymphknoten-Sampling die Prognose der Patienten nicht verbessert.4 Die Konsequenz einer positiven Lymphknotendissektion ist eine weitere adjuvante Therapie, die zwar eine signifikante, aber dennoch relativ geringe Lebensverlängerung erzielt.
Evidenz pro SBRT
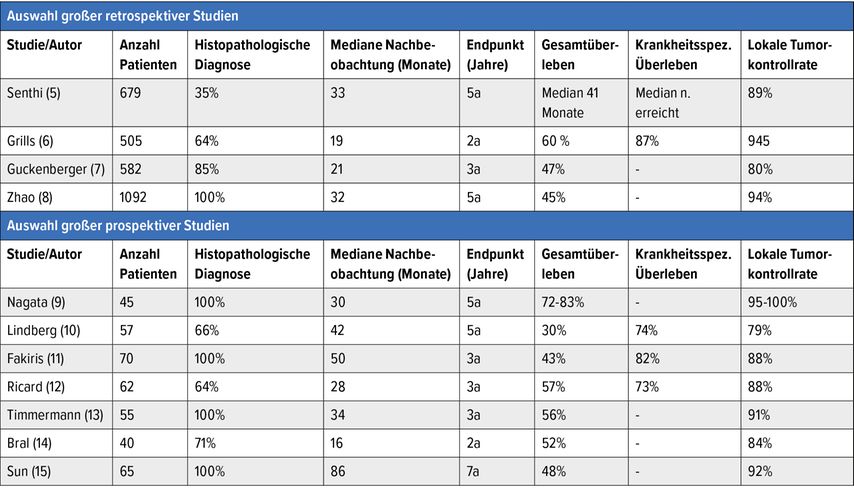
In zahlreichen prospektiven und retrospektiven Studien wurde die SBRT als Behandlungsoption für das frühe Lungenkarzinom bereits untersucht (Tab. 1). Die Lokalkontrollrate lag bei diesen Studien zwischen 79% und 100%. Es hat sich bei genauer Analyse der Daten ergeben, dass für die lokale Kontrolle die Bestrahlungsdosis der entscheidende Faktor ist.
Tab. 1: Auswahl an großen retrospektiven und prospektiven Studien zur SBRT von Patienten mit NSCL im Stadium I
So konnte gezeigt werden, dass bei einer Dosis von mindestens 100Gy biologisch effektiver Dosis die Lokalkontrollrate bei über 90% liegt. Die Gesamtüberlebensrate nach fünf Jahren variiert zwischen etwa 30% und etwas mehr als 80%. Das ist jedoch den vorbestehenden Komorbiditäten geschuldet, welche die Inoperabilität der Patienten begründeten, da die meisten Patienten nicht an ihrem Tumor, sondern an diesen Komorbiditäten verstorben sind.
Demensprechend ist die Rate des krankheitsspezifischen Überlebens mit 73% bis 82% auch deutlich höher. Die SBRT-assoziierte Mortalität ist quasi 0% und die Toxizitätsrate ist mit etwa 3% Grad-3-Toxizität ausgesprochen niedrig.16 Dementsprechend verändert sich die vom Patienten subjektiv wahrgenommene Lebensqualität auch durch die SBRT nicht zum Negativen.17
Neuer Goldstandard
Ob die SBRT für operable Patienten mit einem NSCLC im Stadium I eine gleichwertige Alternative zur Lobektomie ist, wird derzeit noch heftig diskutiert. Randomisierte Studien zu dieser Frage mussten wegen unzureichender Rekrutierung vorzeitig gestoppt werden. Patientendaten aus zwei dieser vorzeitig beendeten randomisierten Studien wurden zu einer gepoolten Analyse herangezogen und prominent publiziert.18
Insgesamt wurden bei dieser Analyse 58 Datensätze operabler Patienten ausgewertet, die entweder in einen SBRT-Arm oder einen Lobektomie-Arm randomisiert wurden. Die Gesamtüberlebensrate war für die mit SBRT behandelten Patienten mit einer 3-Jahres-Überlebensrate von 95% versus 79% nach Lobektomie signifikant höher. Die Rate des rezidivfreien 3-Jahres-Überlebens lag nach SBRT bei 86% und nach Lobektomie bei 80% und unterschied sich somit nicht signifikant.
Im lokalen, regionalen und distanten rezidivfreien Überleben gab es für die beiden Behandlungsarme keinen Unterschied. Nach SBRT gab es keine Grad- 4-Nebenwirkungen und nur 10% Grad-3-Nebenwirkungen. Nach Lobektomie kam es hingegen bei 44% der Patienten zu Nebenwirkungen von Grad 3 und 4, und ein Patient starb an intraoperativen Komplikationen.
Natürlich hat diese Analyse deutliche methodische Limitationen, einerseits durch die kleine Patientenzahl und andererseits durch das unterschiedliche Studiendesign der gepoolten Studien. Dennoch handelt es sich hierbei bisher um die einzigen Daten, die zu vergleichbaren randomisierten Patienten vorliegen. Diese Daten lassen den Schluss zu, dass die onkologischen Behandlungsergebnisse nach SBRT oder Lobektomie für Patienten mit einem NSCLC im Stadium I ähnlich, wenn nicht gar gleich gut sind. Daher wurden nach dieser Publikation erneut zahlreiche randomisierte Studien, die die SBRT mit der Operation für operable Patienten in frühen Stadien des NSCLC vergleichen, gestartet. Mit den Ergebnissen ist in den nächsten Jahren zu rechnen.
Die SBRT ist sicherlich eine leitliniengerechte und evidenzbasierte Therapieoption für Patienten mit einem NSCLC im Stadium I, die aufgrund von Komorbiditäten ein erhöhtes Operationsrisiko haben bzw. inoperabel sind. Sie sollte diesen Patienten unbedingt als kurative Therapieoption angeboten werden. Selbstverständlich sollten alle Patienten in einem interdisziplären Tumorboard vorgestellt werden, um eine optimale Therapiestrategie festzulegen, die die individuelle Patientensituation berücksichtigt.
Literatur:
1 Kaniski F et al.: Temporal patterns of care and outcomes of non-small cell lung cancer patients in the United States diagnosed in 1996, 2005, and 2010. Lung Cancer 2017; 103: 66-74 2 Lax I et al.: Stereotactic radiotherapy of malignancies in the abdomen. Methodological aspects. Acta Oncol 1994; 33: 677-83 3 Nevinny-Stickel M et al.: Reproducibility of patient positioning for fractionated extracranial stereotactic radiotherapy using a double-vacuum technique. Strahlenther Onkol 2004; 80: 117-22 4 Darling GE et al.: Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg 2011; 141: 662-70 5 Senthi S et al.: Patterns of disease recurrence after stereotactic ablative radiotherapy for early stage non-small-cell lung cancer: aretrospective analysis. Lancet Oncol 2012; 13: 802-9 6 Grills IS et al.: A collaborative analysis of stereotactic lung radiotherapy outcomes for early-stage non-small-cell lung cancer using daily online cone-beam computed tomography image-guided radiotherapy. J Thorac Oncol 2012; 7: 1382-93 7 Guckenberger M et al.: Safety and efficacy of stereotactic body radiotherapy for stage I non-small-cell lung cancer in routine clinical practice: a patterns-of-care and outcome analysis. J Thorac Oncol 2013; 8: 1050-8 8 Zhao L et al.: Planning target volume D95 and mean dose should be considered for optimal local control for stereotactic ablative radiation therapy. Int J Radiat Oncol Biol Phys 2016; 95: 1226-35 9 Nagata Y et al.: Clinical outcomes of a phase I/II study of 48 Gy of stereotactic body radiotherapy in 4 fractions for primary lung cancer using a stereotactic body frame. Int J Radiat Oncol Biol Phys 2005; 63: 1427-31 10 Lindberg K et al.: Long-term results of a prospective phase II trial of medically inoperable stage I NSCLC treated with SBRT – the Nordic experieence. Acta Oncol 2015; 54: 1096-104 11 Fakiris AJ et al.: Stereotactic body radiation therapy for early stage non-small-cell lung carcinoma: four-year results of a prospective phase II study. Int J Radiat Oncol Biol Phys 2009; 75: 677-682 12 Ricardi U et al.: Stereotactic body radiation therapy for early stage non-small-cell lung cancer: results of a prospective trial. Lung Cancer 2010; 68: 72-7 13 Timmermann R et al.: Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303: 1070-6 14 Bral S et al.: Prospective, risk-adapted strategy of stereotactic body radiotherapy for early-stage non-small-cell lung cancer: results of a Phase II trial. Int J Radiat Oncol Biol Phys 2011; 80: 1343-9 15 Sun B et al.: 7-year follow up after stereotactic ablative radiotherapy for patients with stage I non-small-cell lung cancer: results of a phase 2 clinical trial. Cancer 2017; 123: 3031-9 16 Lagerwaard FJ et al.: Outcomes of stereotactic ablative radiotherapy in patients with potentially operable stage I non-smal- cell lung cancer. Int J Radiat Obcol Biol Phys 2012; 83: 348-53 17 Lagerwaard FJ et al.: Patient-reported quality of life after stereotactic ablative radiotherapy for early-stage lung cancer. J Thorac Oncol 2012; 7: 1148-54 18 Chang JY et al.: Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol 2015; 16: 630-7
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...