Highlights zum Nierenzellkarzinom
Autorin:
Univ.-Prof. Dr. Manuela Schmidinger
Universitätsklinik für Urologie
Medizinische Universität Wien
Beim Jahrestreffen der American Society of Clinical Oncology (ASCO) 2022 wurden zwar keine neuen, bahnbrechenden Therapiestrategien beim Nierenzellkarzinom (RCC) vorgestellt, jedoch gab es interessante Updates aus den großen Studien der letzten Jahre, welche das Management von Patienten mit Nierenzellkarzinom nachhaltig verändert haben. Zudem wurden Updates zu Studien mit neuen Medikamenten und neue diagnostische Tools vorgestellt.
Keypoints
-
Der Benefit einer adjuvanten Therapie mit Pembrolizumab bestätigt sich auch nach längerem Follow-up.
-
Der Erfolg von aktuellen Erstlinien-Strategien wird weiterhin bestätigt, Response-Tiefe ist für das PFS und OS relevant und eine tiefere Response wird durch Kombinationstherapien erreicht.
-
Neue zielgerichtete Therapien, abseits der Immun- checkpoint-Inhibitoren, sind vielversprechend, insbesondere der neue HIF-2alpha-Inhibitor Belzutifan, der sich durch extrem lange Ansprechdauer und gute Verträglichkeit auszeichnet.
Adjuvante Therapie
Basierend auf den Ergebnissen der KEYNOTE-564-Studie wurde kürzlich der Immuncheckpoint-Inhibitor (ICI) Pembrolizumab im adjuvanten Setting zugelassen (Patientenprofil: intermediäres oder intermediär-hohes Rückfallrisiko). Die Zulassung basierte auf einem signifikanten Benefit in Bezug auf das krankheitsfreie Überleben (DFS) im Vergleich zum Placebo. Beim ASCO-Jahrestreffen 2022 wurde nun ein Follow-up der Studie präsentiert.1
Nach einer medianen Nachbeobachtungszeit von 30 Monaten zeigt sich anhaltend eine Verlängerung des DFS (HR0,63). Zudem profitieren Patienten im Pembrolizumab-Arm in Bezug auf
-
die Zeit bis zum Auftreten von Fernmetastasen (HR 0,63: median in beiden Armen nicht erreicht),
-
die mediane Zeit bis zur Nächstlinientherapie (HR 0,67: median nicht erreicht) sowie
-
die Zeit bis zur Progression auf die Nächstlinientherapie (HR 0,57: median nicht erreicht).
Erstlinien-Setting beim klarzelligen RCC
Aktuell sind vier Therapien im Erstlinien-Setting beim klarzelligen RCC empfohlen. Bei Patienten aller Risikogruppen kann aus folgenden Therapien gewählt werden:
-
Pembrolizumab + Axitinib,
-
Nivolumab + Cabozantinib,
oder Pembrolizumab + Lenvatinib.
Bei Patienten mit intermediärem oder hohem Risiko steht zusätzlich die Kombination Nivolumab + Ipilimumab als Strategie zur Verfügung.
Updates umfassten folgende Bereiche:
CheckMate-214-Studie:
Zu Nivolumab + Ipilimumab (Nivo+Ipi) versus Sunitinib wurde Neues zur Beziehung zwischen Lebensqualität („Health-related Quality of life“, HRQoL) und Effektivität der Therapie berichtet.2 Baseline- und longitudinale HRQoL-Ergebnisse wurden mit dem progressionsfreien Überleben und Gesamtüberleben (OS) assoziiert. In beiden Therapiearmen führte eine Verbesserung der HRQoL zu einem signifikant längeren medianen Überleben.
Die Ergebnisse für QoL-Responder versus Non-Responder lauteten wie folgt:
-
Nivo+Ipi-Arm: HR 0,39: median nicht erreicht versus 34,7 Monate, p<0,0001
-
Sunitinib-Arm: HR 0,57: median 48,9 versus 27 Monate, p=0,0001
KEYNOTE-426-Studie:
Pembrolizumab + Axitinib (Pembro+Axi) versus Sunitinib: Hier wurde eine explorative Analyse zum Vergleich der Zeit von der Randomisierung in der Studie bis zur Progression in der nächsten Therapielinie gezeigt (progressionsfreies Überleben 2, PFS2). Das PFS2 war im Pembro+Axi-Arm signifikant länger als im Sunitinib-Arm (HR 0,63: 40,1 versus 27,7 Monate). Bei derzeit noch nicht erreichtem medianem Überleben der Patienten mit günstigem Profil sind die PFS2-Daten besonders interessant, da sich hier bereits eine Verlängerung des PFS2 zeigt (HR 0,68: 46,0 versus 39,9 Monate). Das PFS2 wird gerne als Surrogat für das Gesamtüberleben interpretiert, wenn dieses median noch nicht erreicht ist.
CheckMate-9ER-Studie:
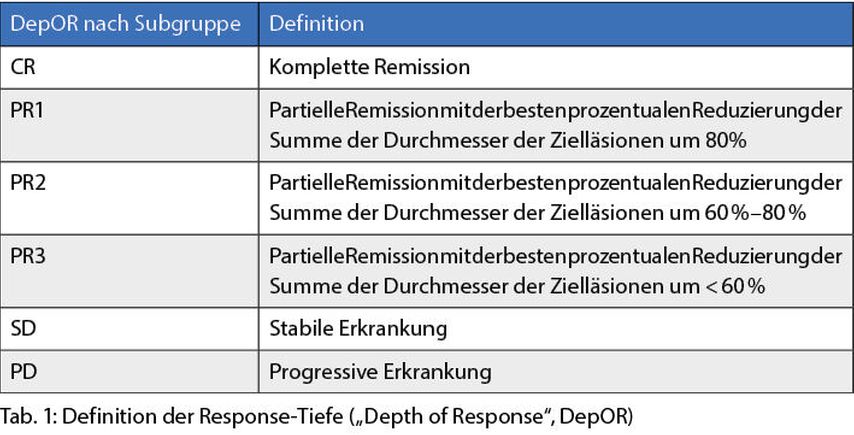
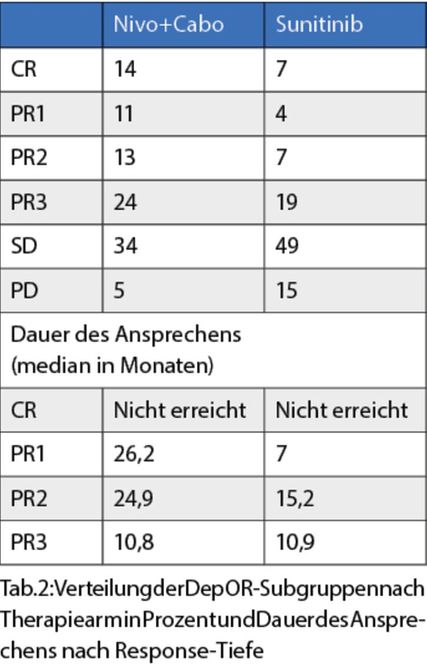
Nivolumab + Cabozantinib (Nivo+Cabo) versus Sunitinib:Suarez C et al.3 zeigten eine Analyse zur Assoziation der Response-Tiefe mit dem klinischen Ergebnis; Response-Tiefe (DepOR) wurde wie in Tabelle 1 dargestellt definiert. Im Nivo+Cabo-Arm war der Anteil an Patienten mit tiefer Response größer als im Sunitinib-Arm.
Unabhängig vom Therapiearm war die Response-Tiefe mit einem verlängerten PFS und OS assoziiert. Patienten mit erheblicher Response-Tiefe („complete response“ [CR], „pathological response 1“ [PR1]) hatten eine vergleichbare Überlebensrate in beiden Armen. Die mediane Dauer des Ansprechens war ebenfalls mit der Response-Tiefe assoziiert (Tab. 2).
Keynote-564-Studie, CLEAR-Studie:
Pembrolizumab + Lenvatinib (LenPem) versus Sunitinib (versus Lenvatinib + Everolimus): Zu dieser Studie wurde ebenfalls die Zeit bis zur Progression auf die Zweitlinientherapie (PFS2) präsentiert.4 Die Ergebnisse beziehen sich auf ein medianes Follow-up von 26,6 Monaten; die Zeit von der Randomisierung in den jeweiligen Studienarm bis zur Initiierung der Nachfolgetherapie war im LenPem-Arm doppelt so lange wie im Sunitinib-Arm (median 12,68 versus 6,62 Monate). Auch das PFS2 war im LenPem-Arm nicht erreicht versus 28,7 Monate im Sunitinib-Arm (HR 0,50: p<0,0001).
Neue Therapien
Batiraxcept+Cabozantinib:
Shah NJ et al.5 präsentierten die Ergebnisse einer Phase-Ib-Studie mit dem hochpotenten AXL-Inhibitor Batiraxcept (rekombinantes Fusionsprotein bestehend aus humanem AXL und humanem Immunglobulin G1 [Fc] kombiniert mit dem VEGF-MET-AXL-Inhibitor Cabozantinib).
Grad-3- oder Grad-4-Nebenwirkungen traten bei 15% der insgesamt 26 Patienten auf und umfassten vorwiegend Fatigue, Appetitverlust und Diarrhö. 88% der Patienten zeigten eine Reduktion der Targetläsion nach acht Wochen. Die Rate an objektiven Remissionen lag bei 46%, wovon 4% zum Zeitpunkt der Analyse noch unbestätigt waren. Die PFS-Rate nach sieben Monaten lag bei 71%.
Belzutifan-Studien (HIF-2alpha-Inhibitor):
Jonasch E et al.6 präsentierten das Drei-Jahres-Follow-up der LITESPARK-001-Studie, in der Patienten mit unterschiedlichen soliden Tumoren mit Belzutifan behandelt wurden. Vorgestellt wurde die Kohorte der Patienten mit metastasiertem RCC, die zumindest eine Vortherapie gehabt haben durften. Das mediane Ansprechen bei dieser Kohorte lag bei 25%, die Krankheitskontrollrate (DCR) bei 80%. 2% der Patienten erreichten eine Komplettremission. Bemerkenswert ist die Tatsache, dass die Dauer des Ansprechens nach drei Jahren noch nicht erreicht war. Das mediane PFS betrug 14,5 Monate.
Vom selben Autor wurden auch Ergebnisse zum Zwei-Jahres-Follow-up der LITESPARK-004-Studie gezeigt.7 Diese Phase-II-Studie inkludierte Patienten mit VHL-Keimbahnmutation (VHL-Syndrom) und Nierenzellkarzinomen. Alle Patienten waren in Bezug auf systemische Therapie unbehandelt, hatten aber zahlreiche Operationen im Laufe ihres Lebens gehabt. Die Ansprechrate in Bezug auf das RCC war 59% (CR: 3%, PR: 56%, stabile Erkrankung [SD]: 39%; Progression [ist bei keinem Patienten berichtet worden]: 0%); die mediane Zeit des Ansprechens war nicht erreicht.
Wichtig bei dieser Erkrankung ist aber nicht nur das Ansprechen des RCC, sondern auch der mögliche Benefit bei anderen typischen tumorösen Manifestationen der Erkrankung: Das Ansprechen bei Pankreastumoren lag bei 80%, bei pankreatischen neuroendokrinen Tumoren bei 90% und bei ZNS-Hämangioblastomen bei 38%; bei den retinalen Hämangioblastomen wurde eine Verbesserung bei 100% der Patienten bzw. bei 100% aller Augen berichtet. Grad-3- oder Grad-4-Nebenwirkungen waren vergleichsweise selten (16%) und beschränkten sich auf Anämie (10%) und Fatigue (5%).
Neues aus der Diagnostik
PSMA-PET beim Nierenzellkarzinom
Basierend auf der Tatsache, dass das Prostata-spezifische Membranantigen (PSMA) eigentlich nicht nur auf Prostatakarzinomen, sondern auch auf anderen Neoplasien exprimiert sein kann, wurden von einer australischen Forschungsgruppe Daten zur PSMA-Positronen-Emissionstomografie (PSMA-PET) beim Nierenzellkarzinom vorgestellt. Die Biopsie von PSMA-aviden Läsionen zeigte eine 88%ige Konkordanz mit histopathologischen Ergebnissen und führte bei 30% der Patienten zu einer Änderung der Therapiestrategie, die zuvor auf Basis der CT-Befunde festgelegt wurde.8◼
Literatur:
1 Choueiri T et al.: ASCO 2022, Abstr. #4512 2 Cella D et al.: ASCO 2022, Abstr. #4502 3 Suarez C et al.: ASCO 2022; Abstr. #45014 Voss M et al.: ASCO 2022; Abstr. #4514 5 Shah NJ et al.: ASCO 2022; Abstr. #4511 6 Jonasch E et al.: ASCO 2022; Abstr. #4509 7 Jonasch E et al.: ASCO 2022, Abstr. #4546 8 Pathmanathan S et al.: ASCO 2022, Abstr. #4540
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...