Highlights zu aggressiven B-Zell-Lymphomen beim EHA und ICML
Autor:
Dr. Michael Panny
3. Medizinische Abteilung
Hanusch-Krankenhaus, Wien
E-Mail: michael.panny@oegk.at
Auch nach dem Jahreskongress der European Hematology Association (EHA) und der International Conference on Malignant Lymphoma (ICML) 2021 bleibt die Chemoimmuntherapie mit R/CHOP (oder R/CHOP-like) die Standard-Erstlinientherapie bei aggressiven B-Zell-Lymphomen. Neben der bereits etablierten und sich rasch weiter entwickelnden CAR-T-Zell-Therapie drängt jedoch auch eine Reihe neuer Substanzen in frühere Therapielinien. Präliminäre Daten zeigen erste erfolgversprechende Ergebnisse von auf den molekularen Subtyp ausgerichteten Therapien.
Therapieintensivierung bei Hochrisiko-Lymphomen
Von Magnusson et al. wurde eine retrospektive Datenanalyse zur Therapieintensivierung mit EPOCH-R bei Patienten mit singulärem MYC-Rearrangement, „double-“ oder „triple-hit“ Lymphomen im Vergleich zu R-CHOP präsentiert. Von 6809 Patienten mit diffus großzelligem B-Zell-Lymphom (DLBCL) wurden 218 mit MYC-Rearrangement im fortgeschrittenen Stadium identifiziert, 64 hatten ein singuläres MYC-Rearrangement („single-hit“), 116 ein MYC- und BCL2- oder BCL6-Rearrangement („double-hit“) und 37 ein MYC- und BCL2- und BCL6-Rearrangement.
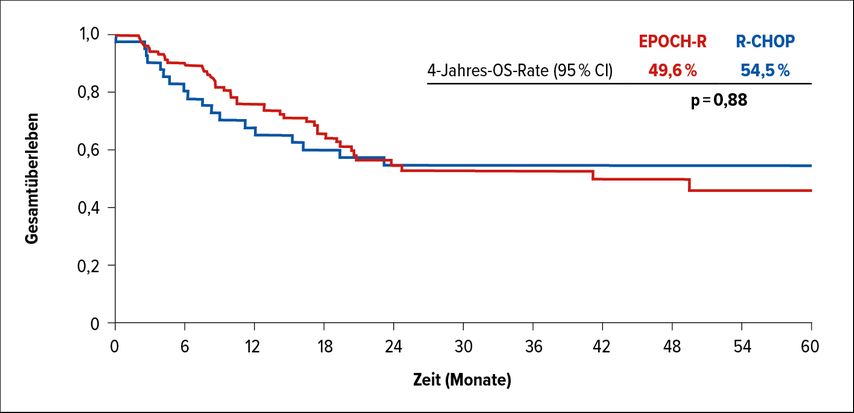
Für „double-“ und „triple-hit“ Lymphome lag das Gesamüberleben (OS) nach 4 Jahren mit R-CHOP bei 54,5%, während es für EPOCH-R ohne signifikanten Unterschied bei 49,6% lag (Abb. 1). Bei den „single-hit“ Lymphomen lag das 4-Jahres-OS ohne signifikanten Unterschied bei überraschend geringen 32,8% im R-CHOP- und bei 30,4% im EPOCH-R-Arm.1 Die optimale Induktionstherapie (und Konsolidierung) für die kleine Gruppe der „double-“ oder „triple-hit“ Lymphome ist nicht abschließend geklärt. Die deutlich toxischere Therapie mit EPOCH-R muss aufgrund der nicht ganz klaren Datenlage im Einzelfall abgewogen werden, dennoch erscheint eine Therapieintensivierung aufgrund der vorliegenden Datenlage rational. Auch am Jahreskongress der American Society of Hematology (ASH) 2020 wurde eine sehr gute Effektivität von EPOCH-R und folgender Konsolidierung mit autologer Stammzelltransplantation präsentiert.
Abb. 1: Gesamtüberleben bei „double-“ und „triple-hit“-Lymphomen unter R-CHOP vs. EPOCH-R (modifiziert nach Magnusson et al.)1
Neue Substanzen im Rezidiv
Im Schatten der CAR-T-Zell-Therapie hat sich in den letzten Jahren für Patienten mit r/r DLBCL eine Reihe von effektiven und meist gut verträglichen Therapieoptionen ergeben, sie haben das Dogma des DLBCL als „one shot cancer“ durchbrochen: bispezifische CD20/CD3-Antikörper, Polatuzumab Vedotin, Tafasitamab, Selinexor und nun Naratuximab-Emtansin.
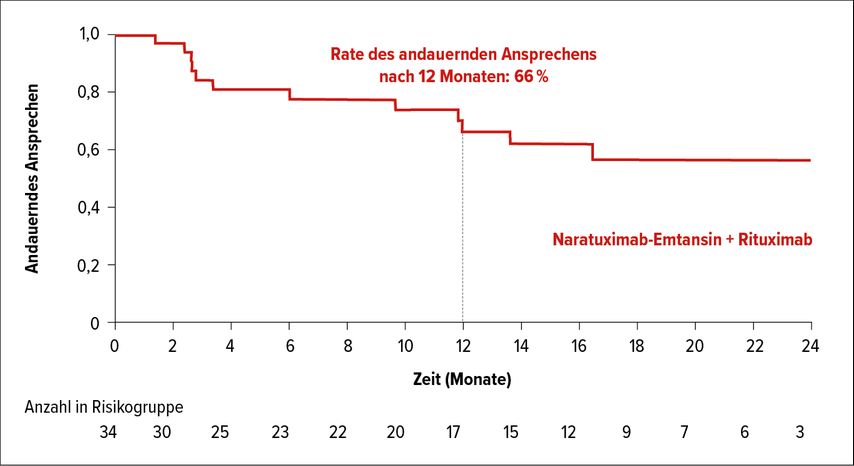
In der Late-Breaking Abstract Session beim EHA-Kongress wurden vielversprechende Daten zu Naratuximab-Emtansin in Kombination mit Rituximab bei rezidiviertem/refraktärem (r/r) DLBCL präsentiert. Der mit einem Maytansinoid gekoppelte CD37-Antikörper zeigte bei diesen intensiv vorbehandelten Patienten mit extrem ungünstiger Prognose eine sehr gute Tolerabilität. Die allgemeine Ansprechrate (ORR) bei 76 Patienten mit r/r DLBCL lag bei 44,7% mit einer Rate des kompletten Ansprechens (CR) von 31,6%. Zwei Drittel der Patienten mit Therapieansprechen hatten eine Ansprechdauer von zumindest einem Jahr (Abb. 2).2
Abb. 2: Dauer des Ansprechens unter Naratuximab-Emtansin in Kombination mit Rituximab bei DLBCL (modifiziert nach Levy et al.)2
Darüber hinaus wurden vielversprechende präliminäre Phase-IB/II-Daten zur Kombinationstherapie des bispezifischen CD20/CD3-Antikörpers Mosunetuzumab mit Polatuzumab Vedotin bei 22 Patienten mit r/r B-Zell-Non-Hodgkin-Lymphom (B-NHL: follikuläre Lymphome [FL] oder aggressive NHL, inklusive de novo DLBCL) präsentiert. Bei lediglich zwei Patienten wurde ein „cytokine release syndrome“ (CRS) dokumentiert, beide mit Grad 1 gut beherrschbar. Ansonsten zeigte sich ein akzeptables Nebenwirkunsprofil. Von den 22 Patienten mit im Median drei Vortherapien fand sich bei 15 ein Ansprechen, mit 12 kompletten Remissionen. Wie bereits für die Mosunetuzumab-Monotherapie präsentiert zeigten sich die Remissionen vermutlich anhaltend.3
Ein Update der Daten zur Monotherapie mit bispezifischen CD20/CD3-Antikörpern wurde für Mosunetuzumab4, Epcoritamab5 und Glofitamab6 präsentiert – die Daten zur Effektivität und Toxizität wurden bestätigt und sind äußerst vielversprechend, allerdings sind zur Bestätigung größere Fallzahlen mit längerem Follow-up nötig. Grundsätzlich zeigen sich die bispezifischen Antikörper auch nach Versagen einer CAR-T-Zell-Therapie unabhängig vom Level der CD20-Expression effektiv, ein Ansprechen auf bispezifische Antikörper erscheint in vielen Fällen anhaltend.
CAR-T-Zell-Therapie
Bei der ICML vorgestellte, französische „Real world“-Daten zur CAR-T-Zell-Therapie bei r/r DLBCL bestätigten im Wesentlichen die Effektivitäts- und Toxizitätsdaten aus den Phase-II-Zulassungsstudien und zeigten das Problem der Patientengruppe, die auf eine (nötige) Bridgingtherapie zum Zeitpunkt der Reinfusion progredient war: Beispielsweise lag die Rate des progressionsfreien Überlebens (PFS) nach 6 Monaten bei progredienter Erkrankung vor Tisagenlecleucel (n=100) bei lediglich 17%. Ein klinisch relevanter Unterschied in der Effektivität zwischen den derzeit am Markt verfügbaren Substanzen konnte nicht detektiert werden.7
Gezielte subgruppenspezifische Therapie
Erste randomisierte Phase-II-Daten zu einer Induktionstherapie mit R-CHOP + X je nach genetischem Subtyp (basierend auf den von Schmitz et al. 2018 im „New England Journal of Medicine“ publizierten Subtypen)8 wurden ebenfalls bei der ICML präsentiert: Mit einer CR-Rate von 87% im experimentellen Arm vs. 66% im Standard-R-CHOP-Arm wurde ein signifikanter Vorteil detektiert. Die PFS-Rate nach einem Jahr lag im R-CHOP+X-Arm bei 93%, im Standard-R-CHOP-Arm bei 73%. Nach einem Zyklus R-CHOP erhielten Patienten im experimentellen Arm bei MCD-like oder BN-like Subtyp Ibrutinib + R-CHOP, bei EZB-like Subtyp Tucidinostat + R-CHOP, bei TP53-Mutation Decitabin + R-CHOP, die anderen Patienten erhielten Lenalidomid + R-CHOP.9 Einschränkend ist zu erwähnen, dass hauptsächlich junge und fitte Patienten in die Studie eingeschlossen waren und die größte Patientengruppe Ibrutinib + R-CHOP erhielt. Junge und fitte Patienten profitierten bereits im Phoenix-Trial (Ibrutinib + R-CHOP vs. R-CHOP) deutlich von der Hinzugabe von Ibrutinib, aufgrund der Toxizität bei älteren Patienten konnte für das Gesamtkollektiv kein Vorteil gezeigt werden.10
Covid-19 und B-Zell-Lymphome
Eine retrospektive Analyse von 111 Lymphompatienten mit Covid-19 aus 16 französischen Kliniken zeigte bei 32 Patienten (29%) eine Viruspersistenz länger als einen Monat. 24 Patienten verstarben innerhalb eines Monats. Von 42 Patienten mit DLBCL verstarben 15 innerhalb eines Monats. Ein erhöhtes Risiko für Viruspersistenz und schweren Verlauf fand sich bei Patienten >70 Jahre, bei Patienten mit CD20-Antikörpertherapie innerhalb des letzten Jahres und bei Patienten mit refraktärer Erkrankung.11
Das evidente Problem der Viruspersistenz (und Virusevolution) bei B-Zell-Depletion erfordert ein engmaschiges Monitoring bei Lymphompatienten. Das Problem der Viruspersistenz und die hohe Mortalität unterstreichen die Notwendigkeit der Therapie dieser Patientengruppe an spezialisierten Zentren, gerade bei Patienten mit aggressiven Lymphomen und entsprechend dringender Therapieindikation.
Primäre ZNS-Lymphome
Für die Induktionstherapie bei primären ZNS-Lymphomen (PCNSL) zeigt sich die MTX-basierte Polyimmunchemotherapie MATRix mit konsolidierender Therapie (autologer Stammzelltransplantation [ASCT] oder Ganzhirnbestrahlung [WBRT]) als hocheffektiv: Die OS-Rate nach sieben Jahren liegt bei 70%. Konsolidierend waren ASCT und Ganzhirnbestrahlung gleich effektiv, bei allerdings verminderter kognitiver Funktion nach Ganzhirnbestrahlung. Für die konsolidierende ASCT fand sich keine erhöhte Nicht-Rezidiv-Mortalität oder ein Signal für eine erhöhte Rate an Sekundärmalignomen. Die Induktionstherapie mit MATRIx und konsolidierender ASCT ist Standard für fitte Patientinnen mit PCNSL, die neurokognitive Funktion ist nach konsolidierender ASCT deutlich besser als nach konsolidierender WBRT.12
Literatur:
1 Magnusson T et al.: No difference in overall survival between R-CHOP and R-EPOCH among patients with advanced stage MYC-rearranged, double hit, or triple hit diffuse large B-cell lymphoma. EHA 2021, Abstr. #S224 2 Levy MY et al.: Safety and efficacy of CD37-targeting naratuximab emtansine plus rituximab in diffuse large B-cell lymphoma and other non-Hodgkin’s B-cell lymphomas – a phase 2 study. EHA 2021, Abstr. #LB1903 3 Ghosh N et al.: Promising tolerability and efficacy results from dose-escalation in an ongoing phase Ib/II study of mosunetuzumab with polatuzumab vedotin for relapsed/refractory B-cell non-Hodgkin’s lymphoma. EHA 2021, Abstr. #S222 4 Olszewski A et al.: Mosunetuzumab (MOSUN) monotherapy for elderly/unfit patients (PTS) with first-line diffuse large B-cell lymphoma (DLBCL) continues to show promising safety and efficacy with durable complete responses. EHA 2021, Abstr. #EP503 5 Mous R et al.: Subcutaneous epcoritamab in patients with relapsed/refractory B-cell non-Hodgkin lymphoma: safety profile and anti-tumor activity. EHA 2021, Abstr. #EP499 6 Carlo-Stella C et al.: Glofitamab step-up dosing (SUD): updated efficacy data show high complete response rates in heavily pretreated relapsed/refractory (r/r) non-Hodgkin lymphoma (nhl) patients (pts). EHA 2021, Abstr. #EP501 7 Le Gouill S et al.: First results of DLBCL patients treated with CAR-T cells and enrolled in DESCAR-T registry, aFrench real-life database for CAR-T cells in hematologic malignancies. ICML 2021, Abstr. #084 8 Schmitz R et al.: Genetics and pathogenesis of diffuse large B-cell lymphoma. N Engl J Med 2018; 378(15): 1396-1407 9 Zhang M et al.: Genetic subtype guided rituximab-based immunochemotherapy improves outcome in newly diagnosed diffuse large B-cell lymphoma: first report of a randomized phase 2 study. ICML 2021, Abstr. #062 10 Younes A et al.: Randomized phase III trial of ibrutinib and rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in non-germinal center B-cell diffuse large B-cell lymphoma. JClin Oncol 2019; 37(15): 1285-95 11 Duléry R et al.: High incidence of prolonged COVID-19 among patients with lymphoma treated with B-cell depleting immunotherapy. EHA 2021, Abstr. #21512 Ferreri AJM et al.: MATRIx induction followed by autologous stem cell transplant or whole-brain irradiation in primary CNS lymphoma. 7-year results of the IELSG32 randomized trial. ICML 2021, Abstr. #047
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...