Highlights vom ASCO-Kongress zu den gastroösophagealen Tumoren
Autorin:
Ap. Prof. Priv.-Doz. Dr. Dr. Aysegül Ilhan-Mutlu
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I Medizinische Universität Wien
E-Mail: aysegul.ilhan@meduniwien.ac.at
Der Jahreskongress der American Society of Clinical Oncology (ASCO) fand wieder virtuell statt. Obwohl überwiegend Studien zur Immuntherapie präsentiert wurden (CheckMate-648, CheckMate-649, CheckMate-577, ESCORT-1st usw.), wurden auch Daten zur zielgerichteten Therapie, darunter die Studien KEYNOTE-811 und FIGHT, vorgelegt. Dieser kurze Artikel zielt darauf ab, einige praxisverändernde Abstracts zum Bereich der gastroösophagealen Tumore zusammenzufassen, die auf dem ASCO-Kongress 2021 präsentiert wurden, und eine Perspektive zu geben, wie die Daten in unserer täglichen klinischen Praxis umgesetzt werden könnten.
Keypoints
-
Nivolumab + Chemotherapie ist eine sichere und relevante Option für die Erstlinienbehandlung von Patienten mit fortgeschrittenem oder metastasiertem ESCC und TPS ≥1%.
-
Die FDA hat Nivolumab bereits als adjuvante Behandlung für Patienten mit reseziertem EC/GEJC zugelassen, die eine neoadjuvante CRT mit pathologischer Resterkrankung sowohl für Adenokarzinom- als auch für ESCC-Patienten erhielten. Eine Zulassung durch die EMA wird in den nächsten Monaten erwartet.
-
Die Wirksamkeit von Nivolumab + Chemotherapie bei Patienten mit einem CPS <5 mit fortgeschrittenem oder metastasiertem EC/GEJ und Adenokarzinom des Magens ist nach wie vor umstritten. Hier werden längere Follow-ups nötig sein.
Ösophaguskarzinom und Tumoren des gastroösophagealen Übergangs
Plattenepithelkarzinom des Ösophagus (ESCC)
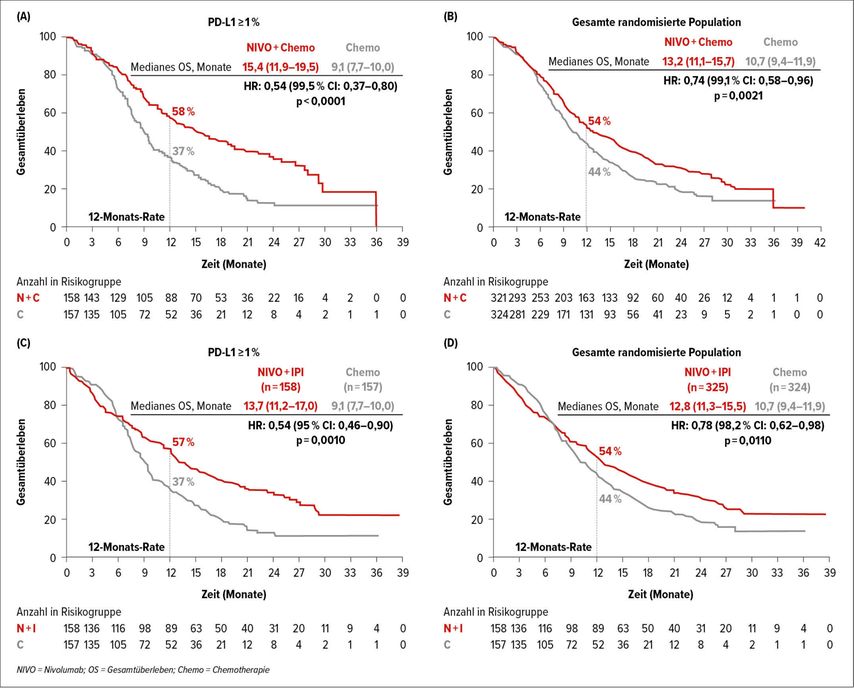
Die CheckMate-648-Studie1 randomisierte 970 Patienten mit Stadium IV ESCC in den nachfolgenden Armen: 1. Nivolumab + Chemotherapie q2w mit Fluorouracil und Cisplatin q4w; 2. Nivolumab mit 3mg/kg q2w plus Ipilimumab mit 1mg/kg q6w; 3. alleinige Chemotherapie. Die ko-primären Endpunkte waren das Gesamtüberleben (OS) und das progressionsfreie Überleben (PFS) bei Patienten mit einer Tumorzell-PD-L1-Expression („tumorproportion score“, TPS) ≥1%. Diese Gruppe hatte eine starke statistisch signifikante Verlängerung des OS mit Nivolumab + Chemotherapie im Vergleich zu Chemotherapie allein, und zwar 15,4 vs. 9,1 Monate (HR:0,54; 99,5% CI:0,37–0,80; p<0,0001). Ein signifikanter Überlebensvorteil wurde für den Nivolumab-Ipilimumab-Arm im Vergleich zur alleinigen Chemotherapie gezeigt, jedoch waren die numerischen OS-Raten niedriger und es gab ein Cross-over der Überlebenskurven nach sechsmonatiger Behandlung, was darauf hindeutet, dass die Krankheit bei Patienten unter Nivolumab-Ipilimumab-Behandlung schnell fortschreitet (OS=13,2 vs. 10,7 Monate, HR:0,64; 99,5% CI: 0,46–0,90; p=0,001) (Abb. 1). Laut Subgruppenanalyse schienen Patienten mit negativem TPS von Immuntherapie + Chemotherapie nur sehr geringfügig zu profitieren. Daher werden uns weitere Untersuchungen, einschließlich der positiven Combined-Score-Analyse (CPS), mehr Informationen über die geeignete Patientenauswahl liefern. Darüber hinaus gab das Cross-over der Überlebenskurven für den Nivolumab-Ipilimumab-Arm Anlass zu kritischen Bedenken, da es definitiv einer weiteren Erklärung bedürfe, welche Patienten unter diesem chemotherapiefreien Regime besonders früh eine Progression erlitten. Mit den verfügbaren Daten ist es gerechtfertigt, darauf hinzuweisen, dass Nivolumab + Chemotherapie eine sichere und relevante Option für die Erstlinienbehandlung von Patienten mit fortgeschrittenem oder metastasiertem ESCC und TPS ≥1% ist.
Abb. 1: Kaplan-Meier-Kurven der CheckMate-648 Studie. A) Nivolumab + Chemotherapie vs. Chemotherapie-Mono für TPS ≥ 1; B) Nivolumab + Chemotherapie vs. Chemotherapie-Mono für die gesamte Kohorte; C) Nivolumab + Ipilimumab vs. Chemotherapie-Mono für TPS ≥ 1; D) Nivolumab + Ipilimumab vs. Chemotherapie-Mono für die gesamte Kohorte (nach Chau I et al.)1
Resektables Ösophaguskarzinom und Tumor des gastroösophagealenÜbergangs
Es gab auch Highlights zu resektablen Ösophaguskarzinomen („esophageal cancer“, EC) und Tumoren des gastroösophagealen Übergangs („gastroesophageal junction cancer“, GEJC). In der CheckMate-577-Studie2 zeigte Nivolumab eine signifikante und klinisch bedeutsame Verlängerung des krankheitsfreien Überlebens (DFS; primärer Endpunkt) gegenüber Placebo (22,4 vs. 11,0 Monate; HR:0,69; 96,4% CI: 0,56–0,86; p=0,0003) und wurde von Patienten mit reseziertem (R0) Stadium II/III EC/GEJC, die eine neoadjuvante Radiochemotherapie erhielten und einen pathologischen Residualtumor aufwiesen, gut vertragen. Auf dem ASCO-Kongress wurden aktualisierte Überlebensanalysen in Bezug auf das fernmetastasenfreie Überleben (DMFS) und PFS2 demonstriert. Das mediane DMFS betrug 28,3 vs. 17,6 Monate mit Nivolumab vs. Placebo (HR: 0,74; 95% CI: 0,60–0,92). Das mediane PFS2 wurde mit Nivolumab im Vergleich zu 32,1 Monaten mit Placebo nicht erreicht (HR: 0,77; 95% CI: 0,60–0,99). Die FDA hat Nivolumab bereits als adjuvante Behandlung für Patienten mit reseziertem EC/GEJC zugelassen, die eine neoadjuvante CRT mit pathologischer Resterkrankung sowohl für Adenokarzinom- als auch für ESCC-Patienten erhielten.
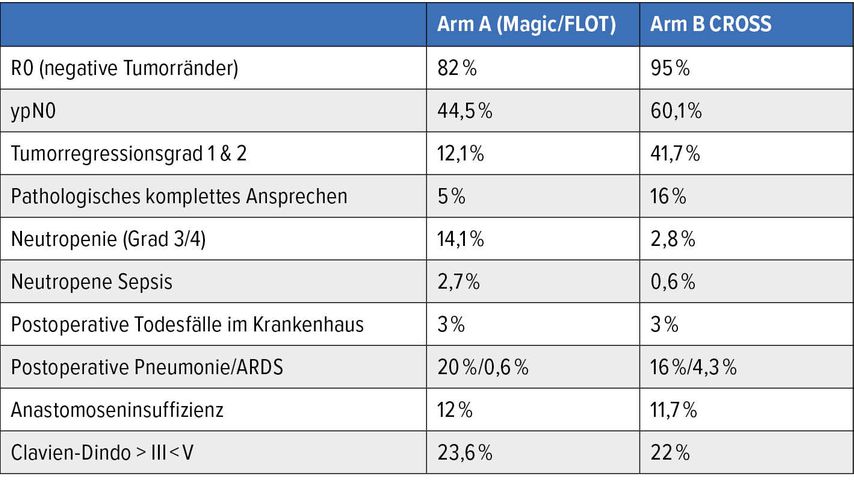
Es ist jedoch umstritten, welche neoadjuvante Behandlungsoption für EC- und GEJC-Patienten optimal ist. Ein weiteres Highlight der ASCO 2021 war die Neo-AEGIS-Studie3, die diese Frage beantworten sollte und Patienten mit EC/GEJC entweder zu neoadjuvantem CROSS (Carboplatin/Paclitaxel, 41,4Gy Strahlentherapie) oder zu einer perioperativen Chemotherapie basierend auf dem MAGIC-Schema (Epirubicin, Cisplatin/Oxaliplatin, 5-FU/Capecitabin) und neuerdings auf dem FLOT-Schema (Docetaxel, 5-FU, Leucovorin, Oxaliplatin) randomisierte. Von 362 Patienten erhielten 178 CROSS und 184 MAGIC/FLOT (157/27), 90% waren männlich, 84% hatten cT3 und 58% hatten cN1 (Tab. 1). Die Überlebensraten waren in beiden Gruppen ähnlich. Die Autoren kamen zu dem Schluss, dass diese Studie keinen Beweis dafür erbrachte, dass die perioperative Chemotherapie der multimodalen Therapie mit CROSS inakzeptabel unterlegen ist. Hervorzuheben ist jedoch die Wahl des Chemotherapie-Arms des MAGIC-Protokolls (83%), der nach der Veröffentlichung der FLOT-Daten nicht mehr als Standard gilt. Gemäß der histopathologischen Regressionsanalyse der FLOT-Studie liegt die pCR-Rate des FLOT-Arms bei 16%, während die im EOX-Arm der Neo-AEGIS-Studie mit nur 5% angegeben wurde, was darauf hindeutet, dass die lokale Krankheitskontrolle des Chemotherapie-Arms (überwiegend EOX) der Neo-AEGIS-Studie der derzeit angewandten Standardbehandlung (FLOT) deutlich unterlegen ist. Die ESOPEC-Studie hat ein ähnliches Design wie die NEO-AEGIS-Studie, jedoch mit dem FLOT-Schema als Chemotherapie-Arm, der hoffentlich in den nächsten Jahren mehr klinisch relevante Daten liefern wird.
Magen-/GEJ-Tumore
Nach Vorstellung der CheckMate-649-Studie wurde Nivolumab + Chemotherapie bei Patienten mit einem CPS ≥5 mit fortgeschrittenem oder metastasiertem EC/GEJC und Adenokarzinom des Magens zum Standard. Allerdings war seitdem umstritten, ob Patienten mit einem CPS <5 einen Nutzen daraus ziehen oder nicht. Dennoch hat die FDA diese Behandlungskombination bei allen Patienten mit fortgeschrittenem gastroösophagealem Adenokarzinom unabhängig vom CPS zugelassen. Am ASCO-Kongress 2021 gaben Moehler et al.4 einen kurzen Hinweis zur Wirksamkeit von Nivolumab bei Patienten mit einem CPS <1 und <5. Den Subgruppenanalysen zufolge scheinen die Überlebenszeiten zwischen Nivolumab-Chemotherapie-Arm und Chemotherapie-Mono sehr ähnlich zu sein, was darauf hindeutet, dass der Nutzen von Nivolumab, der in der gesamten Patientenpopulation beobachtet wurde, hauptsächlich von den Patienten mit einem CPS ≥5 abgeleitet wird. Die Autoren betonten die bessere Gesamtansprechrate (ORR) im Nivolumab-Chemotherapie-Arm, die bei längerer Nachbeobachtung zu einem verlängerten OS führen könnte. Die Entscheidung der Europäischen Arzneimittel-Agentur (EMA) wird abgewartet.
Seit der Veröffentlichung der TOGA-Studie gab es einen großen Versuch, mit verschiedenen Wirkstoffen oder Kombinationen auf den humanen epidermalen Wachstumsfaktor-Rezeptor 2 (HER2) abzuzielen, der leider keine Wirksamkeit zeigte. KEYNOTE-8115 ist eine Phase-III-Studie, in der Patienten mit HER2-positivem metastasierendem Magen- oder GEJ-Tumor entweder zu Pembrolizumab + Behandlungsstandard (SOC, Anti-HER2 und Chemotherapie) oder Placebo + SOC randomisiert wurden. Die ORR betrug 74,4% (95% CI: 66,2–81,6) für Pembrolizumab + SOC vs. 51,9% (43,0–60,7) für Placebo + SOC (Unterschied 22,7 Prozentpunkte, p=0,0006). Die Autoren kamen zu dem Schluss, dass die Zugabe von Pembrolizumab zu SOC als Erstlinienbehandlung bei HER2 + metastasierendem Magen-/GEJ-Karzinom zu einem erheblichen, statistisch signifikanten Anstieg der ORRführte; die Ansprechraten waren dauerhaft und die Verträglichkeit war überschaubar. Die FDA hat Pembrolizumab in dieser Subpopulation von Patienten basierend auf dieser im Protokoll festgelegten ersten interimistischen Analyse zugelassen.
Bereits auf dem ASCO-GI-Kongress 2021 feierte die zielgerichtete Therapie mit der FIGHT-Studie ihr Comeback. FIGHT6 ist eine internationale Phase-II-Studie, an der Patienten mit fortgeschrittenen oder metastasierten gastroösophagealen Tumoren teilnahmen, deren Tumor den Fibroblasten-Wachstumsfaktor-Rezeptor 2b (FGFR2b) exprimiert. FGFR2b wurde entweder mit Immunhistochemie (IHC) oder mit ctDNA untersucht. Die Patienten wurden mit mFOLFOX6 behandelt und zu Bemarituzumab, einem monoklonalen Antikörper gegen FGFR2b, randomisiert. Von den 155 Patienten waren 149 (96%) FGFR2b+ nach IHC, 26 (17%) nach ctDNA und 20 (13%) nach beiden. Der Bemarituzumab-Arm hatte ein medianes OS von 19,2 Monaten (95% CI: 13,6 bis nicht erreicht) vs. 13,5 Monate (95% CI: 9,3–15,9) für Placebo (HR: 0,60; 95% CI: 0,38–0,94) für die Intention-to-treat-Population; bei Patienten mit FGFR2b+ ≥10% nach IHC betrug das mediane OS für Bemarituzumab 25,4 Monate (95% CI: 13,8 bis nicht erreicht) vs. 11,1 Monate (95% CI: 8,4–13,8) für Placebo (HR: 0,41; 95% CI: 0,23–0,74). Eine Phase-III-Studie, die dieselbe Hypothese testet, wurde bereits eingeleitet.
Das Design der FIGHT-Studie umfasste einige sehr interessante Merkmale, die die Wissenschaftler hoffentlich bei der Gestaltung zukünftiger klinischer Studien inspirieren werden.
-
Die Patienten durften während der Screening-Phase einmal eine mFOLFOX-Behandlung erhalten, was dazu beitrug, die Patientenrekrutierung zu erhöhen und den Patienten die Standardbehandlung ohne Zeitverzögerung anzubieten.
-
Die Biomarker-Analyse umfasste sowohl IHC als auch ctDNA, um die geeignete Subgruppe von Patienten, die von der Behandlung profitieren könnten, präziser auszuwählen.
-
Überlebensanalysen wurden nicht nur zur Positivität von FGFR2b, sondern auch zu den unterschiedlichen Cut-offs der Zellpositivität von FGFR2b berichtet.
Literatur:
1 Chau I et al.: Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): First results of the CheckMate 648 study. ASCO 2021, Abstr. #4001 2 Kelly RJ et al.: Adjuvant nivolumab (NIVO) in resected esophageal or gastroesophageal junction cancer (EC/GEJC) following neoadjuvant chemoradiotherapy (CRT): Expanded efficacy and safety analyses from CheckMate 577. ASCO 2021, Abstr. #4003 3 Reynolds JV et al.: Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Preliminary results of phase III RCT of CROSS versus perioperative chemotherapy (Modified MAGIC or FLOT protocol). ASCO 2021, Abstr. #4004 4 Moehler MH et al.: First-line (1L) nivolumab (NIVO) plus chemotherapy (chemo) versus chemo in advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): Expanded efficacy and safety data from CheckMate 649. ASCO 2021, Abstr. #4002 5 Janjigian JJ et al.: Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction (G/GEJ) cancer: Initial findings of the global phase 3 KEYNOTE-811 study. ASCO 2021, Abstr. #4013 6 FIGHT: A randomized, double-blind, placebo-controlled, phase II study of bemarituzumab (bema) combined with modified FOLFOX6 in 1L FGFR2b+ advanced gastric/gastroesophageal junction adenocarcinoma (GC). ASCO 2021, Abstr. #4010
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...