Hämatologie: die Highlights 2022
Bericht:
TÄ Ingeborg Morawetz, MA
Therapien entsprechend molekularer Risikoeinschätzung, hochspezifische Prognosen ohne Biopsien und neue Chancen für alte Wirkstoffkombinationen – auf der Frühjahrstagung 2022 der Österreichischen Gesellschaft für Hämatologie & Medizinische Onkologie (OeGHO) und der Arbeitsgemeinschaft hämatologischer und onkologischer Pflegepersonen (AHOP) wurden die aktuellen Forschungshighlights der Hämatologie vorgestellt.
Priv.-Doz. DDr. Katharina Prochazka von der Klinischen Abteilung für Hämatologie der Medizinischen Universität Graz präsentierte in einem „Best of Hämatologie“ die jüngsten Forschungserfolge der Hämatologie. Den Einstieg in das umfangreiche Thema gestaltete sie optimistisch: Trotz der Pandemie seien in den letzten zwei Jahren allein in Österreich zum Thema Hämatologie 1535 wissenschaftliche Arbeiten in über 500 Journalen erschienen.1,2
Dass der Fachbereich sich also auch von einer globalen Gesundheitskrise nicht einschränken lässt, trägt zu einer reichen Datenlage bei. Über Priv.-Doz. Prochazkas ausgewählte Highlights der Hämatologie 2022 können Sie sich in diesem Artikel informieren.
Akute myeloische Leukämie
Nach einer Phase relativer Ruhe gibt es im Bereich der Therapie der akuten myeloischen Leukämie (AML) inzwischen Neues zu berichten. Weiterhin mit dem Ziel der kompletten Remission (CR) erweitert sich der Fokus von der Hochdosis-Induktionstherapie auf die Immuntherapie.
Je nach Belastungsstufe der Patient*innen können so individuell geeignete Therapiekonzepte umgesetzt werden. Zur Auswahl stehen unter anderem Kinaseinhibitoren, IDH-Inhibitoren und der BCL-2-Hemmer Venetoclax. Die Kombination Venetoclax/Azacitidin (Ven/Aza) erzielt ausgezeichnete Remissionsraten bei Patient*innen, die körperlich kaum oder weniger belastbar sind.3,4,5
Um die komplette Remission nach der allogenen Stammzelltherapie, dem Goldstandard für körperlich fitte Patient*innen, zu erhalten, wurden die bisherigen Erhaltungstherapien nun auch um orales Azacitidin für genetische Risikogruppen und ältere Patient*innen erweitert.6–8
Eine wichtige Erkenntnis konnte zu der Frage gewonnen werden, warum die seltenen Fälle von Patient*innen, die eine CR von über fünf Jahren aufweisen („long first remission“ [LFR]), auch insgesamt ein besseres klinisches Outcome zeigen. Neben Unterschieden in Stammzellmarkern und immunphänotypischen Spezifika konnte nachgewiesen werden, dass bei Patient*innen mit LFR die T-Zellen keine Erschöpfung in Form einer verminderten Anzahl von CD4+ TH1-Zellen aufweisen.
Bei einem simulierten Relaps reagierten ihre T-Zellen schnell und effizient, während die der Patient*innen mit einem ereignisfreien Überleben von unter zwei Jahren (SFR) herunterreguliert wurden. Die immunsuppressive Qualität von AML scheint bei LFR-Patient*innen höher zu sein als bei SFR-Patient*innen.9
Myelodysplastisches Syndrom
Beim myelodysplastischen Syndrom (MDS) gibt es sowohl in der Risikostratifizierung als auch in der Therapie Neuerungen.
Das bisherige revidierte internationale prognostische Punktesystem (IPSS-R) zur Risikostratifizierung wurde 2021 von IPSS-M abgelöst. Dieses weiterentwickelte Punktesystem umfasst nun auch den binären Mutationsstatus von 22 prädiktiven Genen und die Zahl der Mutationen aus einer Gruppe von 17 Genen. Bei der Untersuchung in Validierungskohorten konnte belegt werden, dass das leukämiefreie Überleben, das Gesamtüberleben (OS) und die Transformationswahrscheinlichkeit mit dem IPSS-M besser vorausgesagt werden können als mit dem IPSS-R. Bei bereits eingestuften Patient*innen sollte demnach eine erneute Risikostratifizierung mit dem verbesserten Score erfolgen.10
Therapeutisch gibt es neue Ansätze beim Low-Risk- und High-Risk-MDS. Beim Low-Risk-MDS haben sich Patient*innen bisher als nicht empfänglich für Erythropoietin-stimulierende Wirkstoffe gezeigt. Mit Imetelstat wurde ein kompetitiver Telomeraseinhibitor untersucht, der Patient*innen in aktuellen Studien teilweise transfusionsunabhängig macht und zu einem längeren transfusionsfreien Überleben führt.11
Beim High-Risk-MDS zeigt sich ein klarer Vorteil im OS beim Einsatz der Kombinationstherapie Ven/Aza, das mit einem raschen molekularen Ansprechen einhergeht.12–15 Nach Dr. Prochazkas Einschätzung wird diese Kombination in die Guidelines aufgenommen werden.
Chronische myeloproliferative Erkrankungen
Auch bei den chronischen myeloproliferativen Erkrankungen (CMPE) konnte mit neuen Erkenntnissen gepunktet werden. In einer Studie wurde der Einfluss der JAK2-V617F-Punktmutation auf die hämatopoietischen Stammzellen untersucht. Es wurde gezeigt, dass die Mutation Dekaden vor der Diagnose entsteht und zu einem Fitnessstatusvorteil der mutierten Zellen führt.16
Therapeutisch wurde der STAMP-Inhibitor Asciminib in der ASCEMBL-Studie gegen den Tyrosinkinase-Inhibitor (TKI) Bosutinib getestet. Inkludierte Patient*innen blickten auf zwei Therapien mit TKI und ein Nicht-Ansprechen auf diese zurück. Bei Asciminib wiesen sie in der Studie ein gutes Ansprechen und ein gutes molekulares Ansprechen (MMR) in Woche 24 auf. Im Vergleich zu Bosutinib war es sogar doppelt so hoch. Dr. Prochazka vermutet, dass der STAMP-Inhibitor für bestimmte Patient*innengruppen mit CMPE die „Therapie der Zukunft“ sein könnte.17,18
Multiples Myelom
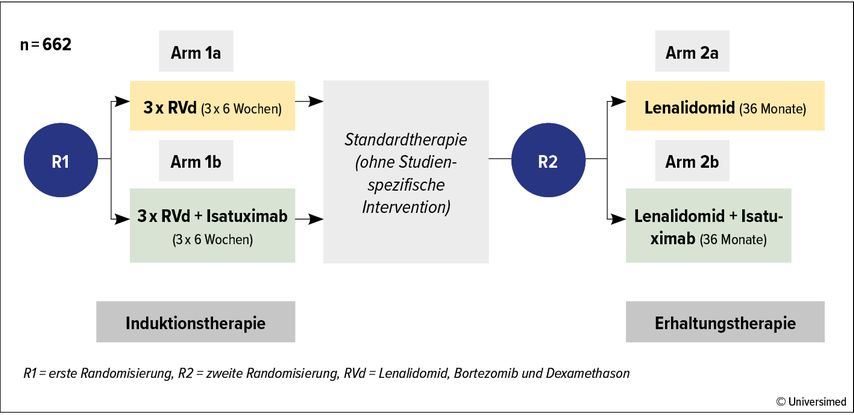
Unter allen hämatologischen Erkrankungen gibt es die meisten berichtenswerten Erfolge beim multiplen Myelom (MM). Am bedeutendsten sind hier die Vierfachtherapie in Erstlinie bei Patient*innen, die für eine Transplantation qualifizieren, und ein neuer Therapieansatz in der Rezidivtherapie.
Für die Quadrupeltherapie mit Daratumumab wurde in der GRIFFIN-Studie die Grundlage RVd (Lenalidomid, Bortezomib und Dexamethason) und in der MASTER-Studie die Grundlage KRd (Carfilzomib, Lenalidomid und Dexamethason) gewählt. In beiden Studien zeigten sich hohe Ansprech- und CR-Raten für den Interventionsarm. In der MASTER-Studie hatte die Kombination für „Ultra high risk“-Myelome jedoch nur einen verminderten Erfolg.19–22
Isatuximab und RVd erbrachten in der GMMG-HD7-Studie die besten Ergebnisse unter allen MM-Quadrupeltherapien (Abb. 1).20–23 Die Kombination von Elotuzumab und RVd hingegen zeigte in der SWOG-1211-Studie keinen Vorteil gegenüber der Tripeltherapie.19
Als neue Rezidivtherapie bei multipel vortherapierten Patient*innen konnte sich mit guten Ansprechraten und verlängertem progressionsfreiem Überleben (PFS) und OS der bispezifische Antikörper Teclistamab beweisen.23,24
Akute lymphatische Leukämie
Eine ausschlaggebende Entwicklung gibt es bei der akuten lymphatischen Leukämie (ALL) in der Diagnostik, während die Erfolge in der Therapie zu vernachlässigen sind.
Das bisherige diagnostische Spektrumder ALL wird mit den neuen Methoden „whole genome sequencing“ und „whole transcriptome sequencing“ nicht nur erweitert, sondern der Diagnoseweg im Idealfall auch vereinfacht. Statt einer Kombination mehrerer Analysen könnte in Zukunft das Durchführen nur einer der neuen Analysen gleichwertige Ergebnisse bringen und so zu Zeitersparnis, Fehlerreduktion und einer möglichen Automatisierung führen.25 Therapeutisch konnte mit der GMALL-Studie 2021 im Vergleich zu den EFS(Ereignisfreies-Überleben)-Ergebnissen von 2003 trotz schlechten Ansprechens bei Nelarabin und Blinatumomab eine Verbesserung erzielt werden. Auch die OS-Rate war mit 87% nach drei Jahren bei Patient*innen zwischen 18 und 25 Jahren erhöht. Der Subtyp spielt hierbei keine Rolle.26
Diffus großzelliges B-Zell-Lymphom
Beim diffus großzelligen B-Zell-Lymphom (DLBCL) und auch beim ZNS-Lymphom (CNSL) konnte zur Diagnostik und Prognostik die Messung zirkulierender Tumor-DNA (ctDNA) herangezogen werden. Sie zeigte nicht nur eine hohe Sensitivität und Spezifität, sondern korrelierte auch mit dem radiografischen Tumorvolumen. Im Therapieverlauf kann sie als prognostischer Biomarker verwendet werden. Ein weiterer Vorteil ist der mögliche Verzicht auf Biopsien.27,28
Therapeutisch kündigt sich mit der POLARIX-Studie ein möglicher Paradigmenwechsel an. Die alte R-CHOP(Rituximab-Cyclophosphamid-Doxorubicin-Vincristin-Prednisolon)-Therapie könnte als Pola-R-CHP endlich Eingang in die Guidelines finden. In einem Arm ergänzt um Polatuzumab-Vedotin führte sie zu ausgezeichneten Ansprechraten, einer Reduktion des Risikos für Progress, Rezidiv oder Tod um 27% (HR: 0,73 [95% CI: 0,57–0,95; p=0,02]) und zu einem Vorteil in der PFS-Rate von 6,5% nach 24 Monaten (76,7% [95% CI: 72,7–80,8] vs. 70,2% [95% CI: 65,8–74,6]). Über 85% der Patient*innen konnten ihre Therapie zu Ende bringen. Das OS ist nach zwei Jahren noch nicht signifikant unterschiedlich. Wegen überlappender Neurotoxizität wurde Vincristin in der neuen Kombination ausgespart.29
Indolente Lymphome/chronische lymphatische Leukämie
Die Studie CLL13 untersucht, ob die Chemoimmuntherapie bei der chronischen lymphatischen Leukämie (CLL) wirklich bereits ihre Grenzen erreicht hat. Während Venetoclax-basierte Schemata grundsätzlich deutliche Vorteile für die minimale Resterkrankung (MRD)zeigen, können solche Vorteile bei Kombination mit Rituximab nicht beobachtet werden. Die besten Ergebnisse auch im Bereich des PFS erzielte möglicherweise die Kombination Venetoclax-basierter Schemata mit Obinutuzumab. Definitive Aussagen können erst im Laufe des Jahres getroffen werden.30
Die Therapie des follikulären Lymphoms könnte mit dem Einsatz bispezifischer Antikörper revolutioniert werden. Mosunetuzumab, ein Antikörper mit CD3- und CD20-Bindungsstellen, wurde im relapsierten refraktären Setting getestet. Er zeigte hervorragende Ansprechraten mit bis zu 78,9% CR. Glofitamab brachte ähnliche Ergebnisse. Eine Kombination beider Antikörper ist möglich. Fixe Dosierungen und einfache Einnahme erleichtern bei beiden die Anwendung. Das Zytokin-Freisetzungssyndrom konnte durch Lenalidomid-Zugabe und eine Step-up-Dosierung signifikant gemindert werden.31,32
CAR-T-Zell-Therapie
Als möglicher neuer Standard in der Hämatologie finden Chimäre-Antigenrezeptor-T-Zellen (CAR-T-Zellen) bei vielen verschiedenen Erkrankungen Anwendung. Beim DLBCL sind sie sogar schon in den Guidelines angekommen.
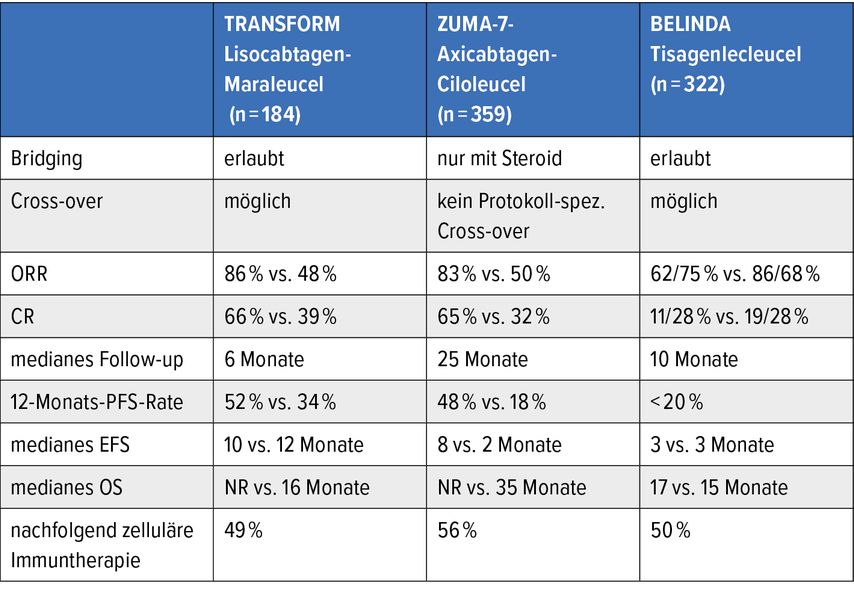
In drei großen Studien, namentlich ZUMA-7, BELINDA und TRANSFORM, wurde nun untersucht, ob CAR-T-Zell-Therapie die Stammzelltransplantation unter bestimmten Umständen ersetzen könnte (Tab. 1). Zielgruppe sind unter zwölf Monaten relapsierte oder nach Erstlinientherapie refraktäre Patient*innen mit aggressivem Non-Hodgkin-Lymphom, die für eine autologe Stammzelltransplantation (ASCT) infrage kommen.33–35
Tab. 1: Vergleich der TRANSFORM-, ZUMA-7- und BELINDA-Studien. Modifiziert nach Priv.-Doz. DDr. Katharina Prochazka
In der ZUMA-7-Studie mit Axicabtagen-Ciloleucel und der TRANSFORM-Studie mit Lisocabtagen-Maraleucel konnten im Vergleich zu ASCT Vorteile in der CR (65% vs. 32% und 66% vs. 39%) und der Gesamtansprechrate (ORR, 83% vs. 50% und 86% vs. 48%) nachgewiesen werden. Tisagenlecleucel in der BELINDA-Studie brachte keine solchen Vorteile.33–35
Dennoch kann die zelluläre Immuntherapie bereits als Drittlinientherapie eingeplant werden. Es ist zudem denkbar, dass sie bei bestimmten Patient*innengruppen sogar schon als Zweitlinientherapie zum Einsatz kommen könnte.
Quelle:
OeGHO- & AHOP-Frühjahrstagung 2022, „Best of“ Hämatologie, Priv.-Doz. DDr. Katharina Prochazka
Literatur:
1 Webofscience: Datenabfrage 26.3.2022 2 OeGHO, Österreichische Krebshilfe: Österreichischer Krebsreport 2021. Wien: MedMedia Verlag 2022 3 Pollyea D et al.: Bone Marrow Transplant 2022; 57(2): 160-6 4 DiNardo CD et al.: J Clin Oncol 2021; 39(25): 2768-78 5 Chen EC et al.: Am Soc Hematol Educ Program 2020; 1: 41-50 6 Wei A et al.: N Engl J Med 2020; 383: 2526-37 7 Roboz GJ et al.: Blood 2022; 139: 2145-55 8 Döhner H et al.:EHA 2021; Abstract #S131 9 Ferraro F et al.: Medical Science 2021; 118(45): 118 (49) e2116427118 10 Bernard E et al.: ASH 2021; Abstract #61 11 Steensma DP et al.: J Clin Oncol 2021; 39(1): 48-56 12 Komrokji RS et al.: ASH 2021; Abstract #536 13 Bazinet A et al.: Blood 2021; 138(Supplement 1): 535 14 Zeidan AM et al.: ASH 2021; Abstract #537 15 Garcia JS et al.: ASH 2021; Abstract #241 16 Van Egeren D et al.: Cell Stem Cell 2021; 28: 514-23 17 Réa D et al.: Blood 2021; 138(21): 2031-41 18 Mauro MJ et al.: ASH 2021; Abstract #310 19 Usmani SZ et al.: Lancet Haematol 2021; 8(1): e45-5 20 Goldschmidt H et al.: ASH 2021; Abstract #463 21 Costa L et al.: ASH 2021; Abstract #481 22 Laubach JP et al.: ASH 2021; Abstract #79 23 Usmani SZ et al.: Lancet 2021; 398(10301): 665-74 24 Moreau P et al.: ASH 2021; Abstract #896 25 Haferlach C et al.: ASH 2021; Abstract #273 26 Gökbuget N et al.: ASH 2021; Abstract #362 27 Scherer F et al.: ASH 2021; Abstract #6 28 Meriranta L et al.: Blood 2022; 139(12): 1863-77 29 Tilly H et al.: N Engl J Med 2021; 386(4): 351-63 30 Eichhorst B et al.: ASH 2021; Abstract #71 31 Budde E et al.: ASH 2021; Abstract #127 32 Morschhauser F et al.: ASH 2021; Abstract #128 33 Locke FL et al.: N Engl J Med 2022; 386(7): 640-54 34 Bishop MR et al.: N Engl J Med 2021; 386: 629-39 35 Kamdar M et al.: ASH 2021; Abstract #91
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...