Haben Tumorvakzine (noch) eine Zukunft?
Bericht:
Dr. Therese Schwender
Vom aktuellen Stand der Entwicklung bei Tumorvakzinen über die Sinnhaftigkeit einer Kombination von Radio- und Immuntherapie bis hin zum Einsatz neuer Immuntherapeutika beim Lungenkarzinom und Melanom – der ESMO Immuno-Oncology Congress 2022 deckt die vielfältigen Interessen all jener ab, die sich für diesen rasant wachsenden Bereich der Onkologie interessieren.
Das breitgefächerte Programm des Kongresses beinhaltete unter anderem zwei „Controversy Sessions“. In der ersten wurde die Frage diskutiert, ob Tumorvakzine noch eine Zukunft haben. Denn obwohl Impfstoffe die Behandlung von Krebserkrankungen grundlegend verändern könnten, haben die Ergebnisse der bisher durchgeführten klinischen Studien nicht die Erwartungen erfüllt, mit denen sie gestartet wurden. Es ist daher nicht verwunderlich, dass am therapeutischen Potenzial von Krebsimpfstoffen gezweifelt wird. „Auch wenn es noch viele Hürden zu überwinden gilt, glaube ich, dass die Geschichte der Krebsimpfstoffe noch lange nicht zu Ende ist“, erklärte jedoch Prof. Stephen P. Schoenberger, La Jolla/USA.
Zielantigene identifizieren und validieren
Eine der dringlichsten Aufgaben bestehe aktuell darin, geeignete Zielantigene zu identifizieren und, was besonders wichtig ist, sie zu validieren. Derzeit liegt der Schwerpunkt auf Tumoren, die auf eine Checkpoint-Blockade ansprechen und die eine hohe Mutationslast aufweisen. Mit Verbesserungen bei der Auswahl der Zielantigene sollte es möglich sein, den Anwendungsbereich auf Tumoren mit geringerer Mutationslast auszuweiten, die derzeit nicht auf Checkpoint-Inhibitoren ansprechen und für die es nur wenige Behandlungsmöglichkeiten gibt. „Außerdem müssen wir bestimmen können, welche Patienten am ehesten einen klinischen Nutzen haben. Es gibt aktuell noch keine bestätigten Biomarker, aber unsere Gruppe hat Signale entdeckt, die darauf hindeuten, dass Tiefe, Breite und Ausmaß der bereits vorhandenen Neoantigen-spezifischen T-Zell-Antwort bei einem bestimmten Patienten oder einer Patientin eine hervorragende Möglichkeit zur Vorhersage des Ansprechens auf die Checkpoint-Blockade und auf Krebsimpfstoffe sein könnten“, führte er aus.
Ebenfalls noch zu klären gilt es, in welchem Krankheitsstadium Impfstoffe am besten wirken. „Es ist wahrscheinlich, dass in erster Linie Erkrankte geimpft werden, bei denen die Erst- oder Folgetherapien versagt haben“, so Prof. Schoenberger. In diesem Setting eine Wirkung zu erzielen, sei für jede Art der Behandlung eine Herausforderung. „Ich denke, dass wir in den nächsten Jahren immer mehr ermutigende Daten über Krebsimpfstoffe sehen und signifikante und relevante Fortschritte machen werden, mit deren Hilfe es uns möglich sein wird, das Potenzial dieser Art der Therapie zu nutzen und die Behandlungsresultate für die Patientinnen und Patienten zu verbessern.“
Kombination von Radio- und Immuntherapie sinnvoll?
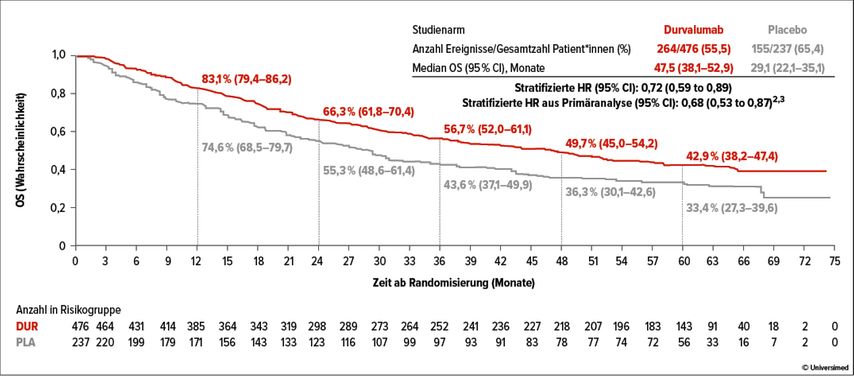
Die zweite„Controversy Session“ befasste sich mit der Frage, ob die Kombination einer Radio- mit einer Immuntherapie sinnvoll ist. Wie Prof. Dr. Jean-Pascal Machiels, Brüssel, erklärte, gibt es eine gute präklinische Rationale für die Kombination von Radiotherapie (RT) und Immuntherapie. „Die Radiotherapie kann wie ein Impfstoff wirken, der Tumorantigene freisetzt und das Immunsystem gegen den Tumor stimuliert, wodurch die Wirkung von Checkpoint-Inhibitoren auf die T-Zell-Reaktion verstärkt wird“, erläuterte er. Die bisherigen Ergebnisse aus randomisierten klinischen Studien sind jedoch nicht eindeutig. Einerseits gibt es positive Beispiele, wie die Phase-III-Studie PACIFIC, in der nachgewiesen wurde, dass die Verabreichung von Durvalumab nach einer Chemoradiotherapie (CRT) bei Patientinnen und Patienten mit einem nicht resezierbaren nichtkleinzelligen Lungenkarzinom (NSCLC) im Stadium III zu einem langfristigen Vorteil beim progressionsfreien und beim Gesamtüberleben führte (Abb. 1).1 Andererseits hat eine Reihe von Studien bei Kopf- und Halstumoren, bei denen verschiedene Kombinationen von CRT, RT oder RT + Cetuximab mit PD-(L)1-Inhibitoren eingesetzt wurden, ihre primären Endpunkte nicht erreicht. Ein Beispiel dafür ist die Phase-III-Studie KEYNOTE-412, die bei Patienten mit nicht vorbehandelter, lokal fortgeschrittener Erkrankung keinen signifikanten Vorteil für das ereignisfreie Überleben (EFS) zeigte, wenn der PD-1-Inhibitor Pembrolizumab zusätzlich zur CRT, gefolgt von einer Pembrolizumab-Monotherapie, eingesetzt wurde.2„Zwischen der PACIFIC-Studie und Keynote-412 gibt es jedoch einige auffallende Unterschiede in der Art und Weise, wie die Behandlung verabreicht wurde“, betonte Prof. Machiels. So wurde in der PACIFIC-Studie die Immuntherapie sequenziell nach der CRT verabreicht. In allen bisher vorgestellten Studien zu Kopf-Hals-Tumoren wurde die Immuntherapie dagegen während der CRT oder RT verabreicht. „Es ist möglich, dass das Muster des Absterbens der T-Zellen im Tumor, das sich aus dieser gleichzeitigen Behandlung ergibt, das Potenzial für Synergien zwischen Immuntherapie und RT verringert“, kommentierte er.
Abb. 1: PACIFIC-Studie: Durvalumab nach Chemoradiotherapie führte bei Patient*innen mit nicht resezierbarem NSCLC Stadium III zu langfristigem Vorteil bei PFS und OS
Definition der optimalen Sequenz notwendig
„Wenn wir das Potenzial dieser möglicherweise sehr wirksamen Kombinationstherapie ausschöpfen wollen, müssen wir die optimale Behandlungsabfolge bestimmen“, erläuterte Prof. Machiels weiter. Aktuell laufen zwei placebokontrollierte Phase-III-Studien bei Patientinnen und Patienten mit Kopf-Hals-Tumoren (IMvoke010 und KEYNOTE-689), die in dieser Hinsicht nützliche Erkenntnisse liefern dürften. „Neben der Bestimmung der wirksamsten Behandlungssequenz muss auch ermittelt werden, welche Patientinnen und Patienten am ehesten auf eine Kombination aus Radio- und Immuntherapie ansprechen“, führte Prof. Machiels aus. Die vielleicht schwierigste Aufgabe sei jedoch, einen Weg zu finden, um die Strategie der Bestrahlung regionaler Lymphknoten zu verfeinern. „Es ist verlockend, einfach nur die Dosis der RT zu verringern und damit die mögliche Schädigung der Immunantwort zu reduzieren, aber dies muss gegen die Folgen für die erkrankte Person abgewogen werden, die möglicherweise eine unzureichende Dosis an RT erhält“, meinte er. Zudem sei dieser Ansatz sehr schwer zu standardisieren. „Während wir auf die Ergebnisse der klinischen Studien warten, wird die Debatte über den Nutzen der Kombination von RT und Immuntherapie weitergehen“, schloss Prof. Machiels.
ctDNA-Status bei adjuvanter Atezolizumab-Therapie
Die Resultate einer explorativen Analyse von 600 Patientinnen und Patienten mit einem resezierten nichtkleinzelligen Lungenkarzinom (NSCLC), die an der IMpower010-Studie teilgenommen hatten (adjuvante Chemotherapie gefolgt von Atezolizumab oder bester Supportivtherapie [BSC]) präsentierte Dr. Enriqueta Felip, Barcelona.3 Dabei wurden die klinischen Ergebnisse unter Atezolizumab in Abhängigkeit von der PD-L1-Expression und dem postoperativen Status der zirkulierenden Tumor-DNA (ctDNA) – als Biomarker für die minimale Resterkrankung (MRD) – untersucht. Zudem evaluierte die Gruppe um Dr. Felip den ctDNA-Status nach der Chemotherapie und während der Atezolizumab- bzw. BSC-Behandlung sowie das krankheitsfreie Überleben (DFS) gemäß ctDNA-Status nach Chemotherapie.
Die Analyse ergab, dass Atezolizumab das DFS im Vergleich zu BSC in allen PD-L1-positiven Subgruppen (Tumorzellen [TC] ≥1%, 1–49% und ≥50%) verbesserte, jedoch nicht in der PD-L1-negativen (TC <1%). Die adjuvante Chemotherapie führte bei 62% der Patienten (64/103), die postoperativ ctDNA-positiv waren, zu einer ctDNA-Clearance. Diese Chemotherapie-vermittelte ctDNA-Clearance war mit einem verlängerten DFS verbunden. Der DFS-Vorteil von Atezolizumab gegenüber BSC war sowohl bei Erkrankten mit postchemotherapeutischer ctDNA-Clearance (31,3 Monate vs. 13,3 Monate; Hazard-Ratio [HR] 0,7; 95%-Konfidenzintervall [CI] 0,37–1,34) als auch bei denjenigen ohne nachweisbar (4,2 Monate vs. 3,9 Monate; HR: 0,67; 95% CI: 0,34–1,32). In der Gruppe der ctDNA-positiven Erkrankten nach Chemotherapie blieb der Wert unter Atezolizumab über die Zeit stabil, während er in der BSC-Gruppe um etwa das Zehnfache anstieg. Bei ctDNA-negativen Patienten nach der Chemotherapie schien Atezolizumab die Konversion zu einer ctDNA-Positivität zu verzögern. Dr. Felip fasste schließlich zusammen: „Diese Post-hoc-Analysen zeigen, dass Atezolizumab die Ergebnisse unabhängig vom postoperativen und postchemotherapeutischen ctDNA-Status verbessert.“ Wie Prof. Dr. Solange Peters, Lausanne, in der Diskussion dieser Arbeit erklärte, hat sich der postoperative MRD-Status damit zwar als prognostisch, aber weder als prädiktiv noch als ausreichend empfindlich für Entscheidungen hinsichtlich einer Deeskalation der Therapie erwiesen. Dies nicht zuletzt aufgrund der hohen Rate an falsch negativen Resultaten mit aktuellen Assays.
Adagrasib plus Pembrolizumab beim fortgeschrittenen NSCLC
In der Vergangenheit haben sich KRAS-Alterationen beim NSCLC als schwierige Therapieziele erwiesen, jedoch wurden mittlerweile spezifische KRASG12C-Inhibitoren entwickelt. Die Phase-I/II-Studie KRYSTAL-1 bestätigte kürzlich die Wirksamkeit des irreversiblen KRASG12C-Inhibitors Adagrasib bei vorbehandelten Patientinnen und Patienten mit KRASG12C-mutiertem NSCLC.4 Präklinische Studien deuten darauf hin, dass Adagrasib die immunologische Mikroumgebung des Tumors rekonditionieren und die Tumoren für eine Checkpoint-Inhibitor-Therapie sensibilisieren könnte.5 Dies bildete denn auch die Basis für die Strategie, Adagrasib in Kombination mit einer Immuntherapie einzusetzen.
In der Phase-Ib-Kohorte von KRYSTAL-1 und der Phase-II-Studie KRYSTAL-7 erhielten therapienaive Erkrankte mit einem KRASG12C-mutierten, fortgeschrittenen NSCLC Adagrasib plus Pembrolizumab. Bei den Patientinnen und Patienten aus KRYSTAL-1 (n=7) fand sich nach einem medianen Follow-up von 19,3 Monaten eine objektive Ansprechrate (ORR) von 57% (4/7) und eine Krankheitskontrollrate (DCR) von 100%. Die vier Responder zeigten ein dauerhaftes Ansprechen von mehr als 9 Monaten, wobei 2 von ihnen auch nach 18 Monaten noch weiterbehandelt wurden. Behandlungsassoziierte Nebenwirkungen (TRAE) des Grades 3 wurden bei 4 Studienteilnehmenden beobachtet. Es gab keine TRAE der Grade 4 oder 5.
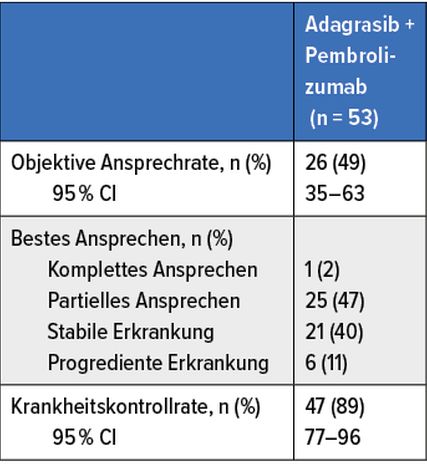
Tab.1: Resultate der Phase-II-Studie KRYSTAL-7 bei therapienaiven Erkrankten mit einem KRASG12C-mutierten, fortgeschrittenen NSCLC6
Gemäß der vorläufigen Wirksamkeitsanalyse (medianes Follow-up 3,5 Monate) von 53 auswertbaren therapienaiven Patientinnen und Patienten der KRYSTAL-7-Studie erreichte Adagrasib plus Pembrolizumab hier eine ORR von 49% und eine DCR von 89% (Tab. 1). Die mediane Zeit bis zum Ansprechen betrug 1,4 Monate. Die Behandlung wurde bei 66% der Patienten fortgesetzt.
Gemäß der Analyse wies die gleichzeitige Behandlung mit Adagrasib und Pembrolizumab ein beherrschbares Sicherheitsprofil auf, das mit dem einer Monotherapie mit einem der beiden Wirkstoffe übereinstimmte. Die Rate an TRAE, die zum Abbruch der Behandlung führten, war niedrig. Auf der Grundlage dieser Ergebnisse sind nun Phase-III-Studien zur Erstlinienbehandlung von NSCLC-Erkrankten mit Adagrasib + Pembrolizumab im Vergleich zur Standardtherapie geplant.
Anti-IL-8-Antikörper plus Immuntherapie beim Melanom
IL-8 ist ein CXC-Chemokin, das protumorigene Wirkungen entfaltet, indem es die Immunsuppression durch die Rekrutierung von Neutrophilen und myeloischen Suppressorzellen in die Mikroumgebung des Tumors fördert. Dr. Matteo Simonelli (Mailand/I) präsentierte beim Kongress aktualisierte Ergebnisse der Phase-I/II-Studie mit dem vollständig humanen Anti-IL-8-Antikörper BMS-986253 + Nivolumab (NIVO) ± Ipilimumab (IPI) bei fortgeschrittenen Tumorerkrankungen.7
Bis Anfang August 2022 hatten 159 Patienten (mittleres Alter: 63) BMS-986253 mit NIVO (n=144) oder mit NIVO + IPI (n=15) erhalten. Beide Schemata wurden gut vertragen. Bei 6 von 46 (13%) Patienten mit einem Melanom wurde ein partielles Ansprechen unter der Behandlung mit BMS-986253 + NIVO beobachtet. Alle Responder hatten zuvor eine Anti-PD-1- und 5 eine Anti-CTLA-4-Therapie erhalten. Ein komplettes Ansprechen wurde bei 1 von 6 mit BMS-986253 + NIVO + IPI behandelten Patienten mit Melanom erreicht. Im Phase-II-Teil der Studie wird nun BMS-986253 kombiniert mit Immuntherapie bei Patientinnen und Patienten mit nicht resezierbaren Melanomen nach einer Anti-PD-(L)1-Therapie untersucht.
Quelle:
ESMO Immuno-Oncology Congress 2022, 7.–9. Dezember 2022, Genf und online
Literatur:
1 Spigel DR et al.: Five-year survival outcomes from the PACIFIC trial: Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. J Clin Oncol 2022; 40: 1301-11 2 Machiels JP et al.: Primary results of the phase III KEYNOTE-412 study: Pembrolizumab with chemoradiation therapy (CRT) vs placebo plus CRT for locally advanced head and neck squamous cell carcinoma. Ann Oncol 2022; 33(Suppl_7): S808-S869 3 Felip E et al.: IMpower010: ctDNA status in patients with resected NSCLC who received adjuvant chemotherapy followed by atezolizumab or best supportive care. ESMO Immuno-Oncology Congress 2022, Abstr. #1O 4 Jänne PA et al.: Adagrasib in non–small-cell lung cancer harboring a KRASG12C mutation. N Engl J Med 2022; 387: 120-31 5 Briere DM et al.: The KRASG12C Inhibitor MRTX849 reconditions the tumor immune microenvironment and sensitizes tumors to checkpoint inhibitor therapy. Mol Cancer Ther 2021; 20: 975-85 6 Jänne PA et al.: Preliminary safety and efficacy of Adagrasib with Pembrolizumab in treatment-naive patients with advanced non-small cell lung cancer (NSCLC) harboring a KRASG12C mutation. ESMO Immuno-Oncology Congress 2022, LBA4 7 Simonelli M et al.: Anti–IL-8 BMS-986253 + Nivolumab ± Ipilimumab in patients with advanced cancer: Update of initial phase I results. ESMO Immuno-Oncology Congress 2022, Abstr. #200MO
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...