Fortschritte mit innovativen Substanzen
Bericht:
Dr. Ine Schmale
Die Fortschritte der medikamentösen Forschung beim Lungenkarzinom haben sowohl die zielgerichtete als auch die Immuntherapie in besonderen Maßen hervorgebracht. Bei der 2020 World Conference on Lung Cancer (WCLC) der International Association for the Study of Lung Cancer (IASLC) konnten relevante neue Studienergebnisse präsentiert werden. Die WCLC 2020 wurde aufgrund der Pandemie erst Ende Jänner 2021 durchgeführt.
Das Lungenkarzinom ist seit Jahrzehnten eine der häufigsten Tumorentitäten weltweit. Etwa 11,6% aller neuen Krebsdiagnosen weltweit fielen 2018 auf das Lungenkarzinom. Die relative 5-Jahres-Überlebensrate wurde von 2010–2014 im Bereich von 13,3% bis 32,9% angegeben.Um Tendenzen in der Inzidenz des Lungenkarzinoms zu erkennen, befasste sich eine chinesische Studie mit den globalen Mustern von Lungenkarzinomerkrankungen.1
Die höchste Rate an Lungenkarzinomen bei Männern wurde in der Türkei, in Belarus und Kroatien ermittelt. Bei den Frauen wurden die höchsten Erkrankungsraten in Dänemark, den USA (schwarze Bevölkerung) und Island festgestellt. Die geringste Erkrankungsrate wurde für beide Geschlechter in Uganda beobachtet. Insgesamt war die Erkrankungsrate bei den Männern in der Mehrheit höher als bei den Frauen, mit einer Männer-Frauen-Ratio von bis zu 10,9 (Belarus). In Österreich lag das Verhältnis bei 2:1. In den westeuropäischen Ländern (Niederlande, Deutschland, Schweiz, Österreich, Frankreich) ist die Inzidenz von Lungenkrebs bei Männern leicht rückläufig, während sie bei den Frauen stark ansteigend ist. Der Anstieg bei den Frauen betrifft insbesondere Frauen mit späteren Geburtsjahren, während Männer aller Geburtsjahre ähnlich stark betroffen sind.
Lebensqualität unter adjuvanter Osimertinib-Gabe
In der adjuvanten Situation kann mit Osimertinib eine klinisch relevante Verlängerung des krankheitsfreien Überlebens (DFS) im Vergleich zu Placebo erreicht werden, so die Ergebnisse der Phase-III-Studie ADAURA. Die Lebensqualität wurde nach Auswertungen, die aktuell bei der WCLC präsentiert wurden, nicht beeinträchtigt.2
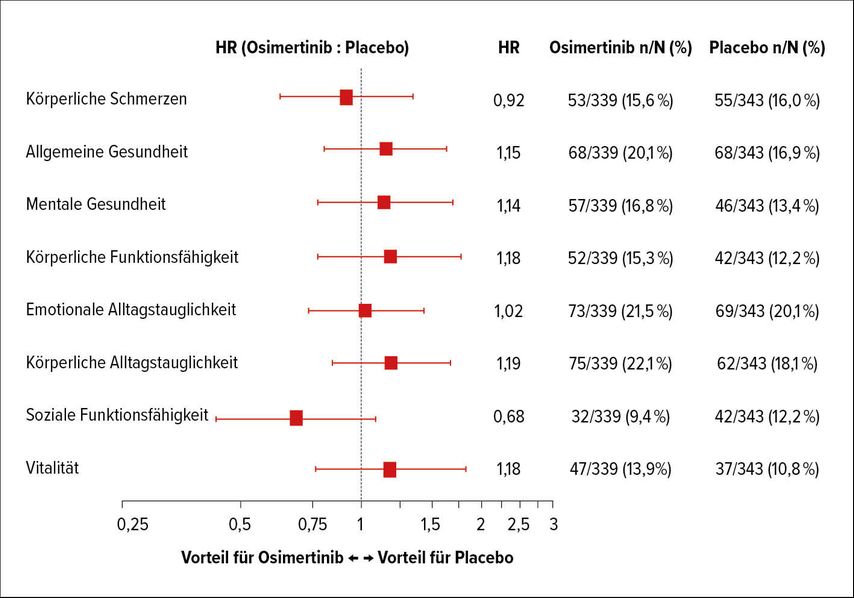
Bei Patienten mit resezierbarem EGFR-mutiertem nicht kleinzelligem Lungenkarzinom (NSCLC) im Stadium IB–IIIA wurde mit der adjuvanten Osimertinib-Gabe im Vergleich zu Placebo eine 80%ige Risikoreduktion bezüglich eines Krankheitsrückfalls erreicht (HR: 0,20; 99,12% CI: 0,14–0,30). Da die Beeinträchtigung der Lebensqualität der potenziell geheilten Patienten unter adjuvanter Behandlung ein wichtiger klinischer Parameter ist, hat sich die Erfassung von Lebensqualitätsdaten in der adjuvanten Situation etabliert. Eine dreijährige adjuvante Behandlung mit täglich 80mg Osimertinib zeigte keinen negativen Einfluss auf die Lebensqualität. Von den insgesamt 682 in die ADAURA-Studie eingeschlossenen Patienten füllten ≥85% beider Studienarme den Short-Form-36-Gesundheitsfragebogen bei Studienbeginn, in Woche 12 sowie 24 und dann alle 24 Wochen bis zur Beendigung der Therapie aus. Die mediane Einnahmedauer der Studienmedikation betrug zum Zeitpunkt der Auswertung 22,5 Monate im Osimertinib- und 18,7 Monate im Placeboarm. 12% versus 10% der Patienten hatten die Einnahme der Studienmedikation bereits abgeschlossen. Sowohl in Bezug auf die körperliche als auch die mentale Lebensqualität zeigte sich bei krankheitsfreien Patienten kein klinisch relevanter Unterschied vom Therapiebeginn im Studienverlauf oder im Vergleich der Studienarme (Abb. 1).
Abb. 1: Zeit bis zur Verschlechterung diverser Lebensqualitätsparameter im Vergleich von Osimertinib und Placebo (nach Majem et al.)2
Diese Ergebnisse bestätigen den Einsatz von Osimertinib als effektive neue Therapiestrategie im adjuvanten Setting.
Pembrolizumab plus Chemoradiotherapie im Stadium III
In der Phase-II-Studie KEYNOTE-799 wurde die Kombination von Pembrolizumab mit Chemoradiotherapie bei nicht vorbehandelten NSCLC-Patienten im Stadium III untersucht.3 Insgesamt wurden 216 Patienten mit nicht resektablen, lokal fortgeschrittenen Tumoren im Stadium IIIA–C in die Studie eingeschlossen und erhielten je nach histologischer Ausprägung drei Zyklen (q3w) Pembrolizumab mit Paclitaxel und Carboplatin (Kohorte A) oder mit Pemetrexed und Cisplatin (Kohorte B). Anschließend wurde in den Zyklen 4–17 eine Pembrolizumab-Monotherapie verabreicht.
Die Patienten waren im Median 66 (A) bzw. 64 (B) Jahre alt und in 95% der Fälle Raucher oder vormalige Raucher. Ein Ansprechen wurde bei 69,6% (A) bzw. 70,5% (B) der Patienten beobachtet. Der Median bezüglich der Dauer des Ansprechens war mit einer medianen Nachbeobachtungszeit von 15,5 (A) bzw. 13,6 (B) Monaten noch nicht erreicht. Bei 82,2% (A) bzw. 72,1% (B) der Patienten hielten die Remissionen ≥12 Monate an. Die 12-Monats-Rate des progressionsfreien Überlebens (PFS) betrug in den beiden Studienkohorten 67,7% (A) bzw. 65,2% (B) und die des Gesamtüberlebens (OS) 81,2% (A) bzw. 88,0% (B).
Die Inzidenz der Nebenwirkungen war konsistent mit bekannten Toxizitäten der einzelnen Therapiepartner. Pneumonien von Grad ≥3 traten bei 8,0% und 7,9% der Patienten in beiden Kohorten auf.
Cemiplimab-Monotherapie in der Erstlinie
In der ersten Therapielinie des NSCLC wurden mit Cemiplimab vielversprechende Ergebnisse, insbesondere bei Tumoren mit hoher PD-L1-Expression, erreicht. Cemiplimab ist ein hochaffiner, humaner Anti-PD-1-Antikörper. In der Phase-III-Studie EMPOWER-Lung1 wurde die Erstlinientherapie mit Cemiplimab gegenüber einer Chemotherapie nach Wahl des Prüfarztes verglichen und dafür sowohl die Intention-to-treat-Population als auch die Population mit einer PD-L1-Expression ≥50% gesondert ausgewertet.4 Insgesamt wurden 563 Patienten mit PD-L1 ≥50% mit Cemiplimab (n=283) oder Chemotherapie (n=280) behandelt. Die Patienten waren median 63 bzw. 64 Jahre alt und in 76–77% der Fälle Europäer. 43% der Tumoren entsprachen histologisch einem Plattenepithelkarzinom. Bei 12% der Patienten wurden Hirnmetastasen nachgewiesen. 15–16% der Patienten waren in einem lokal fortgeschrittenen und 84–85% in einem metastasierten Erkrankungsstadium. Bei je etwa einem Drittel der Tumoren wurde eine PD-L1-Expression zwischen 50 und 60%, zwischen 60 und 90% und ≥90% identifiziert.
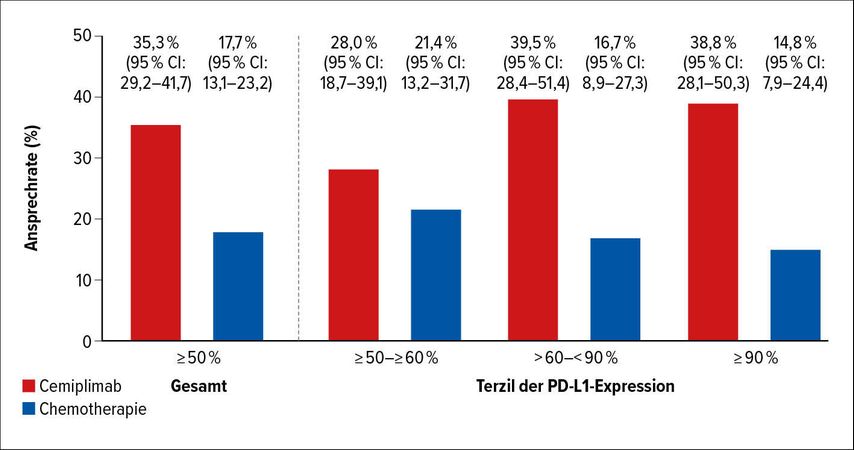
Mit der Cemiplimab-Monotherapie wurde gegenüber der Chemotherapie eine Verlängerung des PFS von median 5,7 auf 8,2 Monate (HR: 0,54; 95% CI: 0,43–0,68) erreicht. Das OS unter Chemotherapie betrug median 14,2 Monate, während es im Cemiplimab-Arm noch nicht erreicht war (HR: 0,57; 95% CI: 0,42–0,77). Nach 12 Monaten lebten 72,4% der Patienten unter Cemiplimab versus 53,9% unter Chemotherapie und 40,7% versus 7,1% der Patienten waren ohne Tumorprogress. Ein objektives Ansprechen wurde bei 35,3% versus 17,7% der Patienten gesehen. Dabei sprachen Patienten mit höherer PD-L1-Expression (>60%) häufiger auf den PD-1-Inhibitor und weniger häufig auf die Chemotherapie an, verglichen mit einer niedrigeren Expression (Abb. 2). Eine höhere PD-L1-Expression korrelierte auch mit einer stärkeren Tumorschrumpfung. Die Autoren schlossen, dass die Höhe der PD-L1-Expression ermittelt werden sollte, um Patienten mit dem größtmöglichen Nutzen von einer Cemiplimab-Monotherapie in der ersten Therapielinie zu identifizieren.
Abb. 2: Ansprechrate unter Cemiplimab versus Chemotherapie in Abhängigkeit von der PD-L1-Expression (nach Kilickap et al.)4
Neratinib bei EGFR-Exon-18-mutierten Tumoren
In etwa 5% der EGFR-Mutationen beim Lungenkarzinom handelt es sich um eine Mutation im EGFR-Exon 18. Neratinib ist ein oraler, irreversibler EGFR-, HER2- und HER4-gerichteter TKI, der in der offenen, einarmigen SUMMIT-Studie bei Lungenkarzinompatienten mit EGFR-Exon-18-mutierter Erkrankung untersucht wird. Bei der WCLC 2020 wurden erste Ergebnisse von 11 auswertbaren Patienten gezeigt.5
Die Patienten waren im Median 67 Jahre alt und hatten bereits median 2 Therapielinien erhalten. 10 der Patienten (91%) waren mit einem EGFR-TKI (Gefitinib, Erlotinib, Osimertinib oder Afatinib) behandelt worden und 3 Patienten (27%) mit einem Checkpoint-Inhibitor. 6 Patienten (55%) hatten im Vorfeld der Studie eine Chemotherapie erhalten. Ein Ansprechen zeigten 4 Patienten, mit einer medianen Dauer des Ansprechens von 7,5 Monaten. Eine klinische Krankheitskontrolle, definiert als Komplettremission (CR), partielle Remission (PR) oder eine stabile Erkrankung (SD) über mindestens 16 Wochen, zeigten 8 Patienten (73%). Im Median lebten die Patienten 6,9 Monate progressionsfrei. Die Therapie wurde gut vertragen. Diarrhö, als häufigste Nebenwirkung, trat bei 4 Patienten mit Grad 1 und einem Patienten mit Grad 2 auf. Es wurden keine Grad-3-Diarrhöen, immunvermittelten Nebenwirkungen oder Hautausschläge beobachtet. Die Rekrutierung in die SUMMIT-Studie läuft derzeit noch.
Amivantamab bei EGFR-Exon-20-mutiertem NSCLC
Amivantamab ist ein bispezifischer Antikörper, der an EGFR und MET bindet. Im Gegensatz zu den zugelassenen EGFR-gerichteten TKI kann Amivantamab den durch Exon-20-Insertion aktivierten EGFR-Signalweg inhibieren. In der CHRYSALIS-Studie erhielten 114 NSCLC-Patienten mit Exon-20-Insertion nach Versagen einer Platin-basierten Chemotherapie Amivantamab. Die Auswertung von 81 Patienten, die ≥3 Kontrolltermine wahrnehmen konnten, wurde bei der WCLC 2020 vorgestellt.6
Die Patienten waren median 62 Jahre alt und in der Hälfte der Fälle asiatischer Herkunft. 53% der auswertbaren Patienten waren Nichtraucher. Die mediane Zeit seit Erstdiagnose betrug 17 Monate. Im Median hatten die Patienten zwei Therapielinien erhalten. Die Hälfte der Patienten war immunonkologisch vorbehandelt und ein Viertel hatte einen EGFR-TKI erhalten.
Mit einer medianen Nachbeobachtungszeit von 9,7 Monaten wurde ein Ansprechen bei 40% der Patienten beobachtet. Die mediane Dauer des Ansprechens lag bei 11,1 Monaten. Eine stabile Erkrankung wurde zudem bei 48% gesehen, sodass die klinische Krankheitskontrollrate 74% betrug. Zur Zeit der Auswertung waren noch 47% der ansprechenden Patienten unter Therapie, 63% der Patienten zeigten ein Ansprechen für eine Dauer von ≥6 Monaten. Das mediane PFS betrug 8,3 Monate und das mediane OS 22,8 Monate.
Die Therapie wurde gut vertragen, mit therapieassoziierten Nebenwirkungen von Grad ≥3 bei 16% der Patienten. 4% der Patienten brachen die Therapie aufgrund von therapieassoziierten Nebenwirkungen ab.
Sotorasib induziert hohe Ansprechraten und tiefe Remissionen
Auch bezüglich spezifischer KRAS-Mutationen können Fortschritte verzeichnet werden. Im Rahmen der CodeBreaK-100-Studie erhielten 126 vorbehandelte Patienten mit KRASG12C-mutiertem, nicht kleinzelligem Adenokarzinom der Lunge einmal täglich Sotorasib in einer Dosierung von 960mg.7
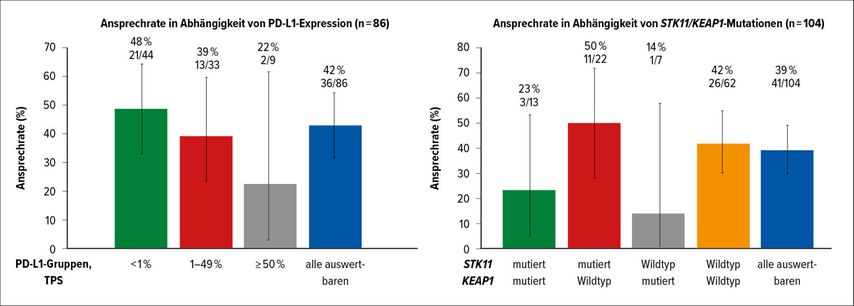
Das mediane Alter der Patienten betrug 63,5 Jahre mit einer Altersspanne von 37 bis 80 Jahren. Bei der Mehrheit der eingeschlossenen Patienten handelte es sich um aktive oder ehemalige Raucher (92,9%). 89,7% der Studienteilnehmer hatten bereits eine Platin-basierte Chemotherapie, 91,3% eine Immuntherapie mit PD-(L)1-Inhibitoren und 81,0% sowohl eine Platin-basierte Chemotherapie als auch eine Immuntherapie erhalten. Die mediane Nachbeobachtungszeit betrug bei Studienauswertung 12,2 Monate. Ein bestätigtes objektives Ansprechen wurde bei 37,1% und eine Krankheitskontrolle bei 80,6% der Patienten erfasst. Die Patienten sprachen über alle PD-L1-Expressionsspiegel und alle STK11-/KEAP1-Mutationskombinationen auf Sotorasib an (Abb. 3). Bei 81% der Patienten wurde eine Tumorschrumpfung jedweden Ausmaßes gesehen. Das mediane prozentuale Ausmaß der größten Tumorschrumpfung unter allen Patienten mit Ansprechen betrug 60%.
Abb. 3: Ansprechraten unter Therapie mit Sotorasib in Abhängigkeit von der PD-L1-Expression und STK11- und/oder KEAP1-Mutationen (nach Li et al.)7
Die mediane Zeit bis zum objektiven Ansprechen lag bei 1,4 Monaten, die mediane Dauer des Ansprechens (DOR) betrug 10,0 Monate (95% CI: 6,9–11,1). 72% der Remissionen wurden bereits bei der ersten Kontrolluntersuchung gesehen. 43% der Patienten mit Ansprechen waren zum Zeitpunkt des Daten-Cut-offs weiterhin unter Behandlung. Das mediane PFS betrug 6,8 Monate. Therapieassoziierte Nebenwirkungen aller Grade, im Wesentlichen gastrointestinale Nebenwirkungen, traten bei 69,8% der Patienten auf. Bei insgesamt 19,8% der Patienten wurden therapieassoziierte Grad-3-Ereignisse gesehen, Grad-4- oder tödliche Ereignisse traten nicht auf. Bei 7,1% der Patienten führten die behandlungsbedingten unerwünschten Wirkungen zum Therapieabbruch.
Die Monotherapie mit Sotorasib wird in der konfirmatorischen Phase-III-Studie CodeBreaK 200 mit Docetaxel bei vorbehandelten Patienten mit NSCLC und KRASG12C-Mutation verglichen.
Trastuzumab Deruxtecan bei HER2-Überexpression
In der offenen, multizentrischen Phase-II-Studie DESTINY-Lung01 wurde das neue Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan (T-DXd) bei vorbehandelten NSCLC-Patienten mit HER2-überexprimierenden (Kohorte 1) oder HER2-mutierten (Kohorte 2) metastasierten Tumoren untersucht.8 Bei der WCLC 2020 wurde eine Zwischenanalyse der 49 Patienten der Kohorte 1 präsentiert.
Die Patienten waren median 63 Jahre alt und mehrheitlich aus Nordamerika und Europa. Im Median hatten die Patienten bereits drei Therapielinien erhalten, 91,8% waren mit einer Platin-basierten Therapie, 73,5% mit einer Immuntherapie und 24,5% mit Docetaxel vorbehandelt. Im Ergebnis sprachen 24,5% der Patienten auf die Therapie an, eine klinische Krankheitskontrolle (CR, PR und SD) zeigten 69,4% der Patienten. Die mediane DOR betrug 6,0 Monate. Mit einer medianen Nachbeobachtungszeit von 6,1 Monaten lag das PFS im Median bei 5,4 Monaten (95% CI: 2,8–7,0) und das OS bei median 11,3 Monaten (95% CI: 7,8 bis nicht erreicht).
Die Patienten wurden im Median über einen Zeitraum von 18 Wochen behandelt, mit einer Spanne von 3,0 bis 57,1 Wochen. Therapieassoziierte Nebenwirkungen traten bei 89,8% der Patienten auf, therapieassoziierte Nebenwirkungen von Grad ≥3 bei 55,1% der Patienten. 22,4% der Patienten brachen die Therapie aufgrund von therapieassoziierten Nebenwirkungen ab. Es trat ein therapieassoziierter Todesfall auf.
Quelle:
2020 World Conference on Lung Cancer, 28.–31. Jänner 2021
Literatur:
1 Zhang Y et al.: WCLC 2020; Abstr. #OA10.05 2 Majem M et al.: WCLC 2020; Abstr. #OA06.03 3 Reck M et al.: WCLC 2020; Abstr. #OA02.03 4 Kilickap S et al.: WCLC 2020; Abstr. #OA01.03 5 Boni V et al.: WCLC 2020; Abstr. #OA04.06 6 Sabari JK et al.: WCLC 2020; Abstr. #OA04.04 7 Li BT et al.: WCLC 2020; Abstr. #PS02.07 8 Nakagawa K et al.: WCLC 2020; Abstr. #OA04.05
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...