Fortgeschrittenes Ovarial-karzinom nach Platintherapie
Autor:
Priv.-Doz. DDr. Christoph Suppan
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
LKH – Univ.-Klinikum Graz
E-Mail: christoph.suppan@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Ovarialkarzinom gehört mit über 300000 Neuerkrankungen pro Jahr zu den 20 häufigsten Krebsformen weltweit. Das mediane progressionsfreie Überleben beträgt im metastasierten Setting unter der Standarderstlinie mit platinhaltiger Chemotherapie plus Bevacizumab etwa 11–19 Monate. Circa 70% dieser Betroffenen entwickeln ein Rezidiv innerhalb der ersten drei Jahre nach Therapieinitiierung und sind mit einer reduzierten Überlebenswahrscheinlichkeit konfrontiert.1 Der Bedarf an Entwicklung und Implementierung neuer Therapieoptionen ist demnach sehr hoch.
Der VEGF-Inhibitor Bevacizumab
Die Zugabe des VEGF-Inhibitors Bevacizumab konnte in mehreren Studien einen signifikanten Vorteil im progressionsfreien Überleben (PFS) erwirken, während der Benefit im Gesamtüberleben (OS) nur in definierten Hochrisikopopulationen signifikant ausfiel.2,3 Der neoadjuvante Einsatz ist nach aktueller Datenlage unklar, jedoch mit einem günstigen Sicherheitsprofil vergesellschaftet und somit möglich.
Ob auch die intraperitoneale Chemotherapie oder die hypertherme intraperitoneale Chemoperfusion (HIPEC) einen Stellenwert haben, wird kontrovers diskutiert. Sie stellen jedenfalls keinen Standard dar. Als Chemotherapie-Backbone in der Erstlinie wird die dreiwöchentliche Dosierung von Carboplatin/Paclitaxel empfohlen, wöchentliches Paclitaxel kann unter gewissen Umständen erwogen werden.
Nach Abschluss von sechs Zyklen kann eine Erhaltungstherapie mit einem PARP-Inhibitor angeboten werden. Grundlage dafür ist die Biomarkertestung auf Vorliegen einer homologen Rekombinationsdefizienz (HRD) und/oder BRCA-Mutation im Tumorgewebe oder in der Keimbahn.
Unterschiedliche PARP-Inhibitoren wurden in Studien untersucht, die meist alle Patient:innen unabhängig vom Biomarkerstatus einschlossen. Die Dauer der PARP-Inhibitor-Therapie betrug meist zwischen 24 und 36 Monaten.
Gesondert erwähnen möchte ich die Studie SOLO-1, die lediglich Patient:innen mit einer BRCA-Mutation inkludierte, und die Studie PAOLA-1, die Olaparib in Kombination mit Bevacizumab untersuchte.4,5 Den größten Benefit im progressionsfreien Überleben und Gesamtüberleben erreichten in allen Studien die BRCA-positiven Patient:innen.4–7 Für diese Gruppe werden derzeit entweder Olaparib, Olaparib+Bevacizumab oder Niraparib als Erhaltungstherapie nach Ansprechen auf platinhaltige Chemotherapie empfohlen.
Für die HRD-positive/BRCA-Wildtyp-Patient:innenpopulation, die etwa 25% ausmacht, werden entweder Niraparib für drei Jahre oder Olaparib+Bevacizumab für zwei Jahre empfohlen. Den geringsten Benefit einer PARP-Inhibitor-Erhaltungstherapie haben Patient:innen mit einem BRCA-Wildtyp/HRD-negativen Subtyp, den immerhin 50% aller Ovarialkarzinompatient:innen haben. Hier zeigte sich zwar in der PRIMA-Studie ein PFS-Benefit unter Niraparib (5,4 Monate vs. 8,4 Monate; HR: 0,65) , das Gesamtüberleben war jedoch nicht signifikant länger (p=0,88; HR: 1,01).7,8 Prinzipiell kann diesen Patient:innen daher eine Erhaltungstherapie mit Niraparib oder Bevacizumab angeboten werden.
Antikörper-Wirkstoff-Konjugate
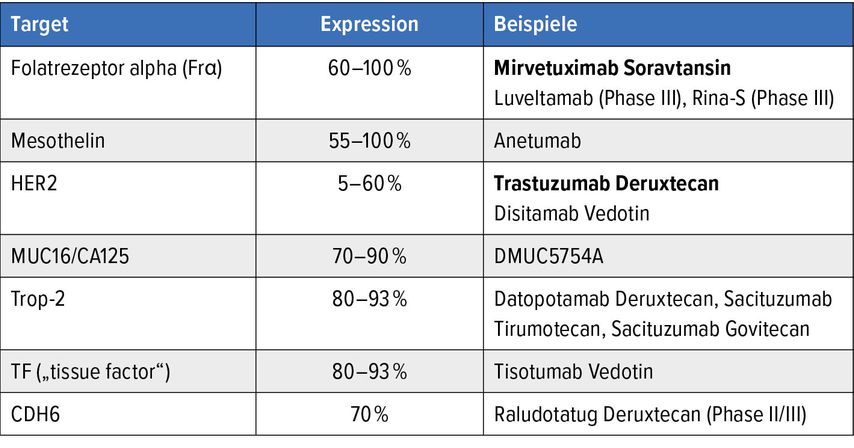
Bei Auftreten einer Platinresistenz standen in der Vergangenheit unterschiedliche Chemotherapiesubstanzen mit mäßigen Ansprechraten zur Verfügung. Inzwischen wurde aber auch die Therapiewelt des metastasierten Ovarialkarzinoms durch neue Antikörper-Wirkstoff-Konjugate (ADC) bereichert (Tab.1).
Tab. 1: Übersicht über Antikörper-Wirkstoff-Konjugate (modifiziert nach Birrer MJ et al., J Natl Cancer Inst 2019, Lian L et al., Human Pathol 2019)
Die erste Phase-III-Studie in diesem Setting ist MIRASOL, die das ADC Mirvetuximab Soravtansin gegenüber herkömmlicher Chemotherapie untersucht hat. Basis für den Studieneinschluss war der Nachweis einer Folatrezeptor-alpha-(FR-α)-Überexpression im Tumorgewebe von ≥75%.
Unter Mirvetuximab Soravtansin, das einen Mikrotubuli-Inhibitor als Payload trägt, zeigte sich eine signifikante Verlängerung des PFS (p<0,0001; HR: 0,65) und OS (p=0,0046; HR: 0,67). Diese Substanz ist daher neuer Standard bei platinresistenten Patient:innen mit einer FR-α-Überexpression ≥75%. Der Test wird mittels „VENTANA FOLR1 (FOLR1-2.1) RxDx Assay“ durchgeführt. Potenzielle Nebenwirkungen beinhalten gastrointestinale Beschwerden sowie Augentoxizität, weswegen regelmäßige augenärztliche Untersuchungen empfohlen sind.9
Daten zu zwei weiteren ADC mit FR-α als Therapieziel wurden zuletzt ebenfalls berichtet: Luveltamab Tazevibulin wurde in zwei verschiedenen Dosierungen im platinresistenten Setting getestet und zeigte eine objektive Ansprechrate (ORR) von über 30%.10 Rinatabart Sesutecan ist ebenfalls FR-α-gerichtet, trägt aber als Payload einen Topoisomerase-1-Inhibitor und zeigte ebenfalls eine ORR von etwa 30% bei Patient:innen mit fortgeschrittenem Endometrium- oder Ovarialkarzinom.11
Target HER2-neu
Ein weiteres Target, das bei unterschiedlichen Tumorentitäten exprimiert wird, ist HER2-neu. Die Phase-II-Studie DESTINY-PanTumor02 untersuchte die Wirksamkeit von Trastuzumab Deruxtecan bei unterschiedlichen metastasierten soliden Tumoren mit HER2-Expression 2+ oder 3+ in der Immunhistochemie (IHC) und schloss auch Patient:innen mit Ovarial- oder Endometriumkarzinomen ein.
Die Patient:innen mit Ovarialkarzinom erreichten insgesamt eine ORR von 45%, wobei bei Patient:innen mit HER23+-Expression das Ansprechen noch besser war und das mediane PFS etwa zwölf Monate betrug.12 Demnach hat der immunhistochemische Nachweis von HER2+ oder 3+ auch beim metastasierten Ovarialkarzinom unmittelbare therapeutische Konsequenz und wird in der Literatur mit ungefähr 30% beschrieben.
TROPION-PanTumor03: Trop-2
Ein weiteres bereits bekanntes Protein, das bei unterschiedlichen Tumoren überexprimiert wird, ist Trop-2. Die Studie TROPION-PanTumor03 untersuchte die Wirksamkeit von Datopotamab Deruxtecan bei Patient:innen mit metastasiertem Endometrium- oder Ovarialkarzinom.
Auch hier wurde eine ORR von über 30% im platinresistenten Setting berichtet, während bei platinsensitiven Patient:innen die Ansprechrate erwartungsgemäß deutlich höher war.13 Ähnliche Ergebnisse zeigte auch das Trop-2-gerichtete ADC Sacituzumab Tirumotecan, das ebenfalls vor allem bei platinresistenten Patient:innen untersucht wurde (ORR: 35%).14
Ein weiteres potenzielles und erwähnenswertes Therapieziel ist Claudin-6, dessen Überexpression beim Ovarialkarzinom generell mit schlechteren Überlebensdaten assoziiert ist. Frühe Daten zu der Substanz TOR-L-123 bestätigen ebenfalls eine überzeugende Wirksamkeit: Eine ORR von fast 50% konnte in einem kleinen Patient:innenkollektiv nachgewiesen werden.15 Sollte es zur Zulassung mehrerer ADC beim metastasierten Ovarialkarzinom kommen, wird sich auch hier die Frage stellen, in welcher Sequenz diese unterschiedlichen Substanzen wirksam sein könnten und welche Rolle der Wechsel des Targets oder der angehängten Payload spielt.
Checkpoint-Inhibitoren
Die Rolle von Checkpoint-Inhibitoren in der Behandlung des metastasierten Ovarialkarzinoms ist weiterhin ungewiss. Daten zur Monotherapie mit Pembrolizumab, Nivolumab, Avelumab oder Atezolizumab bei vorbehandelten Patient:innen waren enttäuschend, mit einer ORR zwischen 10% und 20%.16–19
Eine Phase-III-Studie untersuchte die Wirksamkeit von zusätzlichem Atezolizumab zur platinhaltigen Chemotherapie, gefolgt von PARP-Inhibitortherapie mit Niraparib mit oder ohne Atezolizumab.
Trotz des Einsatzes in der früheren Behandlungslinie zeigte sich kein signifikanter Benefit im PFS (11,2 Monate mit Atezolizumab vs. 10,1 Monate ohne).20 Dies wurde sowohl für PD-L1-negative (HR: 0,93) als auch PD-L1-positive (HR: 0,87) Patient:innen berichtet.
Erste positive Daten zum Einsatz von Durvalumab in der Erstlinientherapie wurden vor etwa einem Jahr publiziert: Die DUO-O-Studie ist eine dreiarmige Studie, die u.a. eine Dreifachkombination aus platinhaltiger Chemotherapie, Durvalumab und Bevacizumab, gefolgt von einer Erhaltungstherapie mit Durvalumab, Bevacizumab und Olaparib, untersuchte.
Das mediane PFS in der HRD-positiven/nicht BRCA-mutierten Population zeigte sich mit 45,1 Monaten signifikant länger als im Arm mit Chemotherapie+Bevacizumab, wo es 23,3 Monate betrug (HR: 0,46). Das OS in der ITT-Population zeigte sich in der Interimsanalyse statistisch nicht signifikant verlängert, ein positiver Trend wurde aber für die HRD-positiven Patient:innen ohne BRCA-Mutation berichtet.21
Biomarker-gezielte Therapie
Im Bereich der Biomarker-gezielten Therapie gibt es leider weniger zu berichten. Insbesondere bei HRD-negativen Patient:innen besteht großer Aufholbedarf in der Erweiterung der Therapielandschaft. Zu den häufigsten Mutationen beim HRD-negativen Ovarialkarzinom zählen Funktionsverluste in NF1 und RB1 oder die CCNE1-Amplifikation.22 Letztere ist beim Ovarialkarzinom mit einer schlechteren Prognose und mit Chemoresistenz vergesellschaftet, es gibt jedoch bereits frühe Daten zur Wirksamkeit zielgerichteter Therapien in diesem Setting.23
Entwicklung neuer ADC
Nach Ausschöpfen der Platin- und PARP-Inhibitor-Therapie liegt der Fokus derzeit auf der Entwicklung neuer ADC. Auch beim metastasierten Ovarialkarzinom kann die erweiterte Biomarkertestung abseits von BRCA1/2 und HRD sinnvoll sein und sollte bestenfalls im Rahmen eines interdisziplinären molekularen Tumorboards evaluiert werden.
Literatur:
1 Sung H et al.: CA Cancer J Clin 2021; 71(3): 209-49 2 Burger RA et al.: N Engl J Med 2011; 365(26): 2473-83 3 Perren TJ et al.: N Engl J Med 2011; 365(26): 2484-96 4 Moore K et al.: N Engl J Med 2018; 379(26): 2495-505 5 Ray-Coquard I et al.: N Engl J Med 2019; 381(25): 2416-28 6 Monk BJ et al.: J Clin Oncol 2022; 40(34): 3952-64 7 González-Martín A et al.: N Engl J Med 2019; 381(25): 2391-402 8 Monk BJ et al.: Ann Oncol 2024; 35(11): 981-92 9 Moore KN et al.: N Engl J Med 2023; 389(23): 2162-74 10 Martin LP et al.: Ann Oncol 2024; 35: S568-S9 11 Lee EK et al.: Ann Oncol 2024; 35: S550 12 Meric-Bernstam F et al.: JClin Oncol 2024; 42(1): 47-58 13 Oaknin A et al.: Ann Oncol 2024; 35: S547-S8 14 Wang D et al.: Ann Oncol 2024; 35: S548 15 Konecny GE et al.: Ann Oncol 2023; 34: S517 16 Hamanishi J et al.: J Clin Oncol 2015; 33(34): 4015-22 17 Infante JR et al.: Ann Oncol 2016; 27: vi300 18 Disis ML et al.: JAMA Oncol 2019; 5(3): 393-401 19 Varga A et al.: Gynecol Oncol 2019; 152(2): 243-50 20 González-Martín A et al.: J Clin Oncol 2024; 42(36): 4294-304 21 Trillsch F et al.: ESMO Open 2024; 9 22 Bowtell DD et al.: Nat Rev Cancer 2015; 15(11): 668-79 23 Fu S et al.: J Clin Oncol 2023; 41(9): 1725-34
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...