Fertilität in der onkologischen Nachsorge
Autorinnen:
PD Dr. Bettina Böttcher1
PD Dr. Tamara Diesch-Furlanetto2
PD Dr. Magdalena Balcerek3
1 Klinik für Gynäkologische Endokrinologie und Reproduktionsmedizin,
Medizinische Universität Innsbruck
2 Universitäts-Kinderspital beider Basel, Departement für Päd. Hämatologie/Onkologie
3 Charité-Universitätsmedizin Berlin, Klinik für Pädiatrie m. S. Onkologie und Hämatologie
Korrespondenz:
E-Mail: bettina.boettcher@i-med.ac.at
Onkologische Diagnostik und Therapie können zur Fruchtbarkeitseinschränkung führen. Fertilitätserhaltende und -schützende Maßnahmen bieten Kindern und Jugendlichen die Chance, wenn gewünscht, später im Leben leibliche Kinder zu bekommen.
Keypoints
-
Fertilitätsstörungen können unmittelbar oder erst Jahrzehnte nach einer Krebstherapie auftreten.
-
Fertilitätserhaltende Maßnahmen stehen zur Verfügung. Für präpubertäre Kinder sind sie jedoch noch experimentell.
-
Spontane Schwangerschaften nach einer Krebserkrankung sind möglich, mitunter sind unterstützende reproduktionsmedizinische Maßnahmen notwendig.
-
Schwangerschafts- und Geburtsverläufe sowie die Nachkommengesundheit sind weitestgehend vergleichbar mit jenen der Allgemeinbevölkerung.
Eine Krebserkrankung im Kindes- und Jugendalter kann meist erfolgreich behandelt werden. So betragen die 15-Jahres-Überlebensraten in Deutschland, Österreich und der Schweiz ca. 82%.1 Dennoch können die Diagnose und lebensnotwendige Therapie zu Spätfolgen führen, die die Lebensqualität sowie die körperliche und geistige Gesundheit beeinträchtigen. Dies bedeutet bei pädiatrischen Patient:innen, dass Spätfolgen mitunter im jungen Erwachsenenalter auftreten – einer Lebensphase, in der auch die Gründung einer eigenen Familie relevant wird.
Neun von zehn Überlebenden wünschen sich im Erwachsenenalter ein leibliches Kind.2 Studien zeigen, dass jedoch ca. ein Drittel der 20- bis 40-Jährigen von einer Fruchtbarkeitsstörung betroffen sind, die unmittelbar nach der Krebstherapie (z.B. bei Konditionierungstherapie vor Stammzelltransplantation, median 2,5 Jahre) auftreten oder sich erst Jahrzehnte danach manifestieren kann.3,4 Das Risiko für Fertilitätsstörungen ist u.a. abhängig vom Alter bei der Therapie, der Art und Dosis der Chemotherapie, der Bestrahlungsdosis und -lokalisation sowie von operativen Therapien. Hoch dosierte Alkylanzien und eine gonadale Bestrahlung gelten hierbei als Hochrisikofaktoren.5,6 Ein Sonderfall ist der hypogonadotrope Hypogonadismus bei Mangel an zentralen Gonadotropinen (z.B. nach einer kraniellen Bestrahlung), der jedoch mit einer Hormonersatztherapie behandelt werden kann.
Angesichts des oft drastisch verkürzten reproduktiven Zeitfensters ist es entscheidend, dass sich Patient:innen und ihre Familien frühzeitig mit der Familienplanung befassen. Evidenzbasierte Leitlinien empfehlen, bereits vor Therapiebeginn das individuelle Risiko einer Unfruchtbarkeit zu kommunizieren und fertilitätserhaltende Maßnahmen anzubieten.7 Diese erste Aufklärung erfolgt i.d.R. durch die behandelnden Onkolog:innen und sollte durch eine spezialisierte reproduktionsmedizinische Beratung ergänzt werden. Dieses Gespräch sollte auch zu Therapieabschluss und wiederholt in der Langzeitnachsorge angeboten werden. Zur Unterstützung der Gespräche sollten altersentsprechende Informationsmaterialien für Patient:innen bereitgestellt werden.8
Präventive Maßnahmen zum Fertilitätserhalt
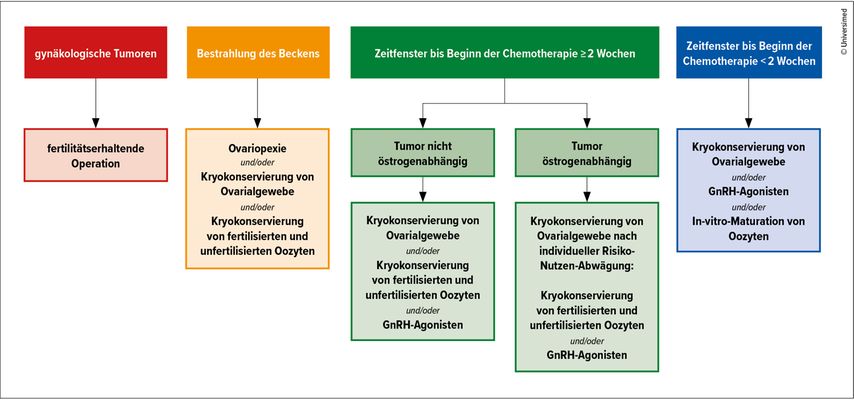
Welche fertilitätserhaltenden Maßnahmen vor, während oder nach einer Krebstherapie eingesetzt werden können, hängt u.a. vom Alter, von der Art der Krebserkrankung und von der geplanten Therapie sowie der allgemeinen Gesundheit ab (Abb. 1).7 Obwohl mittlerweile etablierte Maßnahmen zum Schutz der Fertilität – auch für Kinder und Jugendliche – zur Verfügung stehen, ist es bei einigen Krebserkrankungen und -therapien nicht möglich, diese bereits vor Behandlungsbeginn umzusetzen.
Abb. 1: Fertilitätsprotektive Maßnahmen für Frauen in Abhängigkeit von der onkologischen Therapie und dem verfügbaren Zeitfenster (modifiziert nach Dittrich R et al.)7
Daher sind ein adäquates Monitoring der Fruchtbarkeit nach der Therapie sowie eine erneute Beratung zu fertilitätserhaltenden Maßnahmen nach Therapieende umso wichtiger.7 Fertilitätserhaltende Maßnahmen können aufgrund des therapiebedingten verkürzten reproduktiven Zeitfensters auch nach der Therapie sinnvoll sein, insbesondere wenn bis zu diesem Zeitpunkt keine Maßnahmen ergriffen worden sind.
Mögliche fertilitätserhaltende Methoden
Kryokonservierung von Keimzellen
Die Kryokonservierung von Keimzellen (Eizellen bzw. Spermien) für eine spätere reproduktionsmedizinisch assistierte Kinderwunscherfüllung ist die am häufigsten angewandte Methode.
-
Bei pubertierenden Mädchen und erwachsenen Frauen erfolgt nach einer hormonellen Stimulation (ca. 10–14 Tage) die Eizellentnahme durch transvaginale oder transabdominale Punktion. Die Eizellen können unbefruchtet oder (bei bestehender Partnerschaft und Wunsch) befruchtet kryokonserviert werden.
-
Bei pubertierenden Jungen und erwachsenen Männern können Spermien für eine Kryokonservierung gesammelt werden. Sind im Ejakulat keine Spermien vorhanden, können Hodenbiopsate für eine spätere testikuläre Spermienextraktion (TESE) kryokonserviert werden.
Kryokonservierung von Ovargewebe
Diese Technik eignet sich besonders für präpubertäre Mädchen, da bei ihnen keine Eizellen zur Kryokonservierung entnommen werden können, oder wenn eine Kontraindikation zur Stimulation oder ein Zeitdruck hinsichtlich des Therapiebeginns bestehen. Das laparoskopisch entnommene Ovargewebe wird als Gewebestreifen eingefroren. Diese Fragmente können zu einem späteren Zeitpunkt autolog transplantiert werden. Bis heute konnten mit dieser Methode ca. 300 Kinder gezeugt werden,9 bei einer Schwangerschaftsrate von ca. 40%.10 Das Risiko einer Infiltration des Gewebes mit malignen Zellen sowohl bei Leukämien, Lymphomen als auch diversen soliden Tumoren ist zu beachten, weshalb eine Transplantation nach Therapie mitunter nicht infrage kommt.9 Das Gewebe könnte für noch experimentelle Verfahren wie die Maturation in vitro (IVM) dennoch verwendet werden.11
Ovarielle Gewebeaktivierung
Bei der ovariellen Gewebeaktivierung (IVM) können aus entnommenem Ovargewebe im Labor (in vitro) Eizellen herangereift werden, damit diese für eine Kryokonservierung oder Befruchtung gewonnen werden können. Diese Methode ist noch experimentell und wird daher nicht routinemäßig durchgeführt, könnte jedoch künftig eine breitere Anwendung finden, wenn mehr Erfolgsgeschichten und Forschungsergebnisse vorliegen.
GnRH-Analoga
GnRH-Analoga können insbesondere bei Frauen mit Mammakarzinom das Risiko einer vorzeitigen Ovarialinsuffizienz senken. Bei Jugendlichen ist die derzeitige Studienlage allerdings nicht eindeutig (AWMF-Leitlinie 015/082). Als alleinige Fertilitätsprotektion sollten GnRH-Analoga nicht eingesetzt werden. Nach einem anfänglichen Flare-up-Effekt, bei dem es zu einer kurzzeitig erhöhten Gonadotropinsekretion kommt, erfolgt eine Inaktivierung der Ovarien. GnRH-Analoga können während der Chemotherapie monatlich oder alle drei Monate verabreicht werden.
Testikuläre Gewebekryokonservierung
Bei präpubertären Jungen wird derzeit die Entnahme von Hodengewebe als Fertilitätsreserve untersucht. Nach Therapie könnte das Gewebe reaktiviert werden, um die Spermien zu gewinnen, oder reimplantiert werden, um im Körper auszureifen. Diese Methode konnte bereits bei Rhesusaffen erfolgreich durchgeführt werden.12 Beim Menschen ist sie jedoch experimentell, ohne dass dieses Gewebe bis dato transplantiert wurde. Auch hier ist das Risiko einer potenziellen Infiltration mit malignen Zellen zu beachten. Diese Methode wird nur in wenigen spezialisierten Zentren durchgeführt, da sie ein hohes Maß an Fachwissen und technologischen Fähigkeiten erfordert.
Monitoring der Fertilitätin der Nachsorge
Bei pädiatrischen Krebsüberlebenden sollte die Pubertätsentwicklung im Rahmen der Nachsorgetermine anhand der Tanner-Stadien überwacht und dokumentiert werden. Bei menstruierenden Patientinnen ist ein regelmäßiger Menstruationszyklus ein wichtiger Parameter zur Beurteilung der Ovarfunktion. Bei männlichen Adoleszenten wird das Hodenvolumen mithilfe eines Orchidometers bestimmt.
Laut der aktuellen AMWF-Leitlinie zur Langzeitnachsorge werden zudem Hormonanalysen ab dem 14. Lebensjahr empfohlen (FSH, LH sowie Inhibin B bei Jungen bzw. AMH bei Mädchen). Falls im Alter von 14 Jahren keine Pubertätsanzeichen auftreten, die Pubertätsentwicklung stagniert oder die Menarche/Spermarche bis zum 16. Geburtstag ausbleibt, sollte eine endokrinologische Beratung zur Pubertätsinduktion erfolgen.7
Im weiteren Verlauf sollte bei jugendlichen sowie jungen erwachsenen Patient:innen geprüft werden, ob ein Bedarf und Wunsch nach Kontrazeption bestehen oder ob eine Hormonersatztherapie aufgrund einer frühen Ovarialinsuffizienz erforderlich ist. Bei Vorliegen einer frühen Ovarialinsuffizienz sollte eine Hormonersatztherapie bis zum Erreichen des natürlichen Menopausealters von 50–52 Jahren fortgeführt werden.7
Kinderwunscherfüllung nach onkologischer Therapie
Bei regelmäßigen Zyklen bzw. Normozoospermie und unauffälliger hormoneller Situation sind Spontanschwangerschaften möglich. Allerdings sollte bei ehemaligen Patient:innen eine präkonzeptionelle Beratung erfolgen, um mögliche Komorbiditäten wie z.B. die kardiale Situation nach einer Anthrazyklintherapie abzuklären, da sich eine kardiale Vorschädigung im Rahmen einer Schwangerschaft verschlechtern kann und dann ein entsprechendes Monitoring mit Anbindung in einer spezialisierten Klinik erforderlich wird.13 Wenn eine Subfertilität vorliegt, können reproduktionsmedizinische Maßnahmen wie die In-vitro-Fertilisation (IVF) oder die intrazytoplasmatische Spermieninjektion (ICSI) nach ovarieller Stimulation angewandt werden.
Hierfür können – soweit vorhanden – sowohl frische als auch kryokonservierte Keimzellen verwendet werden. Ebenso kann auf kryokonserviertes Gewebe zurückgegriffen werden. Die Erfolgsaussichten variieren je nach der Art der Behandlung und dem Alter der Patientin. Einige Schlüsselfaktoren umfassen:
Kryokonservierung von Eizellen
Bei Mädchen/Frauen, denen vor der Therapie Eizellen entnommen worden sind, liegen die Chancen, nach der Behandlung eine Schwangerschaft zu erreichen, bei etwa 30–50% pro Zyklus, abhängig von der Qualität der Eizellen und der Art der IVF. Auch nach abgeschlossener Krebstherapie können – ggf. mit eingeschränktem Erfolg und unter Berücksichtigung eines möglicherweise verkürzten reproduktiven Zeitfensters – noch Eizellen für eine Kryokonservierung gewonnen werden. Eizellen, die älter oder weniger reif sind, haben geringere Chancen, erfolgreich befruchtet zu werden.
Transplantation von Eierstockgewebe
Die Erfolgschancen bei dieser Methode variieren, da die Transplantation von Gewebe nach der Krebsbehandlung technisch anspruchsvoll ist. Die Erfolgsraten liegen bei etwa 30–40%, da nicht alle transplantierten Gewebe erfolgreich reaktiviert werden können.10
Kryokonservierung von Spermien
Bei Jungen/Männern, die vor Therapie Spermien abgeben konnten, liegt die Wahrscheinlichkeit, mit diesen eine Schwangerschaft zu erreichen, bei 70–80%, abhängig von der Spermienqualität und der Befruchtungsmethode (z.B. IVF).
Kryokonservierung von testikulärem Gewebe
Für präpubertäre Jungen, bei denen Hodengewebe kryokonserviert wurde, gibt es noch keine etablierten Erfolgsraten, da dies eine experimentelle Methode ist, die bislang noch nicht beim Menschen angewandt wurde. Die Chancen hängen stark davon ab, ob es medizinisch künftig gelingt, nach der Krebsbehandlung reife Spermien aus dem kryokonservierten Gewebe zu gewinnen.
Je nach nationaler Gesetzeslage können zur Erfüllung des Kinderwunschs auch eine Samen-, Eizell- oder Embryonenspende in Betracht gezogen werden. Auch eine Adoption ist eine Möglichkeit zur Verwirklichung des Kinderwunschs und sollte frühzeitig angesprochen werden.
Insgesamt gehen die Schwangerschafts- und Geburtsverläufe bei Frauen mit einer Krebserkrankung im Kindesalter nicht mit mehr Komplikationen wie Gestationsdiabetes oder Präeklampsie im Vergleich zur Allgemeinbevölkerung einher.14,15 Allerdings zeigen sich erhöhte Raten an Frühaborten,16 Frühgeburten,17 insbesondere nach einer Radiatio des Uterus, Geburtseinleitungen und Kaiserschnitten.
Es wird empfohlen, nach einer Krebserkrankung vor der Schwangerschaft ein rezidivfreies Intervall nach beendeter Therapie abzuwarten. Hierfür reichen die Empfehlungen bei Frauen sechs Monate bis zu zwei Jahre. Bei Männern wird ein Zeitraum von mindestens drei Monaten zur Erholung der Spermatogenese angeraten.18 In einer retrospektiven Analyse zeigten sich erhöhte Raten an Früh- und Totgeburten bei Eintritt einer Schwangerschaft innerhalb des ersten Jahres nach Therapieende.19 Die meisten Kinder werden nach einer Krebstherapie der Eltern jedoch gesund, reif und eutroph geboren,20 wobei auch das Risiko für Fehlbildungen und maligne Erkrankungen für diese Kinder15,21 nicht erhöht ist, sofern keine familiäre bzw. genetische Tumorprädisposition vorliegt.
Kosten
Bei der Inanspruchnahme von reproduktionsmedizinischen Maßnahmen sind die länderspezifischen gesetzlichen Regelungen sowie die jeweilige Altersbegrenzung zu beachten.
In Deutschland werden die Entnahme und die Kosten für die Kryokonservierung und Lagerung von Keimzellen und Keimzellgewebe im Rahmen einer gonadotoxischen Therapie ab der Pubertät und bis zum Alter von 40 Jahren bei Frauen bzw. 50 Jahren bei Männern von den Krankenkassen erstattet. Nicht regelhaft übernommen werden bis dato die Kosten der Hormone zur Ovarstimulation bei Patientinnen unter 18 Jahren.
In der Schweiz übernehmen die Krankenkassen die Kosten für Fertilitätserhaltungsmaßnahmen sowie die Lagerungskosten bei onkologisch erkrankten Jugendlichen und jungen Erwachsenen (<40 Jahren).
In Deutschland und der Schweiz werden fertilitätserhaltende Maßnahmen bei präpubertären Patient:innen als experimentell betrachtet und sind daher nicht gedeckt. In solchen Fällen besteht jedoch die Möglichkeit, dass Stiftungen die Kosten übernehmen. Eine spätere IVF wird in Deutschland unter bestimmten Voraussetzungen sowie in der Schweiz bislang nicht von den Krankenkassen übernommen.
In Österreich werden die Kosten für fertilitätsprotektive Maßnahmen derzeit nicht von den Krankenkassen übernommen. Medikamente zur hormonellen Ovarstimulation, die Aufbereitung von Samen, Eizellen oder Ovargewebe sowie Lagerungskosten müssen selbst gezahlt werden. Der sogenannte IVF-Fonds kann bei Vorliegen einer Indikation, wie polyzystisches Ovarsyndrom, Endometriose, beidseitiger Tubenverschluss oder Pathospermie, bis zum 40. Geburtstag der Frau und bis zum 50. Geburtstag des Mannes ggf. anteilig in Anspruch genommen werden.
Fazit
Zusammenfassend lässt sich sagen, dass fruchtbarkeitserhaltende Maßnahmen mittlerweile eine etablierte Praxis in der onkologischen Versorgung darstellen – auch für Kinder und Jugendliche, insbesondere für diejenigen, bei denen eine Schädigung der Fruchtbarkeit durch die Krebstherapie droht. Die Wahl der passenden Methode hängt von verschiedenen Faktoren ab und die Fortschritte in der medizinischen Forschung und Behandlung eröffnen immer mehr Möglichkeiten, die Fertilität zu bewahren. Obwohl nicht alle Methoden eine Erfolgsrate von 100% garantieren, bieten sie betroffenen Kindern und Jugendlichen später die Chance, ihre Fruchtbarkeit zu erhalten und, wenn gewünscht, leibliche Kinder zu bekommen.
Literatur:
1 Erdmann FK et al.: Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2020 2 Korte E et al.: J Adolesc Young Adult Oncol 2020; 9(1): 55-62 3 Pfitzer C et al.: J Cancer Res Clin Oncol 2015; 141(1): 135-42 4 Balcerek M et al.: Dtsch Arztebl Int 2012; 109(7): 126-31 5 Van Dorp W et al.: J Clin Oncol 2016; 34(28): 3440-50 6 Mulder RL et al.: Lancet Oncol 2021; 22(2): e57-67 7 Dittrich R et al.: Geburtshilfe Frauenheilkd 2018; 78(6): 567-84 8 Borgmann-Staudt A et al.: Psychooncology 2019; 28(11): 2218-25 9 Dolmans MM et al.: Fertil Steril 2013; 99(6): 1514-22 10 Pacheco F, Oktay K: Reprod Sci 2017; 24(8): 1111-20 11 Segers I et al.: J Assist Reprod Genet 2015; 32(8): 1221-31 12 Kanbar M et al.: Best Pract Res Clin Endocrinol Metab 2019; 33(1): 103-15 13 Bar J et al.: Am J Obstet Gynecol 2003; 189(3): 853-7 14 Melin J et al.: Obstet Gynecol 2015; 126(4): 803-10 15 Mueller BA et al.: Arch Pediatr Adolesc Med 2009; 163(10): 879-86 16 Velentgas P et al.: Cancer 1999; 85(11): 2424-32 17 Van de Loo L et al.: Fertil Steril 2019; 111(2): 372-80 18 Kliesch S: Urologe A 2016; 55(7): 898-903 19 Mulvihill JJ et al.: Cancer 1987; 60(5): 1143-50 20 Sommerhäuser G et al.: Journal Cancer Surviv 2021; 15(2): 259-72 21 Lawrenz B et al.: Onkologie 2012; 35(3): 128-32
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...