Feintuning im Bereich von Risikoeinschätzung und Therapie
Bericht:
Dr. Judith Moser
Von 14. bis 17. Mai wurde in München der „ESMO Breast Cancer“-Kongress 2025 abgehalten, der über 3600 Teilnehmer:innen aus 103 Ländern anzog. Highlights unter den 476 präsentierten Abstracts bildeten heuer zu einem Gutteil neue Erkenntnisse auf dem Gebiet der Outcome-Prädiktion beim frühen Mammakarzinom, aber auch Ergebnisse klinisch-therapeutischer Studien.
APHINITY – Langzeitdaten
Nach einem Follow-up von 11,3 Jahren wurden am ESMO Breast Cancer 2025 von Loibl et al. die endgültigen Ergebnisse der Phase-III-Studie APHINITY präsentiert.1
APHINITY prüfte die Fragestellung, ob durch die Zugabe von Pertuzumab zur adjuvanten Therapie mit Trastuzumab plus Chemotherapie beim frühen HER2-positiven Mammakarzinom langfristig das Überleben ohne invasive Erkrankung (IDFS) verlängert werden kann. Insgesamt erhielten 4804 Patient:innen innerhalb von acht Wochen nach der chirurgischen Resektion entweder das Prüfregime oder Placebo zusätzlich zu Trastuzumab plus Chemotherapie. Bei jeweils 64% waren die Tumoren Hormonrezeptor(HR)-positiv, und rund zwei Drittel wiesen eine nodale Beteiligung auf. Die 2017 vorgestellte primäre IDFS-Analyse hatte eine 19%ige Verbesserung durch die Zugabe von Pertuzumab ergeben (HR: 0,81; p=0,045).2
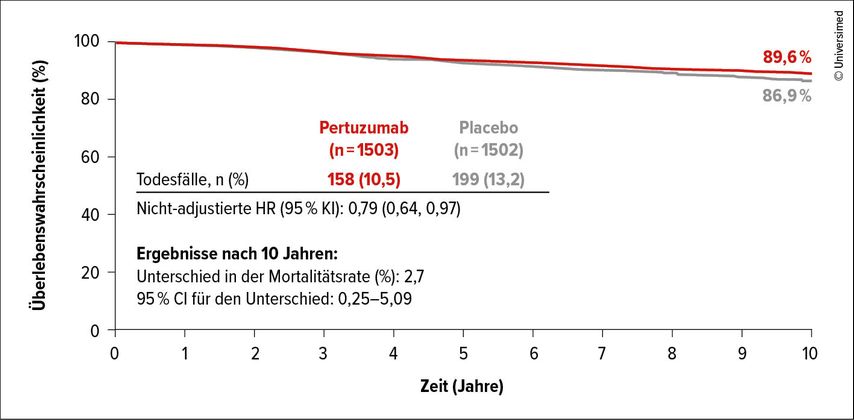
Laut finaler Analyse zum Gesamtüberleben (OS) bewirkte die duale HER2-Blockade eine signifikante Reduktion der 10-Jahres-Mortalitätsrate mit einem absoluten Unterschied von 1,8% (91,6% vs. 89,8%; HR: 0,83; p=0,0441).1 Für den Benefit war die nodal-positive Kohorte ausschlaggebend: Hier lagen die IDFS-Raten nach zehn Jahren bei 89,6% vs. 86,9% (HR: 0,79; Abb. 1), während in der nodal-negativen Gruppe kein Unterschied resultierte (HR: 0,99). Progressionsereignisse manifestierten sich hauptsächlich in Form einer Fernmetastasierung (erstes IDFS-Ereignis: 6,3% vs. 8,8%). Anhaltende Effekte zeigte auch die aktualisierte IDFS-Analyse, die einen absoluten Unterschied von 3,4% mit 10-Jahres-Raten von 87,2% vs. 83,8% erbrachte (HR: 0,79). Ebenso wie in Bezug auf das OS trat der Vorteil der Zugabe von Pertuzumab ausschließlich in der nodal-positiven Gruppe zutage. Eine weitere Subklassifizierung zeigte, dass die Patient:innen mit sowohl nodal-positiven als auch HR-positiven Tumoren am deutlichsten profitierten.
Abb. 1: Nodal-positive Kohorte der APHINITY-Studie: Gesamtüberleben nach zehn Jahren (modifiziert nach Loibl S et al.)1
Im Laufe des verlängerten Follow-ups wurden keine neuen kardialen Signale gemeldet. Primäre kardiale Ereignisse traten in beiden Armen mit einer Häufigkeit von <1% auf. Wie die Autor:innen in ihrer Conclusio festhalten, untermauern die finalen Daten den Benefit von Pertuzumab zusätzlich zu adjuvantem Trastuzumab und Chemotherapie beim frühen Mammakarzinom.
Neoadjuvante CDK4/6-Inhibitions-Therapie + ET: ADAPTcycle
Die Phase-III-Studie ADAPTcycle widmete sich der Frage, ob eine CDK4/6-Inhibition plus endokrine Therapie (ET) beim frühen HR-positiven/HER2-negativen Mammakarzinom mit intermediärem bis hohem Risiko die Chemotherapie ersetzen kann. In der neoadjuvanten Kohorte wurden 341 Patient:innen mit Ribociclib plus Aromataseinhibition (und GnRH-Analogon bei prämenopausalen Frauen) gefolgt von ET behandelt; im Kontrollarm (n=213) gelangte die Standard-Chemotherapie gefolgt von ET zur Anwendung. Als Therapiedauer wurden sechs Monate empfohlen. Die Risikostratifizierung erfolgte auf Basis des Lymphknotenstatus, des Ansprechens auf eine Induktions-ET und des Recurrence Score® (RS) laut Oncotype DX®. ADAPTcycle ist die erste Phase-III-Studie, die beim frühen HR-positiven/HER2-negativen Mammakarzinom einen Direktvergleich der beiden Strategien durchführte.
Gemäß der von Harbeck et al. präsentierten Auswertung waren die Raten pathologischer Komplettremissionen (pCR) in beiden Therapiearmen vergleichbar niedrig (5,7% vs. 7,1%; OR: 0,79; p=0,542).3 Wenn fast komplette pathologische Remissionen dazugezählt wurden, fand sich ein Trend zugunsten der Chemotherapie (9,5% vs. 15,4%; OR: 0,58; p=0,05). Hinsichtlich des klinischen Ansprechens schnitt der Kontrollarm ebenso etwas besser ab (78,0% vs. 93,3%; OR: 0,25; p=0,009), jedoch profitierte der Großteil der mit Ribociclib behandelten Patient:innen, da nur zwei eine Progression entwickelten. In der Subgruppe mit 1–3 positiven Lymphknoten betrugen die pCR-Raten 6,1% vs. 7,4%, während bei einem stärkeren nodalen Befall keinerlei Ansprechen zu verzeichnen war. Niedrige pCR-Raten in beiden Armen fanden sich auch bei hohem Rezidivrisiko gemäß RS (8,0% vs. 7,6%) sowie bei ET-Respondern (6,1% vs. 7,5%).
Diesen Ergebnissen zufolge kann der Benefit der Chemotherapie auch bei Patient:innen begrenzt sein, die unter der Annahme, dass eine ET unzureichend wäre, chemotherapeutisch behandelt werden. Allerdings steht eine definitive Abklärung der klinischen Relevanz der pCR bei Luminal-B-like-Tumoren noch aus, und weitere Studienergebnisse sind abzuwarten.
Genexpressionstests auf dem Prüfstand
Multiparametrische Genexpressions-Assays (MPA) wie Oncotype DX® werden häufig genutzt, um den potenziellen Benefit einer Chemotherapie vorherzusagen. Im Zentrum der im Laufen befindlichen randomisierten, kontrollierten OPTIMA-Studie steht die Validierung von MPA bei Patient:innen mit Östrogenrezeptor(ER)-positivem/HER2-negativem frühem Mammakarzinom und hohem Risiko.
Am ESMO Breast Cancer 2025 wurden erstmals die klinischen Outcomes aus OPTIMA prelim, dem „Feasibility“-Teil der OPTIMA-Studie, vorgestellt.4 Die Teilnehmer:innen waren in den Jahren 2012–2014 randomisiert worden. Der Kontrollarm (n=192) erhielt eine Standard-Chemotherapie gefolgt von ET. Im Prüfarm (n=195) bildete die Risikoeinschätzung die Basis für die Wahl der Behandlung mit Chemotherapie gefolgt von ET (RS>25) oder alleiniger ET (RS≤25). OPTIMA prelim hat in der Vergangenheit bereits signifikante Abweichungen zwischen verschiedenen Assays gezeigt.5
Nach einem medianen Follow-up von zehn Jahren unterschieden sich die klinischen Ergebnissen zwischen dem Prüfarm und dem Kontrollarm nicht.4 Bei 15% vs. 12% war es zu Rezidiven gekommen, die sich bei 6% vs. 1% als Lokoregionalrezidive und bei 9% vs. 11% als Fernmetastasierung manifestierten. Allerdings handelt es sich dabei um exploratorische Daten, da OPTIMA prelim nicht im Hinblick auf den Nachweis einer Nichtunterlegenheit gepowert war.
Bei 383 Patient:innen erfolgte darüber hinaus eine Testung sowohl mit Oncotype DX® als auch mit Prosigna®. Im Vergleich zeigte sich hier, dass Prosigna® eine Personengruppe (22%) mit ungünstigen Outcomes identifizierte, die laut Oncotype DX® niedrige Rezidiv-Scores aufwiesen. Dies ist mit Erkenntnissen aus größeren Datensätzen auf der Basis von Forschungsversionen der Tests konsistent.6 Für 2026 werden die Hauptergebnisse der OPTIMA-Studie erwartet, die auch eine Nichtunterlegenheitsanalyse der Chemotherapieindikation laut Testung einschließt.
Prognostische Kraft der ctDNA
Eine retrospektive Analyse prüfte die Assoziation der Konzentration von zirkulierender Tumor-DNA(ctDNA)zum Diagnosezeitpunkt mit dem Überleben ohne Fernmetastasierung (DRFS) bei 712 Patient:innen mit frühen Hochrisiko-Mammakarzinomen, die in der I-SPY-2-Studie eine neoadjuvante Therapie erhalten hatten.7 Tatsächlich konnte der ctDNA-Status als signifikanter prognostischer Biomarker für das DRFS identifiziert werden. Nach 36 Monaten waren 96,8% der Patient:innen mit ursprünglich negativen Proben frei von Fernmetastasierung, während dies in der Gruppe mit positiver Ausgangs-ctDNA nur auf 80,9% zutraf (HR: 5,5; p<0,001).
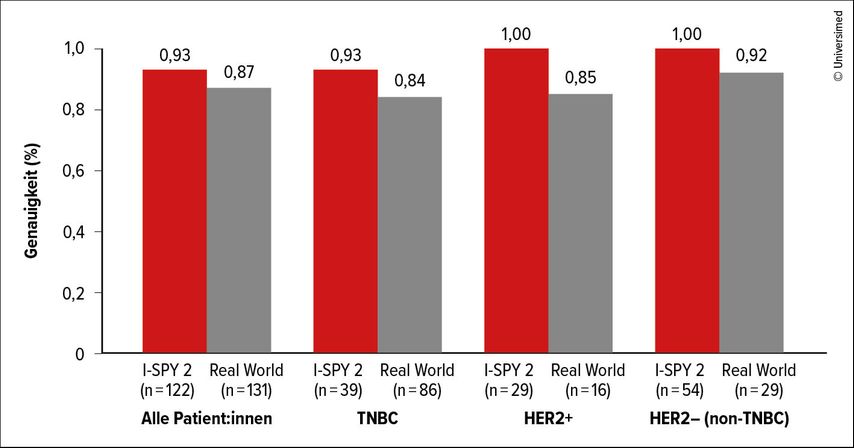
Die ctDNA-Konzentration (MTM/ml) korrelierte unabhängig vom Rezeptorsubtyp (HR+/HER2–, HER2+, Tripelnegativität) mit dem DRFS. Es fand sich eine lineare Assoziation zwischen vier ctDNA-Konzentrationskategorien und der Rezidivwahrscheinlichkeit. Die Wissenschaftler:innen entwickelten zudem unter Zuhilfenahme von maschinellem Lernen ein DRFS-Prädiktionsmodell, das bei verschiedenen Mammakarzinom-Subtypen hohe Genauigkeit zeigte und sich sowohl in der I-SPY-2-Studie als auch im Rahmen der Validierung unter Real-World-Bedingungen bewährte (Abb. 2). Dem Modell zufolge stellt die ctDNA-Konzentration innerhalb der Gruppe der zum Diagnosezeitpunkt verfügbaren prognostischen Faktoren den wichtigsten Prädiktor für das DRFS dar.
Abb. 2: Genauigkeit der Prädiktion des Überlebens ohne Fernmetastasierung laut ctDNA unter Studien- und Real-World-Bedingungen (modifiziert nach Magbanua M et al.)7
Einschränkend weisen die Autor:innen darauf hin, dass das Ansprechen auf die Therapie bekanntermaßen alle vorbestehenden Risikofaktoren beeinflussen kann. Im Laufen befindliche Analysen zielen nun darauf ab, die DRFS-Prädiktion zu optimieren, indem sie verschiedene Kombinationen von Variablen einschließlich Ansprechen und ctDNA-Dynamik einbeziehen.
TIL bei TNBC und pCR
Im Setting des tripelnegativen Mammakarzinoms (TNBC) weist das Erreichen einer pCR durch die neoadjuvante Therapie auf eine günstige Prognose hin, allerdings garantiert auch dieser Parameter keine Rezidivfreiheit. Massa et al. prüften daher bei 613 Patient:innen aus GAMBIT, dem europäischen Real-World-Netzwerk für TNBC, die prognostische Wertigkeit tumorinfiltrierender Lymphozyten (TIL) nach Erreichen einer pCR.8
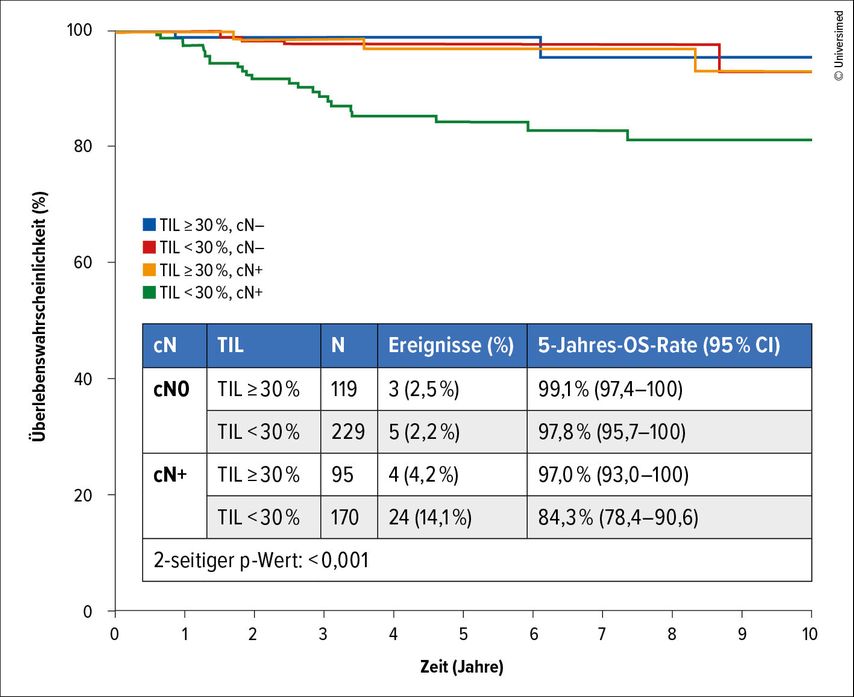
Laut multivariabler Analyse erwiesen sich der Anteil der TIL sowie der nodale Status (positiv vs. negativ) als unabhängig prognostisch sowohl für das DRFS als auch für das OS. Ein TIL-Anstieg um 5% korrelierte mit Risikoreduktionen um 10% (Fernmetastasierung) bzw. 11% (Mortalität). Die Analyse identifizierte zudem eine zuvor unbekannte Subgruppe mit einem gesteigerten Rezidivrisiko: Bei Patient:innen, die sowohl einen Lymphknotenbefall als auch einen niedrigen TIL-Prozentsatz unterhalb des Cut-off von 30% aufwiesen, betrug das DRFS nach fünf Jahren 83%, während es in allen anderen Subgruppen bei mindestens 95% lag. Ebenso unterschritt die Fünf-Jahres-OS-Rate (84%) deutlich die Raten in den anderen Kollektiven, die sich auf ≥97% beliefen (Abb. 3).
Abb. 3: Gesamtüberleben in Abhängigkeit vom nodalen Status und vom Prozentsatz tumorinfiltrierender Leukozyten (TIL; modifiziert nach Massa D et al.)8
Diese Ergebnisse entsprechen Risikosteigerungen um den Faktor 3 (DRFS) bzw. 5 (OS). Wie die Autor:innen hervorheben, handelt es sich bei TIL um ein kosteneffektives und universell anwendbares Stratifikations-Tool. Derzeit erfolgt eine Validierung der Daten bei GAMBIT-Patient:innen, die mit neoadjuvanter Chemotherapie plus Pembrolizumab behandelt werden.
Kombinationsdaten aus EMBER-3
Im Setting des ER-positiven/HER2-negativen metastasierten Mammakarzinoms wurde der selektive ER-Degrader (SERD) Imlunestrant in der Phase-III-Studie EMBER-3 mit einer endokrinen Standardtherapie sowie der Kombination aus Imlunes-trant und Abemaciclib verglichen. Bei Patient:innen, die unter oder nach der Therapie mit Aromatase-Inhibitoren (AI) mit oder ohne CDK4/6-Inhibition progredient geworden waren, bedingte die Kombination im Vergleich zu Imlunestrant alleine eine signifikante PFS-Verlängerung.9 Saura et al. präsentierten am ESMO Breast Cancer 2025 Ergebnisse aus der klinisch relevanten Subgruppe der mit CDK4/6-Inhibitoren Vorbehandelten.10 In diesem Kollektiv hatten 139 die Kombination erhalten und 140 die Imlunestrant-Monotherapie.
Der Umstand, dass die Progression bereits unter der vorangegangenen CDK4/6-Inhibitor-Therapie eingetreten war, beeinträchtigte den Effekt der Gabe von Abemaciclib plus Imlunestrant nicht. Das PFS betrug 9,1 unter der Kombination vs. 3,7 Monate unter Imlunestrant alleine (HR: 0,51) und war mit dem PFS in der Gesamtpopulation vergleichbar (9,4 vs. 5,5 Monate; HR: 0,57). Es fanden sich konsistente PFS-Ergebnisse unabhängig vom Vorhandensein von viszeralen und ossären Metastasen, ESR1- und/oder PI3K-Mutationen sowie vom Vorliegen einer Hochrisikoerkrankung und der Art und Dauer der vorangegangenen CDK4/6-Inhibitor-Therapie.
EMBER-3 ist die erste Phase-III-Studie, die den Benefit einer Kombination aus einem oralen SERD und einem CDK4/6-Inhibitor nach Krankheitsprogression unter CDK4/6-Inhibition demonstriert, wie die Autor:innen zusammenfassend festhalten.
Quelle:
European Society of Medical Oncology (ESMO) Breast Cancer 2025, 14.–17. Mai 2025, München, Deutschland
Literatur:
1 Loibl S et al.: ESMO Breast Cancer 2025; Abstr. #LBA1 2 Von Minckwitz G et al.: Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. New Engl J Med 2017; 377(2): 122-31 3 Harbeck N et al.: ESMO Breast Cancer 2025; Abstr. #189O 4 Stein C et al.: ESMO Breast Cancer 2025; Abstr. #190O 5 Bartlett JMS et al.: J Natl Cancer Inst 2016; 108(9): djw050 6 Bartlett JMS et al.: Comparative survival analysis of multiparametric tests-when molecular tests disagree-A TEAM Pathology study. NPJ Breast Cancer 2021; 7(1): 90 7 Magbanua M et al.: ESMO Breast Cancer 2025; Abstr. #5MO 8 Massa D et al.: ESMO Breast Cancer 2025; Abstr. #2O 9 Jhaveri KL et al.: Imlunestrant with or without abemaciclib in advanced breast cancer. N Engl J Med 2025; 392(12): 1189-202 10 Saura C et al.: ESMO Breast Cancer 2025; Abstr. #2970
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...