Erste Real-World-Daten und Identifikation prognostischer/prädiktiver Biomarker
Bericht:
Mag. Dr. Anita Schreiberhuber
Beim dritten europäischen CAR T-Cell Meeting wurden Langzeitdaten der JULIET-Studie sowie Real-World-Ergebnisse zu verschiedenen CAR-T-Zell-Therapien vorgestellt. Unter den spannendsten Präsentationen waren außerdem jene zur Entwicklung eines Scores zur Prädiktion CAR-T-Zell-mediierter Hämatotoxizität sowie jene zur Auswirkung des enteralen Mikrobioms und von Antibiotikatherapien auf den Therapieerfolg.
Myc-Status und CD3+ T-Zellen als prognostische Biomarker
Beim Jahreskongress der American Society of Hematology (ASH) wurden Langzeitergebnisse der Phase-II-Studie JULIET nach einem medianen Follow-up (FU) von 40,3 Monaten präsentiert, in der die CAR-T-Zell-Therapie mit Tisagenlecleucel (Kymriah®; Tisa-Cel) bei Patienten mit rezidiviertem/refraktärem (rr) diffus großzelligem B-Zell-Lymphom (DLBCL) untersucht wurde. Das mediane progressionsfreie Überleben (PFS) nach 24 bzw. 36 Monaten betrug 33% bzw. 31%. Die Wahrscheinlichkeit für ein anhaltendes Ansprechen der Responder nach 24 bzw. 36 Monaten belief sich auf 60%.1
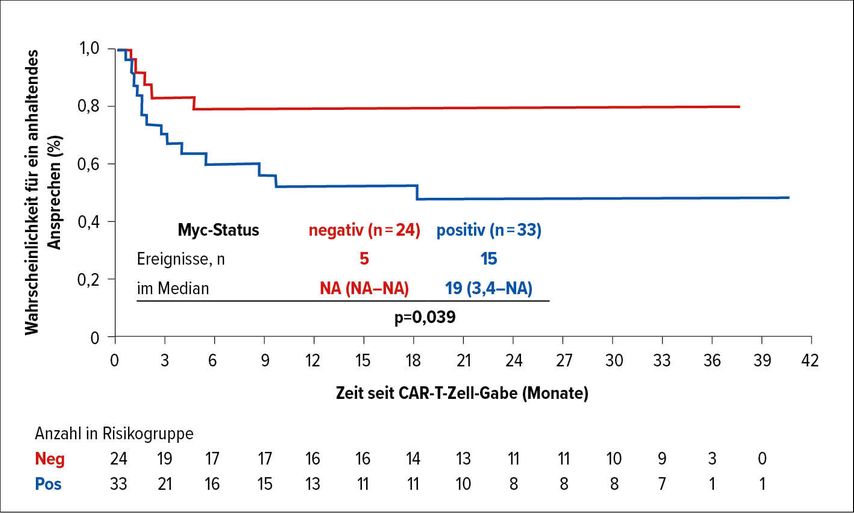
Prof. Dr. Paolo Corradini, Universität Mailand, präsentierte beim diesjährigen europäischen CAR T-Cell Meeting die Ergebnisse einer Substudie von JULIET, in der die Assoziation zwischen Myc-Überexpression, Zahl der tumorinfiltrierenden CD3+ Lymphozyten und Ansprechen auf die CAR-T-Zell-Therapie untersucht wurde. Zu Beginn wurde der Myc-Status von 111 Patienten mittels Immunhistochemie untersucht: Bei 73 Patienten wurde eine Myc-Positivität und bei 38 eine Myc-Negativität nachgewiesen. Ein negativer Myc-Status konnte als positiver Prädiktor für den Therapieerfolg identifiziert werden. Während 18 von 38 Myc-negativen Patienten (47%) innerhalb von sechs Monaten ein partielles bzw. komplettes Ansprechen (PR/CR) erzielten, traf dies im Myc-positiven Kollektiv auf 18 von 73 Patienten (25%) zu. Außerdem hatten Myc-negative Patienten vs. jene mit einer Myc-Überexpression ein im Median signifikant längeres PFS (6,2 vs. 2,5 Monate; p=0,0093) und eine signifikant längere Ansprechdauer (DOR; nicht erreicht vs. 19 Monate; p=0,039). Bei Betrachtung der Kurven zeigt sich, dass sich die DOR bereits nach ca. 6 Monaten auf ein Plateau einstellt (Abb. 1). Das mediane Gesamtüberleben (OS) war bei einer Myc-Negativität vs. eine Myc-Überexpression numerisch länger, dieser Unterschied war jedoch statistisch nicht signifikant (21,0 vs. 7,8 Monate; p=0,12).
Abb. 1: Dauer des Ansprechens auf CAR-T-Zell-Therapie bei Myc-negativen und Myc-positiven Patienten (nach Corradini et al.)2
Bezüglich der Quantität tumorinfiltrierender CD3+ T-Zellen konnte festgestellt werden: Der Nachweis keiner oder einer niedrigen Zahl an tumorinfiltrierenden CD3+ T-Zellen (≤3%) war mit einem schlechteren Outcome assoziiert im Vergleich zu einer normalen bzw. hohen Zahl (>3%). Dies traf auf Ansprechen, DOR, OS und PFS zu, wobei die Ergebnisse für das PFS und das OS signifikant waren (p=0,022 bzw. p=0,032). „Die CD3+ T-Zellen sind ein einfach zu bestimmender Marker, der einen großen klinischen Nutzen bietet“, äußerte sich Corradini zu diesem Prädiktor.2
Real-World-Daten zur CAR-T-Zell-Therapie
Prof. Dr. Marcelo Pasquini, Medical College of Wisconsin, präsentierte Ergebnisse zum Einsatz von Tisa-Cel und Axicabtagen-Ciloleucel (Yescarta®; Axi-Cel) im Real-World-Setting hinsichtlich des Auftretens von Nebenwirkungen (AE) und des Therapieerfolgs, die mit dem „cellular therapy registry“ erhoben wurden. Das Ziel des „cellular therapy registry“ war die Entwicklung einer Datenbank und Durchführung einer Observationsstudie, in die 2016 der erste Patient im Rahmen der Pilotphase eingebracht werden konnte.
Interessant ist, dass sowohl bei der Indikation akute lymphatische Leukämie (ALL) als auch beim Non-Hodgkin-Lymphom (NHL) die Zahl der Patienten mit vorangegangener hämatopoietischer Stammzelltransplantation zwischen 2017 und 2020 abnahm.
Zwischen Oktober 2017 und September 2019 erhielten 750 Patienten eine Infusion mit Axi-Cel. Von 533 Patienten lagen vollständige Daten vor, die analysiert werden konnten. Das mediane FU lag bei 6,2 Monaten. Das Auftreten eines „cytokine release syndrome“ (CRS) kam bei <65- und ≥65-Jährigen vergleichbar häufig vor; ≥93% der betroffenen Patienten erholten sich wieder.Neurotoxizitäten und „immune effector cell-associated neurotoxicity syndrome“ (ICANS) Grad 1–3 traten bei den ≥65- vs. <65-Jährige etwas häufiger auf und dauerten im Median 10 bzw. 7 Tage an, bei 87% bzw. 89% waren diese AE reversibel.
Das Analyseset für Tisa-Cel umfasste vollständige Daten für 410 von insgesamt 583 Patienten, davon hatten 255 eine ALL und 155 ein NHL. In der Indikation ALL waren die Ergebnisse zu DOR, EFS (ereignisfreies Überleben) und OS mit jenen aus der Zulassungsstudie ELIANA4 vergleichbar. Dasselbe gilt für den Vergleich des PFS in der Indikation NHL mit jenem aus der Zulassungsstudie JULIET.5 Mit 66,6% vs. 55,3% lag die DOR etwas unter und mit 61,2% vs. 70,7% das OS nach sechs Monaten etwas über den Ergebnissen aus JULIET.5 Insgesamt bezeichnete Pasquini aber die ersten Daten aus dem Registry als mit jenen aus den Zulassungsstudien vergleichbar.3
Score zur Prädiktion von Hämatotoxizitäten
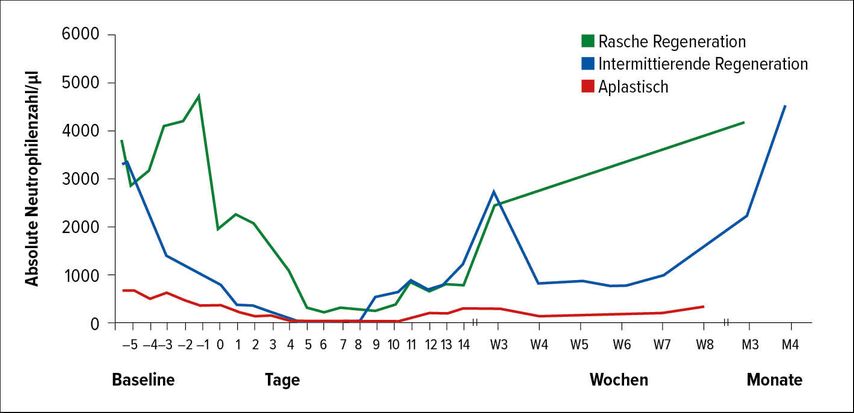
„Hämatotoxizität stellt nicht nur eine Manifestation des CRS dar, sondern ist eine relevante CAR-T-Zell-assoziierte AE, die noch länger nach Abklingen eines CRS oder der Lymphodepletion persistieren kann. Prolongierte Zytopenien prädisponieren die Patienten für schwere infektionsassoziierte Komplikationen aufgrund eines beeinträchtigten Immunsystems“, waren die einleitenden Worte von Dr. Kai Rejeski, LMU-Klinikum der Universität München. Er entwickelte mit seiner Arbeitsgruppe einen multivariaten Score zur Vorhersage von CAR-T-Zell-mediierten Hämatotoxizitäten beim r/r B-Zell-Lymphom, der in einer Trainingskohorte (n=58 Patienten) untersucht und in einer unabhängigen Patientenkohorte (n=70) validiert wurde. Eine klinisch signifikante (schwere) Neutropenie war als Nachweis einer ANC (absolute Neutrophilenzahl) ≤500/µl im Zeitraum von 0–60 Tagen nach CAR-T-Zell-Infusion definiert. Dies trat bei 91% der Patienten ein und dauerte im Median 11 Tage an. 76% wiesen eine tiefe (ANC ≤100/µl), 68% eine protrahierte (ANC ≤500/µl für ≥7 Tage), 30% eine protrahierte, tiefe (ANC ≤100/µl für ≥7 Tage) und 75% eine prolongierte Neutropenie (ANC ≤1000/µl für ≥21 Tage) auf. Dabei wurden verschiedene klinische Phänotypen der Regeneration der Neutropenie beobachtet: die rasche bzw. intermittierende Regeneration, die sich beide durch einen biphasischen Verlauf auszeichneten, sowie die anhaltende Aplasie. (Abb. 2) Es konnten Biomarker identifiziert werden, deren Ausgangslevel in signifikantem Ausmaß mit einer verlängerten Neutropeniedauer assoziiert waren. Basierend auf diesen Erkenntnissen wurde ein Score für CAR-T-Zell-assoziierte Hämatotoxizität entwickelt, der als CAR-HEMATOTOX bezeichnet worden ist. Als Cut-off für eine schwere Neutropenie wurden ≥ vs. <14 Tage gewählt. Um Hoch- von Niedrigrisikopatienten (HR bzw. LR) zu differenzieren, wurden Schwellenwerte für die in signifikanter Assoziation mit der Neutropeniedauer stehenden Parameter ANC, Thrombozyten, Hämoglobin, CRP (C-reaktives Protein) und Ferritin definiert und entsprechend der Spiegelhöhe jeweils Punkte von 0–2 zugeordnet, wobei ein Score von 0–1 als LR und ein Score von ≥2als HR gewertet wurde. In der Trainingskohorte wurde eine Sensitivität von 0,96 und eine Spezifität von 0,67 für die Vorhersage einer schweren Neutropenie mittels des Scores nachgewiesen (AUC [„area under the curve“]: 0,82; p<0,001). In der Validierungskohorte fand sich eine starke Korrelation zwischen der Dauer einer klinisch signifikanten Neutropenie (p<0,0001) und es wurde bestätigt, dass der Score prädiktiv für das Auftreten einer schweren Neutropenie ≥14 Tage ist (AUC: 0,72; p=0,007). Als klinische Implikation dieser Erkenntnisse nannte Rajeski die Ermöglichung einer Risikostratifizierung noch vor der Lymphodepletion mit der eventuellen Konsequenz der Gabe einer Infektionsprophylaxe. Die Optimierung des Scores und eine weitere unabhängige und prospektive Validierung sind im Gange.6
Mikrobiom und Effekte auf Response und Toxizitäten
Es liegt zunehmend Evidenz vor, wonach das Mikrobiom des Darms Effekte auf die Outcomes unter CAR-T-Zell-Therapien ausübt. Peled et al. konnten nachweisen, dass die α-Diversität nach einer allogenen Stammzelltransplantation (allo-SCT) abnimmt und eine geringere Diversität mit einem kürzeren Überleben assoziiert ist.7 Stein-Thoringer et al. beobachteten die Ausbreitung von Enterokokken bei Patienten nach allo-SCT und konnten diese mit einem kürzeren Überleben und einer höheren GvHD(„graft versus host disease“)-bedingten Mortalitätsrate in Zusammenhang bringen.8 Basierend auf diesen Erkenntnissen stellten Dr. Viktoria Blumenberg, LMU-Klinikum der Universität München, und ihre Arbeitsgruppe gemeinsam mit zwei anderen deutschen Zentren die Hypothese auf, dass das Mikrobiom auch das Ansprechen auf eine CAR-T-Zell-Therapie und ihre Toxizitäten moduliert. Eine der CAR-T-Zell-Therapie vorausgehende Behandlung mit Antibiotika (AB) hat ebenfalls diese Effekte. Insgesamt sammelten die Prüfzentren 252 Stuhlproben von 53 Patienten mit DLBCL oder ALL vor und sequenziell nach der Therapie mit Axi-Cel, Tisa-Cel oder einem Anti-CD19-Konstrukt. Diese wurden einer 16s-RNA-Sequenzierung und einem metagenomischen Shotgun-Sequencing zugeführt. Zur Überprüfung der Hypothese wurde eine multivariate Analyse mit Stratifizierung nach Erhalt einer AB-Therapie durchgeführt. Dabei zeigte sich eine signifikante Assoziation zwischen Verabreichung von AB vor der CAR-T-Zell-Therapie und dem PFS und anderen Krankheitscharakteristika wie der Tumorlast. Mit Beginn der AB-Therapie wurde eine kontinuierliche Abnahme der α-Diversität festgestellt, die wiederum mit dem Ansprechen negativ korrelierte: Responder wiesen vor der Therapie eine höhere Diversität als jene mit einem niedrigen Ansprechen auf. Die Erkenntnisse bei allo-SCT-Patienten7 konnten ebenfalls bestätigt werden, da bei Patienten mit einer niedrigeren Diversität ein kürzeres OS und PFS verzeichnet wurden. Darüber hinaus wurde auch die taxonomische Zusammensetzung des intestinalen Mikrobioms untersucht und dabei Fälle identifiziert, die eine hohe Dominanz an Enterococcus faecium, in manchen Fällen sogar eine Monodominanz dieser Spezies, aufgewiesen haben. In einer Netzwerkanalyse wurde eine positive Korrelation zwischen bestimmten Spezies und vorteilhaften Effekten hinsichtlich der Response bei einer gleichzeitigen Protektion vor schwerwiegenden AE festgestellt. Es wurden aber auch Spezies identifiziert, die bei Non-Respondern und bei jenen Patienten vorkommen, die ein höheres Maß an Toxizitäten entwickeln. Zusammenfassend kann konstatiert werden, dass eine AB-Therapie zu einer Abnahme der α-Diversität führt, die Zusammensetzung des Mikrobioms beeinflusst und in weiterer Folge dadurch mit schlechten Outcomes assoziiert ist.9
Quelle:
3rd European CAR T-Cell Meeting, 4.–6. Februar 2021
Literatur:
1 Jäger U et al.: ASH-Meeting 2020; Poster #1194 2 Corradini P et al.: 3rd European CAR T-Cell Meeting 2021; Abstr. #OOO4/ID021 3 Pasquini M: 3rd European CAR T-Cell Meeting 2021; Session 9: Oral Presentation 4 Maude SL et al.: N Engl J Med 2018; 378: 439-448 5 Schuster SJ et al.: N Engl J Med 2019; 380: 45-56 6 Rejseki K et al.: 3rd European CAR T-Cell Meeting 2021, Abstr. #OOO8/ID044 7 Peled JU et al.: N Engl J Med 2020; 382: 822-34 8 Stein-Thoeringer CK et al.: Science 2019; 366: 1143-1149 9 Blumenberg V et al.: 3rd European CAR T-Cell Meeting 2021, Abstr. #OOO1/ID094
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...