Entwicklung einer E-Health-Unterstützung zur Verhaltensänderung
Autor:innen:
Dr. med. Janette Ribaut, PhD1
Dr. med. Sabine Valenta, PhD1,2
Dr. med. Lynn Leppla, PhD1,3
Prof. Dr. Ing. Alexandra Teynor4
Prof. Dr. med. Sabina De Geest, PhD1,5
1 Pflegewissenschaft, Department Public Health, Universität Basel, Schweiz
2 Abteilung Praxisentwicklung und Forschung, Medizinische Direktion, Universitätsspital Basel, Schweiz
3 Department für Hämatologie, Onkologie und Stammzelltransplantation, Klinik für Innere Medizin, Universitätsklinikum Freiburg, Deutschland
4 Fakultät für Informatik, Hochschule Augsburg, Deutschland
5 Academic Centre for Nursing and Midwifery, Department of Public Health and Primary Care, KU Leuven, Belgien
Korrespondenz.
E-Mail: janette.ribaut@unibas.ch
Medikamenten-Nonadhärenz betrifft 30–50% der Patient:innen, mit besonders hohen Risiken nach allogener Stammzelltransplantation. Innovative Versorgungsmodelle, die auch verhaltensändernde Massnahmen beinhalten, können Betroffene bei der Adhärenz unterstützen. In diesem Artikel wird beschrieben, wie genau solche verhaltensändernden Interventionen zur Förderung der Medikamentenadhärenz mithilfe des «behaviour change wheel» entwickelt werden können.
Keypoints
-
Medikamenten-Nonadhärenz betrifft etwa 50% der chronisch erkrankten Menschen und wird durch verschiedene Faktoren beeinflusst, wie etwa Kosten für die Patient:innen oder fehlende Unterstützungsangebote. Dies hat Auswirkungen auf alle Ebenen des Gesundheitssystems und führt zu verminderter Wirksamkeit, niedriger Lebensqualität, vorzeitigen Todesfällen und hohen Gesundheitskosten.
-
Die Medikamentenadhärenz kann durch integrierte Versorgungsmodelle – ggfs. unterstützt durch E-Health-Technologien – gefördert werden. Diese Modelle sollten Multi-Level-Interventionen und verhaltensändernde Massnahmen beinhalten.
-
Anhand des «behaviour change wheel», das als Leitfaden zur Entwicklung von verhaltensändernden Interventionen dient, können solche verhaltensändernden Multi-Level-Interventionen unter Berücksichtigung des Kontexts, der Evidenz und des Feedbacks von Betroffenen schrittweise entwickelt werden. Ausserdem unterstützt die Berücksichtigung von übergeordneten Regelungen die erfolgreiche, langfristige Implementierung.
Medikamentenadhärenz: ein komplexes Gesundheitsverhalten
Medikamentenadhärenz, definiert als «Prozess, bei dem [Patient:innen] ihre Medikamente wie verordnet anwenden», ist ein komplexes Gesundheitsverhalten.1 Es gibt drei Phasen der Medikamentenadhärenz:
-
Therapiebeginn: Anwendung der ersten verordneten Dosis,
-
Umsetzung: Übereinstimmung der tatsächlichen Medikamentenanwendung mit der Verordnung,
-
Therapieabbruch: Ende der Therapie. Persistenz ist die Zeitspanne zwischen der ersten und letzten Dosis.1,2
Obwohl drei Viertel der chronisch erkrankten Menschen die Therapie wie verordnet beginnen, setzen 30–50% sie nicht korrekt um. Zudem brechen über 50% die Behandlung innerhalb von zwei Jahren ab.3 In Europa führt Medikamenten-Nonadhärenz jährlich zu 200000 vorzeitigen Todesfällen,3 verminderter Wirksamkeit,4 niedriger Lebensqualität4 und vermeidbaren Gesundheitskosten von über 125 Mrd.Euro.3
Diese Medikamenten-Nonadhärenz, ob absichtlich (z.B. Beenden der Therapie wegen Nebenwirkungen) oder unabsichtlich (z.B. vergessene Dosen), wird durch Faktoren auf allen Ebenen des Gesundheitswesens beeinflusst: So sind auf Ebene des Gesundheitssystems etwa höhere Selbstkosten für die Patient:innen, in Gesundheitsinstitutionen fehlende Unterstützungsangebote oder bei Gesundheitsfachpersonen mangelnde Kommunikation mit den Patient:innen mit einer niedrigeren Medikamentenadhärenz assoziiert. Auf Patientenebene ist Nonadhärenz oft mit Nebenwirkungen, fehlendem Wissen oder geringer Selbstwirksamkeit verbunden.3
Ein E-Health-gestütztes integriertes Versorgungsmodell bei allogener Stammzelltransplantation: SMILe
Medikamentenadhärenz ist entscheidend für Patient:innen nach allogener Stammzelltransplantation (alloSZT). Um hier die Medikamentenadhärenz zu unterstützen, wurde im SMILe-Projekt ( https://smile.nursing.unibas.ch/ ) ein entsprechendes Modul als Teil eines E-Health-gestützten, integrierten Versorgungsmodells für ein deutsches Setting entwickelt,5,6 an ein schweizerisches Setting angepasst,7,8 implementiert und evaluiert.6,9 Neben Medikamentenadhärenz wurden für Symptomüberwachung, Infektionsprävention und körperliche Aktivität weitere Module entwickelt.
Das Versorgungsmodell besteht aus einer technischen Komponente – der SMILeApp zur Erfassung von Symptomen, Vitalzeichen und Medikamentenadhärenz mit webbasiertem Monitoringtool für Gesundheitsfachpersonen – sowie einem menschlichen Part, «Advanced Practice Nurses» (APN), die über ein Jahr Interventionsmodule anbieten, die Werte der SMILe-App überwachen und bei Bedarf intervenieren.6,8 Nachfolgend wird die Entwicklung des Moduls Medikamentenadhärenz beschrieben.5
Entwicklung von verhaltensändernden Interventionen
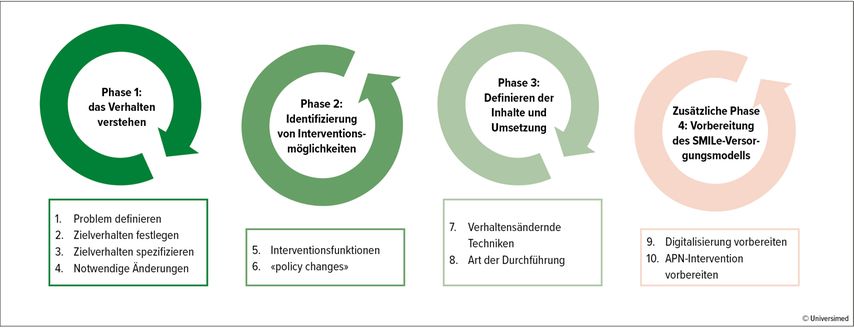
Die Entwicklung des Medikamentenadhärenz-Moduls basierte auf dem «behaviour change wheel» (BCW).10 Das BCW ist ein nützlicher Leitfaden zur Entwicklung von verhaltensändernden Interventionen. Es besteht aus drei Phasen und acht Schritten (Abb. 1). Die Schritte wurden mit Daten aus zwei Kontextanalysen,8,11 wissenschaftlicher Evidenz sowie regelmässigem Feedback von Patient:innen und Angehörigen bearbeitet. Am Ende des BCW fügten wir eine vierte Phase mit zwei weiteren Schritten hinzu, um die Digitalisierung und APN-Visiten zu unterstützen.
Abb. 1: Das Medikamentenadhärenz-Modul wurde entwickelt auf Basis des «behaviour change wheel» (modifiziert nach Michie S et al.10)
Phase 1: das Verhalten verstehen
Schritt 1: Problem definieren
Das Medikamentenregime nach alloSZT, insbesondere die Einnahme der Immunsuppressiva, ist sehr komplex. Diese Medikamente müssen zuverlässig und pünktlich eingenommen werden, um einer «graft-versus-host disease» (GvHD) vorzubeugen oder diese zu behandeln.12 Daher haben wir uns auf Immunsuppressiva fokussiert.
Der Therapiebeginn erfolgt i.d.R. stationär und ist deshalb kein Problem. Allerding haben viele Betroffene Probleme bei der Umsetzung im Alltag: Laut einer Befragung haben in den letzten vier Wochen vor Befragung 33–67% der Patient:innen eine Dosis ausgelassen, 61% die Dosis zur falschen Zeit eingenommen und 4% die Dosis verändert. Therapieabbrüche sind seltener,sie wurden bei 3% der Teilnehmenden festgestellt.13
Schritt 2: Zielverhalten festlegen
Wie beschrieben ist Medikamentenadhärenz ein komplexes Verhalten und besteht aus vielen Komponenten, wie etwa der korrekten Einnahme und dem korrekten Timing, dem Befolgen von Nahrungsmittelempfehlungen oder der korrekten Dosierung. Da die ersten zwei – die korrekte Einnahme und das Timing – bei Immunsuppressiva besonders wichtig sind, haben wir diese beiden als Zielverhalten festgelegt.
Schritt 3: Zielverhalten spezifizieren
Beide Zielverhalten wurden genauer im Hinblick auf mehrere Komponenten beschrieben:
-
WER sie durchführt (Erwachsene, alloSZT-Patient:innen)
-
WAS die Zielverhalten genau beinhalten (Einnahme von Immunsuppressiva 1–2x/Tag wie verordnet)
-
WANN sie durchgeführt werden (i.d.R. 9:00&21:00 Uhr mit einer Abweichung von max. 2 Stunden)
-
WO sie umgesetzt werden (wo die Patient:innen sind, z.B. zu Hause, im Spital, bei der Arbeit)
-
... und WIE sie ausgeführt werden (Tabletten schlucken mit Flüssigkeit)
Schritt 4: notwendige Änderungen
Die notwendigen Veränderungen zur Unterstützung der Medikamentenadhärenz wurden anhand des Capability-Opportunity-Motivation-Behaviour(COM-B)-Modells identifiziert. Dieses Modell beschreibt, dass ein Verhalten (Behaviour) durch die Fähigkeit (Capability), Gelegenheit (Opportunity) und Motivation beeinflusst wird. Bei Capability beeinflusst z.B. Vergesslichkeit die Medikamentenadhärenz negativ, bei Opportunity sind dies Unterbrechungen in der Routine oder fehlender sozialer Support und bei Motivation Nebenwirkungen oder Distress.11,14
Phase 2: Identifizierung von Interventionsmöglichkeiten
Schritt 5: Interventionsfunktionen
Von den neun Interventionsfunktionen (Mittel/Instrumente zur Verhaltensänderung) des BCW wurden jene ausgewählt, die erkannte Barrieren gemäss dem COM-B-Modell positiv beeinflussen. Dazu gehören Edukation (Wissensvermittlung), Überzeugung (Förderung positiver Gefühle und Selbstwirksamkeit), Training (Richten der Medikamente üben), Modelling (Peer-Lernen) und Befähigung (Umgang mit Barrieren ermöglichen).
Schritt 6: «policy changes»
Wir haben aus sieben sogenannten «policy categories» (Massnahmenänderungen) Strategien zur Umsetzung der gewählten Interventionsfunktionen ausgewählt. Regulierung (lokale Richtlinien/Leitlinien) und Dienstleistungserbringung (Etablierung eines integrierten Versorgungsmodells) waren in unserer Situation am sinnvollsten und machbarsten.
Phase 3: Definieren der Inhalte und Umsetzung
Schritt 7: verhaltensändernde Techniken
Verhaltensändernde Techniken beschreiben die aktiven Komponenten von verhaltensändernden Interventionen. Sie können alleine oder in Kombination mit anderen Techniken eingesetzt werden. Für unsere Intervention haben wir 24 Techniken ausgewählt, z.B. soziale Unterstützung, Gewohnheitsentwicklung, Umgebung verändern, Aktionsplanung oder Problemlösestrategien erarbeiten.
Schritt 8: Art der Durchführung
In diesem Schritt wurde die optimale Form der Durchführung für die verhaltensändernden Techniken ermittelt. Es wurde festgelegt, dass die Intervention in persönlichen Visiten mit den APN (z.B. Aktionsplanung) und teilweise über die SMILe-App (z.B. Selbstüberwachung der Einnahme) vermittelt werden soll.
Zusätzliche Phase 4: Vorbereitung des SMILe-Versorgungsmodells
Schritt 9: Digitalisierung vorbereiten
Um die Funktionalitäten in der SMILeApp zu entwickeln, wurden sogenannte «user stories» formuliert: Dies sind kurze Beschreibungen von Funktionen aus der Perspektive der Endnutzer:innen (Patient:innen, APN) und dienen dazu, Anforderungen auf eine verständliche Weise dem Softwareentwicklerteam zu kommunizieren. Dadurch konnte z.B. eine Selbstüberwachungskomponente für die SMILeApp entwickelt werden.
Schritt 10: APN-Intervention vorbereiten
Für die persönlichen APN-Visiten wurde ein umfassendes Interventionsprotokoll erstellt. Dieses Protokoll beschreibt für jede Visite, was (welche verhaltensändernden Techniken, z.B. Information & Instruktion, soziale Unterstützung, Aktionsplanung), wann (bei welcher Visite, in welcher Reihenfolge) durchgeführt werden sollte.
Implementierung und Evaluierung
Das SMILe-Versorgungsmodell wurde mit allen Modulen an den Universitätskliniken Freiburg und Basel im Rahmen einer hybriden, randomisiert-kontrollierten Studie implementiert und evaluiert. Um die Implementierung zu unterstützen, wurden spezifische Strategien angewandt, wie etwa ein lokales Bedürfnisassessment, regelmässiger Austausch mit Stakeholdern, Bildung neuer klinischer Teams, Entwicklung/Anpassung von Edukationsmaterial und technische Unterstützung.
Die Evaluation umfasste neben der Effektivität (z.B. Medikamentenadhärenz, Rehospitalisationsrate, Gesundheitskosten) auch die Implementierung (z.B. Umsetzbarkeit, Akzeptanz). Die Resultate werden derzeit analysiert und demnächst in einer wissenschaftlichen Zeitschrift veröffentlicht.
Literatur:
1 Haag M et al.: The ABC taxonomy for medication adherence translated into French and German. Br J Clin Pharm 2020; 86(4): 734-44 2 Vrijens B et al.: A new taxonomy for describing and defining adherence to medications. Br J Clin Pharm 2012; 73(5): 691-705 3 Khan R, Socha-Dietrich K: Investing in medication adherence improves health outcomes and health system efficiency: adherence to medicines for diabetes, hypertension, and hyperlipidaemia. OECD Health Working Papers 2018 4 Sabaté E: Adherence to long-term therapies: evidence for action: World Health Organization 2003 5 Ribaut J et al.: Theory-driven development of an eHealth powered intervention to support medication adherence in allogeneic stem cell transplantation as part of the SMILe implementation science project. BMC Health Serv Res 2020; 20(1): 827 6 Leppla L et al.: Development of an integrated model of care for allogeneic stem cell transplantation facilitated by eHealth—the SMILe study. Supportive Care in Cancer 2021; 29: 8045-57 7 Ribaut J et al.: Exploring stem cell transplanted patients’ perspectives on medication self-management and electronic monitoring devices measuring medication adherence: a qualitative sub-study of the Swiss SMILe implementation science project. Patient Prefer Adherence 2022; 16: 11-22 8 Valenta S et al.: Context-specific adaptation of an eHealth-facilitated, integrated care model and tailoring its implementation strategies—a mixed-methods study as a part of the SMILe implementation science project. Front Health Serv 2023; 2: 977564 9 De Geest S et al.: The SMILe integrated care model in allogeneic SteM cell TransplantatIon faciLitated by eHealth: a protocol for a hybrid effectiveness-implementation randomised controlled trial. BMC Health Serv Res 2022; 22(1): 1067 10 Michie S et al.: The behaviour change wheel: a new method for characterising and designing behaviour change interventions. Implement Sci 2011; 6(1): 42 11 Leppla L et al.: Clinicians and patients perspectives on follow-up care and eHealth support after allogeneic hematopoietic stem cell transplantation: a mixed-methods contextual analysis as part of the SMILe study. Eur J Oncol Nurs 2020; 45: 101723 12 Tomblyn M et al.: Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective. Biol Blood Marrow Transplant 2009; 44(8): 453-5 13 Kirsch M et al.: Differences in health behaviour between recipients of allogeneic haematopoietic SCT and the general population: a matched control study. Biol Blood Marrow Transplant 2014; 49(9): 1223-30 14 Rebafka A: Medication adherence after renal transplantation—a review of the literature. J Ren Care 2016; 42(4): 239-56 15 Leppla L et al.: Implementation science meets software development to create eHealth components for an integrated care model for allogeneic stem cell transplantation facilitated by eHealth: the SMILe study as an example. J Nurs Scholarsh 2021; 53(1): 35-45
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...