EADO 2024: Optimierte Diagnostik und neue therapeutische Kombinationen
Bericht:
Dr. Judith Moser
Wissenschaftliche und klinische Updates in einem breiten Spektrum an Hauttumoren standen im Fokus der 20. Jahrestagung der European Association of Dermato-Oncology, die Anfang April in Paris stattfand. Während künstliche Intelligenz einen Stellenwert in der Diagnostik erobert, werden im therapeutischen Bereich unter anderem Strategien bei Resistenzen gegen Immuncheckpoint-Inhibitoren gesucht.
Malignes Melanom
Detektion in der Primärversorgung mittels KI-App
Die Auswertung dermatoskopischer Bilder mit Unterstützung durch künstliche Intelligenz (KI) im Rahmen der Melanomdiagnostik gewinnt zunehmend an Bedeutung. Am EADO 2024 präsentierten Papachristou et al. zwei prospektive multizentrische Studien zur Performance eines KI-basierten dermatoskopischen Tools in Form einer Smartphone-App in der Primärversorgung.1 In der Machbarkeitsstudie wurde die KI-App als einfach anzuwenden und leicht verständlich bewertet. Dem folgte eine klinische Studie an 36 Primärversorgungszentren, in deren Rahmen Hausärzt:innen die KI-App unter Real-Life-Bedingungen bei der Evaluierung von Hautläsionen einsetzten. Verdächtige Läsionen wurden basierend auf einer Empfehlung der KI-App den üblichen Standards entsprechend abgeklärt.
Die Analyse bezog sich auf 253 von den Hausärzt:innen festgestellte melanomverdächtige Läsionen bei 228 Patient:innen. 21 der 253 Veränderungen wurden von der KI-App als Melanome identifiziert. Wie ein Vergleich mit der endgültigen Diagnose laut Histologie zeigte, betrug die „area under the curve“ (AUC) für die Fähigkeit der KI-App, Melanome von anderen Läsionen zu unterscheiden, 0,960. Im Hinblick auf die Identifikation invasiver Melanome (n=11) lag die AUC sogar bei 0,988. Sensitivität und Spezifität beliefen sich hier auf 100% bzw. 92,6%. Der negative prädiktive Wert (NPV) von 99,5% wies auf eine geringere Wahrscheinlichkeit für das Übersehen eines Melanoms hin als der NPV von 95,5%, der für die Einschätzung durch die Hausärzt:innen ermittelt wurde.
Zusammenfassend hoben die Autor:innen das Potenzial der KI-App in Bezug auf die Reduktion unnötiger Resektionen benigner Läsionen und die damit einhergehende Entlastung der Dermatolog:innen hervor. Ein wichtiger Aspekt ergibt sich auch aus dem Ausgleich der Unterschiede in den diagnostischen Fertigkeiten der Allgemeinmediziner:innen. Zwei Studien werden die Genauigkeit und Sicherheit der KI-App in einer größeren Population prüfen.
KI-gestützte Diagnostik mittels 3D-TBP und SDDI
Serra-García et al. beschrieben ihre Erfahrungen zur frühen Melanomdetektion bei Hochrisikopatient:innen mittels dreidimensionaler Gesamtkörper-Fotografie (3D-TBP) und digitaler sequenzieller Dermatoskopie (SDDI), wobei die Analyse durch KI-Algorithmen unterstützt wurde.2 Im Rahmen der 3D-TBP entsteht anhand der Bilder von 92 Kameras ein dreidimensionaler Avatar, der die gesamte Körperoberfläche repräsentiert.
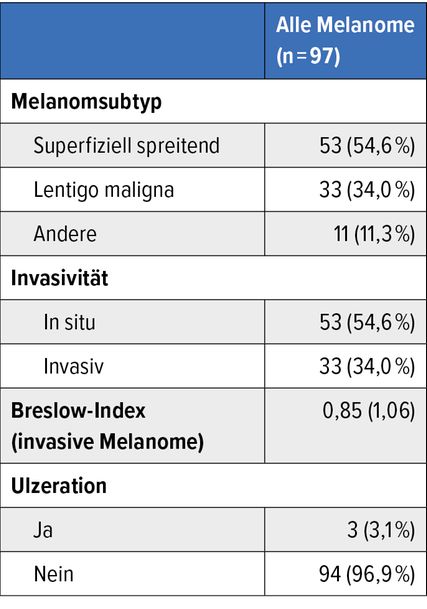
Die retrospektive Auswertung der Daten von 1274 Patient:innen zeigte, dass durch 3D-TBP und SDDI die Identifikation von Melanomen im Frühstadium optimiert und die Rate an benignen Exzisionen gesenkt werden kann. KI verbesserte zusätzlich die Erfassung von Anzahl und Veränderungen der Läsionen im Laufe der Zeit sowie die Einschätzung der Malignität. Insgesamt erfolgten 452 Resektionen. Der Anteil an Melanomen bei allen Eingriffen betrug 21,5% (n=97); In-situ-Melanome wurden in 66% diagnostiziert und invasive Tumoren in 34% (Tab.1). Die „number needed to biopsy“ erwies sich als äußerst günstig: Um ein Melanom zu identifizieren, mussten nur 2,76 melanozytische Läsionen exzidiert werden. Der DEXI(Dermoscopy Explainable Intelligence)-Score war bei Melanomen signifikant höher als bei Nävi (4,85 vs. 2,64; p<0,001). Diese Ergebnisse müssen erst noch in prospektiven Studien validiert werden, wie die Autor:innen einschränkend festhalten.
Real-World-Daten zu adjuvantem Nivolumab
Basierend auf der CheckMate-238-Studie wurde Nivolumab als adjuvante Therapie über bis zu zwölf Monate nach der vollständigen Resektion eines Melanoms im Stadium III/IV zugelassen.3 Eine deskriptive gepoolte Real-World-Analyse untersuchte die Outcomes unter dieser Behandlung anhand der Daten aus vier nichtinterventionellen Studien, die in Frankreich, Deutschland, Belgien/Luxemburg und Australien durchgeführt worden waren.4 Besonderes Augenmerk lag auf der Gruppe mit Frührezidiv (d.h. Rezidiv unter Therapie bzw. ≤6 Monaten nach deren Beendigung). Als primärer Endpunkt galt das rezidivfreie Überleben (RFS) nach fünf Jahren.
In der Gesamtgruppe (n=982) betrug das mediane RFS 45,7 Monate. Ein Frührezidiv manifestierte sich bei 24% (n=236), wobei initial meist Fernmetastasen vorlagen (52%), die primär Lymphknoten, Lunge und Leber betrafen. Wie die Betrachtung der Baseline-Charakteristika zeigt, wies die früh relapsierende Gruppe häufiger ungünstige prognostische Faktoren auf (akrale und ulzerierte Melanome, Resektion im Stadium IIIC) als das Gesamtkollektiv. Therapiebezogene Grad-3/4-Nebenwirkungen manifestierten sich mit vergleichbarer Häufigkeit (13% und 14% in der Gesamtkohorte bzw. bei Frührezidiv). Insgesamt stehen die Ergebnisse in Übereinstimmung mit den Daten der CheckMate-238-Studie zur Wirksamkeit und Sicherheit von adjuvantem Nivolumab.
Bei 80% der Personen mit früher Fernmetastasierung gelangte eine Folgetherapie zum Einsatz, die mit einem medianen progressionsfreien Überleben (PFS) von 5,2 Monaten einherging. Nach zwölf Monaten lebten 36% der Patient:innen. Den Autor:innen zufolge besteht in der Gruppe mit Frührezidiv nach wie vor ein Bedarf an weiteren Behandlungsoptionen.
Pembrolizumab/Lenvatinib nach dualer Immuntherapie
Beim metastasierten oder nichtresektablen Melanom wird häufig eine primäre oder sekundäre Resistenz gegenüber der Erstlinientherapie mit Nivolumab und Ipilimumab beobachtet. Die Kombination aus Pembrolizumab und dem Multikinase-Inhibitor Lenvatinib hat in der einarmigen Phase-II-Studie LEAP-004 bei Melanompatient:innen nach Progression unter PD-(L)1-Inhibitortherapie alleine oder in Kombination mit einer CTLA-4-Hemmung ein klinisch relevantes und anhaltendes Ansprechen gezeigt.5
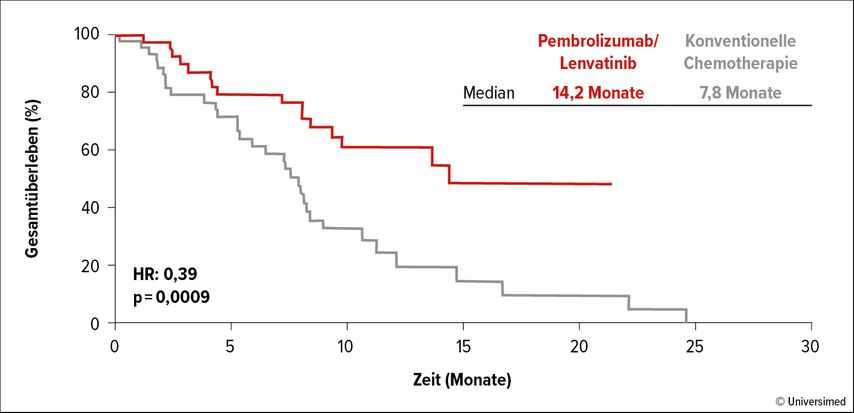
Lyrarakis et al. analysierten daher retrospektiv die Daten von Patient:innen mit fortgeschrittenem Melanom, die eine Progression unter Nivolumab/Ipilimumab erlitten hatten.6 Die mit Pembrolizumab/Lenvatinib behandelte Gruppe (n=39) erfuhr im Vergleich zum Kollektiv, das eine Standard-Chemotherapie erhielt (n=45), signifikante Vorteile im Hinblick auf das mediane PFS (4,8 vs. 3,8 Monate; HR: 0,58; p=0,017), das mediane Gesamtüberleben (OS; 14,2 vs. 7,8 Monate; HR: 0,39; p=0,0009; Abb. 1) sowie die Gesamtansprechrate (ORR; 23,1% vs. 11,1%; p<0,0001). Therapiebezogene Nebenwirkungen der Grade ≥3 traten unter Pembrolizumab/Lenvatinib seltener auf als unter Chemotherapie (48,7% vs. 75,6%; p=0,034) und führten auch weniger häufig zum Therapieabbruch (10,3% vs. 17,8%). Das Sicherheitsprofil war mit dem bekannten Profil konsistent. Insgesamt deuten diese Ergebnisse auf eine mögliche Rolle von Lenvatinib/Pembrolizumab in der schwierig zu behandelnden Subpopulation der Melanompatient:innen mit Resistenzen gegen eine PD-1-/CTLA-4-Inhibitortherapie hin.
Abb. 1: Pembrolizumab/Lenvatinib vs. Chemotherapie nach PD-1-/CTLA-4-gezielter Therapie: Gesamtüberleben (modifiziert nach Lyrarakis G et al.)6
BRAF-positives Melanom: prognostischer Faktor ctDNA
Eine prospektive Studie evaluierte den Stellenwert der zirkulierenden Tumor-DNA (ctDNA) als Biomarker im adjuvanten Setting des BRAF-positiven Melanoms im Stadium III.7 Die Quantifizierung erfolgte mittels digitaler Droplet-PCR, wobei die BRAF-Mutationen V600E/K/R erfasst wurden. Von 32 Patient:innen erhielten 29 Dabrafenib/Trametinib und drei Nivolumab. Vor Therapiebeginn fand sich detektierbare ctDNA bei 34,4% der Patient:innen; diese zeigten gegenüber jenen ohne ctDNA-Nachweis keine Unterschiede in Bezug auf klinische und pathologische Merkmale. Auch korrelierten die ctDNA-Werte zu Baseline nicht mit dem Tumorstadium und den LDH-Werten.
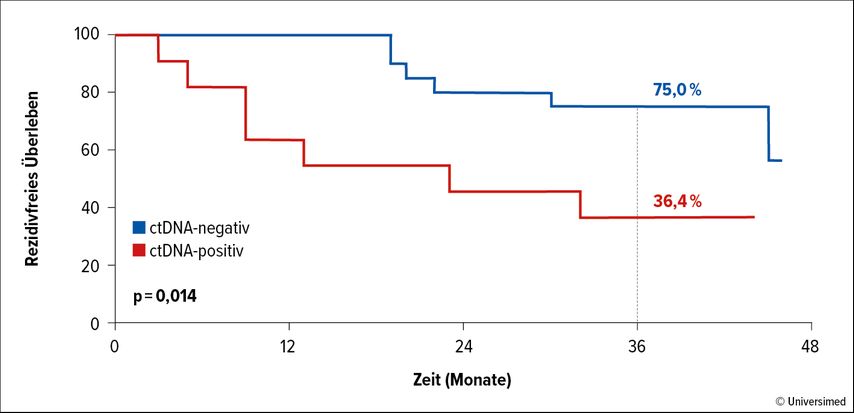
Der ctDNA-Status vor dem Start der adjuvanten Therapie erwies sich als unabhängiger prognostischer Faktor. Innerhalb des medianen Follow-ups von 38 Monaten entwickelten 63,6% der Patient:innen mit initial positiver ctDNA ein Rezidiv, jedoch nur 23,8% jener ohne ctDNA-Nachweis. Die RFS-Raten nach 36 Monaten beliefen sich auf 75% vs. 36,4% (p=0,014; Abb. 2). Ebenso verstarb ein weitaus größerer Prozentsatz der ctDNA-positiven Patient:innen; nach 36 Monaten lebten 95% vs. 54,6% (p=0,004). Alle Personen, die während der adjuvanten Therapie rezidivierten bzw. verstarben, waren anfänglich ctDNA-positiv gewesen. Die univariate Cox-Regressionsanalyse erbrachte eine signifikante Assoziation des ctDNA-Status vor Behandlungsbeginn mit RFS und OS. Wie die Betrachtung der ctDNA-Dynamik vor Augen führt, geht das serologische Rezidiv dem radiologischen Rezidiv um 1–3 Monate voraus. Den Autor:innen zufolge könnten Hochrisikopatient:innen mit positiver Baseline-ctDNA von häufigeren bildgebenden Kontrollen profitieren, und der ctDNA-Status könnte speziell bei niedriger Tumorlast (z.B. Stadium IIIA) in die adjuvante Therapieentscheidung einfließen.
Abb. 2: Rezidivfreies Überleben in Abhängigkeit vom ctDNA-Status vor Beginn der adjuvanten Therapie (modifiziert nach Roccuzzo G et al.)7
Fianlimab/Cemiplimab beimPlattenepithelkarzinom
Der PD-1-Inhibitor Cemiplimab wird bereits als Monotherapie beim metastasierten oder lokal fortgeschrittenen kutanen Plattenepithelkarzinom (cSCC) verwendet. Eine Phase-I-Studie testete die Kombination aus Cemiplimab und dem LAG-3-Antikörper Fianlimab bei 15 Patient:innen mit fortgeschrittenem oder metastasiertem cSCC, die zuvor eine PD-(L)1-gezielte Therapie erhalten hatten.8 Die Kombination wurde dreiwöchentlich über bis zu 24 Monate verabreicht. Im Median waren vor dem Studieneinschluss zwei Behandlungslinien zum Einsatz gekommen. Als primärer Endpunkt galt die ORR.
Das Schema aus Cemiplimab plus Fianlimab legte eine akzeptable Verträglichkeit bei ermutigender klinischer Aktivität an den Tag. Zu immunassoziierten Phänomenen kam es bei 27%, infusionsbezogene Reaktionen wurden bei 13% verzeichnet. Ein Patient (7%) entwickelte eine therapiebezogene Toxizität Grad ≥3. In der Gesamtkohorte resultierte eine ORR von 20%; Komplettremissionen (CRs) traten in zwei Fällen ein (13%), eine partielle Response in einem Fall (7%). Bei zwei Patient:innen mit PD-1-Resistenz wurden lang anhaltende Remissionen dokumentiert. Das mediane PFS lag in der Gesamtgruppe bei drei Monaten. Nach Einschätzung der Autor:innen ist eine weitere Evaluierung des Schemas aus Fianlimab und Cemiplimab gerechtfertigt. Eine Phase-II-Studie wird die Kombination im perioperativen Setting beim resektablen cSCC im Stadium III/IV mit Cemiplimab alleine vergleichen.
Periokuläres Basaliom: Vismodegib plus Mohs-Chirurgie
Lokal fortgeschrittene periokuläre Basaliome sind der häufigste Grund für eine Enukleation des Auges. Eine argentinische Real-World-Studie prüfte die Sequenz aus der neoadjuvanten Therapie mit dem Hedgehog-Pathway-Inhibitor Vismodegib und der Mohs-Chirurgie, die eine vollständige histopathologische Kontrolle des Tumorschnittrands während der Operation beinhaltet. Vismodegib wurde bis zum maximalen klinischen Ansprechen verabreicht. Okuloplastische Verfahren ermöglichten nach der Tumorschrumpfung eine Verbesserung der funktionellen und kosmetischen Ergebnisse.
Elf von 16 Patient:innen (69%) mit periokulärem Basaliom erzielten klinische CRs.9 Eine Person erlitt ein Rezidiv (9%), war jedoch dank eines zweiten Mohs-Eingriffs nach 29 Monaten tumorfrei. Dagegen lässt sich in der Gruppe ohne CR kein eindeutiger Benefit erwarten, wie die Autor:innen hervorhoben. Sie empfehlen ein frühzeitiges Absetzen der Therapie bei fehlendem Ansprechen. Nebenwirkungen von Vismodegib traten häufig auf (Dysgeusie, Muskelkrämpfe), waren aber beherrschbar. Insgesamt konnte bei fünf von sechs Patient:innen mit bestehender Indikation zur Enukleation das Auge erhalten werden.
Quelle:
20th European Association of Dermato-Oncology Congress, 4.–6. April 2024, Paris
Literatur:
1 Papachristou P et al.: EADO 2024, Abst. #A-297 2 Serra-García L et al.: EADO 2024; Abstr. #A-295 3 Weber J et al.: Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. N Engl J Med 2017; 377(19): 1824-35 4 Mortier L et al.: EADO 2024; Abstr. #A-283 5 Arance AM et al.: J Clin Oncol 2021; 39(suppl 15): Abstr #9504 6 Lyrarakis G et al.: EADO 2024; Abstr. #A-203 7 Roccuzzo G et al.: EADO 2024, Abstr. #A-167 8 Kaczmar J et al.: EADO 2024, Abstr. #A-305 9 González A et al.: EADO 2024; Abstr. #A-421
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...