Die Sequenztherapie bei fortgeschrittenem Prostatakarzinom
Autor:
OA Dr. Ercan Müldür
Facharzt für Innere Medizin,
Onkologie und Hämatologie
Zentrum für Onkologie, Hämatologie und Palliativmedizin
Klinikum Ottakring, Wien
Die Behandlung des fortgeschrittenen Prostatakarzinoms hat durch die Zulassung von neuen Therapien für verschiedene Settings wie für das metastasierte kastrationsresistente Prostatakarzinom (mCRPC), das metastasierte hormonnaive Prostatakarzinom (mHNPC) und das nicht metastasierte kastrationsresistente Prostatakarzinom (M0 CRPC) in den letzten Jahren große Fortschritte erfahren.
Neben schon länger etablierten Substanzen wie Docetaxel, Cabazitaxel, Abirateron, Enzalutamid und Radium-223 haben auch Substanzen wie Apalutamid, Darolutamid und Olaparib in den klinischen Alltag Einzug gefunden. Die Herausforderung für den Kliniker bleibt nach wie vor, diese Substanzen in bestmöglicher Sequenz einzusetzen, um das beste Ergebnis für die Patienten zu erzielen.
Überblick über zugelassene Behandlungsoptionen
Nach dem erfolgreichen Einzug von Docetaxel in die Klinik beim metastasierten kastrationsresistenten Prostatakarzinom (mCRPC) im Jahr 2004 (TAX-327)1 hat es über sechs Jahre gedauert, bis mit Cabazitaxel (TROPIC-Trial)2 eine weitere hochwirksame Substanz zur Behandlung des fortgeschrittenen Prostatakarzinoms zur Verfügung stand. Während Cabazitaxel derzeit nur beim mCRPC zugelassen ist, hat Docetaxel seit 2015 nach zwei positiven Phase-III-Studien (CHAARTED und STAMPEDE) auch eine Zulassung bei Patienten mit mHNPC.3,4
Basierend auf der Erkenntnis, dass der intratumoröse Androgenspiegel während der Progression des CRPC durch De-novo- Steroidsynthese ansteigt und Androgenrezeptoren reaktiviert werden,5 konnten sogenannte „androgen receptor targeted agents“ der zweiten Generation (ARTA) entwickelt und in der Behandlung des Prostatakarzinoms etabliert werden:
-
Abirateronacetat, ein Androgensynthese-Inhibitor, ist sowohl beim mCRPC, nach positiven Überlebensdaten in zwei Phase-III-Studien, vor und nach Docetaxel (COU-AA-301, COU-AA-302)6,7 als auch beim mHNPC, ebenfalls nach signifikant verlängerter Überlebenszeit in zwei Phase-III-Studien (LATITUDE und STAMPEDE),8,9 zugelassen.
-
Enzalutamid, ein Androgenrezeptor-Inhibitor, ist nach zwei positiven Phase-III-Studien in Bezug auf das Überleben vor und nach Docetaxel, (AFFIRM, PREVAIL) ebenfalls beim mCRPC zugelassen.10,11
-
Enzalutamid ist außerdem nach zwei positiven Phase-III-Studien (ENZAMET und ARCHES) bei Patienten mit mHNPC sowie nach einer positiven Phase-III-Studie (PROSPER) bei Patienten mit M0 CRPC zugelassen.12–14
-
Apalutamid, ebenfalls ein Androgenrezeptor-Inhibitor, ist nach einer positiven Phase-III-Studie (SPARTAN) beim M0 CRPC sowie nach der positiven Phase-III-Studie TITAN bei Patienten mit mHNPC zugelassen.15,16
Darolutamid, ein weiterer Androgenrezeptor-Inhibitor ist gemäß der positiven Phase-III-Studie ARAMIS bei Patienten mit M0 CRPC zugelassen.17
Zudem konnte bei der Behandlung des mCRPC mit isolierten Knochenmetastasen erstmals mit einer Radionuklidtherapie, Radium-223, in einer Phase-III-Studie (ALSYMPCA) das Gesamtüberleben signifikant verlängert werden.18
Mit Olaparib, einem Poly-Adenosindiphosphat-Ribose-Polymerase(PARP)-Inhibitor, haben wir seit 2020 bei Patienten mit mCRPC und einem Defekt in homologen rekombinanten Reparaturgenen (BRCA1, BRCA2, ATM) eine hochwirksame, zielgerichtete Therapie. In der Zulassungsstudie PROfound, einer randomisierten Phase-III-Studie, wurden nach Detektion von Defekten in DNA-Reparaturgenen mittels Next-Generation-Sequencing (NGS) Patienten mit mCRPC nach Progression unter ARTA (Enzalutamid oder Abirateron) eingeschlossen. Die Studie bestand aus den Kohorten A und B.
In die Kohorte A wurden Patienten mit Mutation in den Genen BRCA1, BRCA2 oder ARM eingeschlossen. Die Patienten der Kohorte B wiesen Veränderungen in mindestens einem von 15 anderen Genen auf, die für die homologe rekombinante Reparatur von Bedeutung sind.
Die Randomisierung erfolgte im Verhältnis 2:1. Die Patienten erhielten Olaparib (2-mal 300mg/Tag) oder den ARTA, den sie noch nicht erhalten hatten (Enzalutamid oder Abirateron). Bei Progress in der Bildgebung war ein Cross-over vom Kontrollarm in den Olaparib-Arm erlaubt.
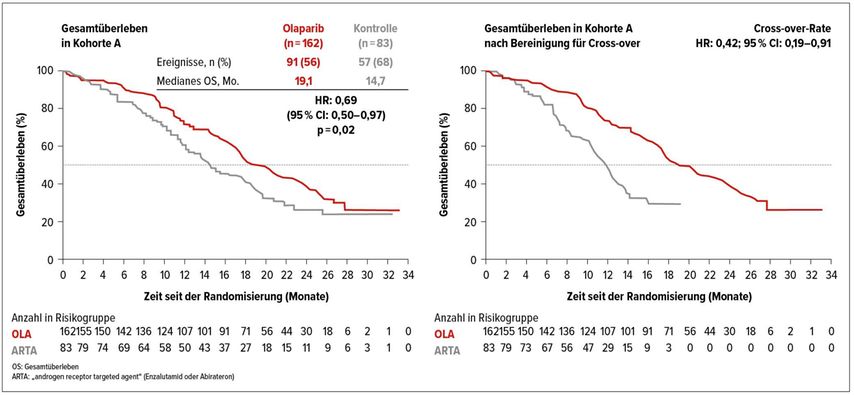
Nachdem sich bereits in der primären Auswertung eine signifikante Verlängerung des progressionsfreien Überlebens unter Olaparib zeigte, fand sich auch in der finalen Auswertung zum Gesamtüberleben – einem wichtigen sekundären Endpunkt der Studie – nach einer medianen Beobachtungsdauer von 21 Monaten über beide Kohorten hinweg, eine – in der Kohorte A auch signifikante – Verlängerung des Gesamtüberlebens. Das mediane Gesamtüberleben in Kohorte A war mit 19,1 Monaten signifikant länger als im Kontrollarm mit 14,7 Monaten (HR: 0,69; p=0,0175). Dies war der Fall, obwohl zwei Drittel der Patienten der Kontrollgruppe (67%) wegen eines Progresses zur Olaparib-Therapie wechselten (Abb. 1).
In Kohorte B war das mediane Gesamtüberleben unter Olaparib zwar mit 14,1 Monaten länger als im Kontrollarm mit 11,5 Monaten, allerdings war der Vorteil mit einer Hazard-Ratio von 0,96 nicht signifikant.19
Abb. 1: Finale Auswertung zum Gesamtüberleben von Kohorte A in der PROfound-Studie (nach de Bono et al.)19
Medikamentöse Sequenztherapie bei fortgeschrittenem PC
Bei der Behandlung des fortgeschrittenen Prostatakarzinoms liegen mittlerweile harte Daten vor, wonach mit jeder einzelnen Therapielinie eine verlängerte Lebenszeit für den Patienten erwirkt werden kann. Das heißt im Klartext: Wenn es der Zustand des Patienten zulässt, sollte er sowohl eine Therapie mit ARTA als auch eine Chemotherapie mit Docetaxel und Cabazitaxel im Laufe der Behandlung seines Prostatakarzinoms erhalten. Bei Patienten mit ossären Metastasen, fehlenden viszeralen Metastasen und Lymphknotenmetastasen kleiner als 3cm stellt das in dieser Indikation zugelassene Radium-223 nach wie vor eine valide Therapieoption mit Überlebensvorteil dar und sollte auch in die Therapiesequenz integriert werden.
In welcher Sequenz diese Substanzen im Praxisalltag erfolgen sollten, um möglichst lange Überlebenszeiten für die Patienten zu generieren, war bis vor Kurzem unklar bzw. Gegenstand klinischer Studien. Aus dem Review zum mCRPC von Maines 2015 und der 2018 publizierten retrospektiven europäischen FLAC-Studie war bereits bekannt, dass jene Patienten die beste Prognose aufweisen, die ihre Therapie in der Sequenz Docetaxel gefolgt von Cabazitaxel und ARTA bekommen haben.20,21
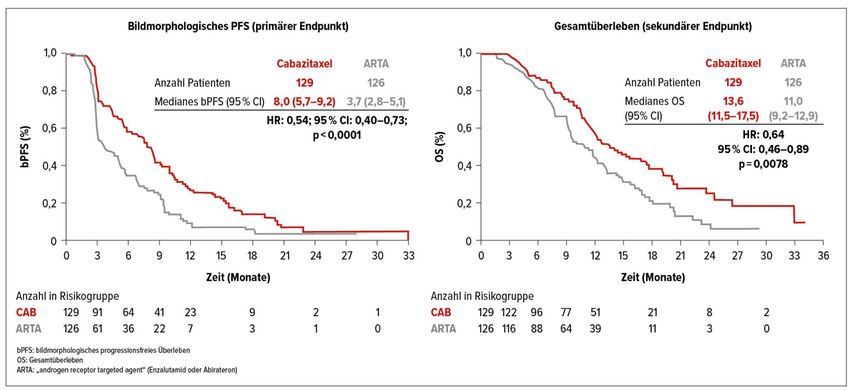
Erst die finalen Ergebnisse der 2019 im „New England Journal of Medicine“ publizierten prospektiv randomisierten Phase-IV-Studie CARD konnte in die Diskussion um die Therapiesequenz beim mCRPC mehr Klarheit bringen. Das Ziel der CARD-Studie war es, die aus den retrospektiven Daten generierte Hypothese zu überprüfen. In diese Studie wurden insgesamt 255 Patienten, die mit Docetaxel vorbehandelt worden waren, anschließend eine AR-gerichtete Therapie (Enzalutamid oder Abirateron) erhielten und darunter eine Ansprechdauer von weniger als 12 Monaten hatten, eingeschlossen. Die Patienten wurden 1:1 randomisiert zu Cabazitaxel 25mg/m2 alle drei Wochen oder Abirateron (1000mg/d) bzw. Enzalutamid (160mg/d). Als primärer Endpunkt wurde das bildmorphologische progressionsfreie Überleben (bPFS) definiert. Das Gesamtüberleben wurde als sekundärer Endpunkt gewählt. Der primäre Endpunkt mit einem signifikant längeren bPFS von 8,0 Monaten für Cabazitaxel im Vergleich zu 3,7 Monaten mit dem zweiten AR-gerichteten Medikament (Hazard-Ratio für bPFS oder Tod 0,54; p<0,001) konnte erreicht werden (Abb. 2). Der sekundäre Endpunkt, das mediane Gesamtüberleben, war mit 13,6 vs. 11 Monate ebenfalls signifikant zugunsten von Cabazitaxel verlängert (HR für Versterben 0,64; p=0,008) (Abb. 2).22
Nichtdestotrotz wird die Frage der Sequenztherapie immer komplexer, da die Substanzen Docetaxel und ARTA bereits in früheren Therapielinien, beim M0 CRPC und mHNPC, eingesetzt werden. Wir haben derzeit auch keine prädiktiven Ansprechfaktoren, um die am besten geeignete therapeutische Sequenz zu bestimmen.
Abb. 2: Bildmorphologisches progressionsfreies Überleben und Gesamtüberleben in der CARD-Studie
(nach de Wit et al.)22
Fazit
Es stehen uns heute bei der Behandlung des fortgeschrittenen Prostatakarzinoms mehrere wirksame Substanzen in verschiedenen Settings wie mCRPC, mHNPC und M0 CRPC zur Verfügung. Durch den Einzug von Docetaxel, Cabazitaxel, Abirateron, Enzalutamid, Radium-223, Apalutamid und Darolutamid in den klinischen Alltag kann heute eine deutliche Verlängerung der Lebenszeit von Patienten mit fortgeschrittenem Prostatakarzinom erreicht werden. Mit dem PARP-Inhibitor Olaparib haben wir mittlerweile eine hochwirksame zielgerichtete Therapie bei einer Subgruppe von Patienten. Die fehlende Effektivität der sequenziellen Therapie mit zwei aufeinanderfolgenden Androgenrezeptor-gerichteten Therapien beim mCRPC ist mit den Daten der CARD-Studie inzwischen belegt.
Literatur:
1 Tannock IF et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. NEngl J Med 2004; 351(15): 1502-12 2 De Bono JS et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment. Lancet 2010; 376(9747): 1147-54 3 Sweeney CJ et al.: Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373(8): 737-46 4 James ND et al.: Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387(10024): 1163-77 5 Locke JA et al.: Androgen levels increase by intratumoral de novo steroidogenesis during progression of castration-resistant prostate cancer. Cancer Res 2008; 68(15): 6407-15 6 De Bono JS et al.: Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364(21): 1995-2005 7 Ryan CJ et al.: Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368(2): 138-48 8 Fizazi K et al.: Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. Engl J Med 2017; 377(4): 352-360 9 James ND et al.: Abiraterone for prostate cancer not previously treated with hormone therapy. N Engl J Med 2017; 377(4): 338-51 10 Scher HI et al.: Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367(13): 1187-97 11 Beer TM et al.: Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371(5): 424-33. 12 Davis ID et al.: Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019; 381(2): 121-31 13 Armstrong AJ et al.: ARCHES: a randomized, phase III study of androgen deprivation therapy with enzalutamide or placebo in men with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2019; 37(32): 2974-86 14 Hussain M et al.: Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. NEngl J Med 2018; 78(26): 2465-74 15 Smith MR et al.: Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med 2018; 378(15): 1408-18 16 Chi KN et al.: Apalutamide for metastatic, castration-sensitive prostate cancer. N Eng J Med 2019; 381(1): 13-24 17 Fizazi K et al.: Darolutamide in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2019; 380(13): 1235-46 18 Parker C et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013; 369(3): 213-23 19 De Bono JS et al.: Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2020; 82(22): 2091-102 20 Maines F et al.: Sequencing new agents after docetaxel in patients with metastatic castration-resistant prostate cancer. Crit Rev Oncol Hematol 2015; 96(3): 498-506 21 Angelergues A et al.: Results of the FLAC European Database of metastatic castration-resistant prostate cancer patients treated with docetaxel, cabazitaxel, and androgen receptor-targeted agents. Clin Genitourin Cancer 2018; 16(4): e777-84 22 De Wit R et al.: CARD cabazitaxel versus abiraterone or enzalutamide in metastatic prostate cancer. N Engl J Med 2019; 381(26): 2506-18
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...