„Die Kombination war deutlich wirksamer, als wir erwartet haben“
Unser Gesprächspartner:
Prof. Dr. Gabriel Rinnerthaler
Klinische Abteilung für Onkologie
Med Uni Graz
E-Mail: gabriel.rinnerthaler@medunigraz.at
Das Interview führte
Ingeborg Morawetz, MA
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Deeskalation statt Eskalation – in einer Welt zahlreicher hochwirksamer Krebsmedikamente gehen die ABCSG und Prof. Dr. Gabriel Rinnerthaler neue Wege. Der Erstautor der Studie ABCSG52/ATHENE hat mit uns über ihre Ergebnisse gesprochen.
Die Studie ABCSG 52/ATHENE hat beeindruckende Ergebnisse gezeigt. Können Sie uns das Set-up der Studie erläutern?
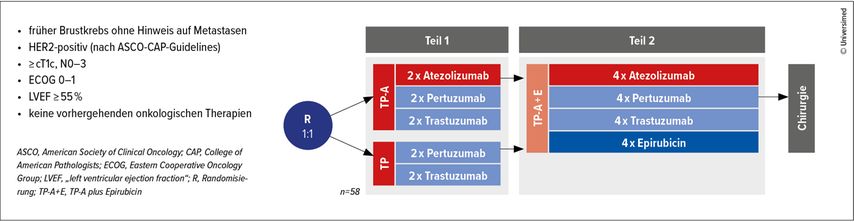
G. Rinnerthaler: Die Studie ABCSG 52/ATHENE ist eine randomisierte Phase-II-Studie mit Patient:innen mit HER2-positivem Mammakarzinom. Bei Patient:innen mit dieser aggressiven Form von Brustkrebs ist der Standard, dass sie mit zwei bis vier unterschiedlichen Chemotherapien in sechs Einzelgaben behandelt werden, in Kombination mit zwei HER2-Antikörpern. Mit dieser Therapie haben wir schon große Erfolge erreicht. Man geht davon aus, dass bei 60–70% der Patient:innen dadurch der Tumor komplett verschwindet. Diese komplette pathologische Remission, die PCR, ist auch mit einer sehr guten Prognose assoziiert.
In unserer Studie ABCSG52/ATHENE wollten wir klären, ob durch eine weniger intensive Therapie gleiche Therapieerfolge erreicht werden können. Moderne Therapien sind sehr effektiv, deswegen gibt es inzwischen einen relevanten Anteil an Patient:innen, die überbehandelt werden. Darum werden neue Konzepte der Deeskalation immer wichtiger.In unserer Studie waren die ersten beiden Therapiezyklen randomisiert auf entweder reine Antikörpertherapie gegen HER2, also Pertuzumab und Trastuzumab, oder die Kombination mit einer Immuntherapie beider mit Atezolizumab. Beim Mammakarzinom und anderen Krebsformen wissen wir bereits, dass durch Atezolizumab die Wirksamkeit der Therapie verbessert werden kann. Nach diesen zwei chemotherapiefreien Gaben wurden alle Patient:innen mit einer Chemotherapie-Monosubstanz, nämlich mit Epirubicin, in Kombination mit der Dreifach-Antikörpertherapie behandelt.
Wir haben Epirubicin deshalb gewählt, weil es sehr gute präklinische Daten dazu gibt, dass Anthrazykline die Wirksamkeit der Immuntherapie stärken können und synergistische Effekte entwickeln. Die Annahme war, dass durch die Therapie mit weniger Chemo- und mehr Immuntherapie bei 40% der Patient:innen eine komplette pathologische Remission auftreten wird. Gesehen haben wir dann aber eine pCR bei 60% der Patient:innen. Die Kombination war also deutlich wirksamer, als wir erwartet haben.
In der Subgruppe der Patient:innen mit einem PD-L1-negativen Status, die bereits initial mit Atezolizumab behandelt wurden, lag die pCR-Rate sogar bei 73%.
Wie erklären Sie sich, dass gerade die PD-L1-negative Gruppe so gut abgeschnitten hat?
G. Rinnerthaler: Diese Beobachtung war unerwartet, wir sind davon ausgegangen, dass die PD-L1-positive Subgruppe besser anspricht. Inzwischen haben wir entsprechende Recherchearbeiten durchgeführt. Es hat sich gezeigt, dass es ähnliche Beobachtungen in einer Phase-III-Studie gab, IMpassion 050, die eine Standardchemotherapie mit Anti-HER2 plus/minus Atezolizumab untersucht hat. Die Studie war insgesamt negativ, aber in der PD-L1-negativen Subgruppe war ein positiver Effekt zu sehen. Man nimmt an, dass PD-L1-Positivität grundsätzlich mit einer sehr guten Effektivität bei klassischen Anti-HER2-Chemotherapie-Kombinationen assoziiert ist. Durch die Standardtherapie wird also eine hohe Wirksamkeit erreicht. PD-L1-negative Tumoren sprechen auf die Kombination einer klassischen Chemotherapie plus Immuntherapie eigentlich schwächer an. Aber es gibt präklinische Daten dazu, dass vor allem bei diesen Tumoren die Kombination aus Immuntherapie und Anti-HER2-Therapie die Wirksamkeit stärken und dass genau in dieser Population eine Anti-Tumor-Immunität besser induziert werden kann.
Soll in Zukunft ein größerer Fokus auf die PD-L1-Negativität gelegt werden?
G. Rinnerthaler: Im Rahmen der Studie haben wir nach den zwei Anfangszyklen der chemotherapiefreien Therapie Tumorproben entnommen. Wir planen derzeit translationale Forschungsprojekte, in denen wir das Tumorgewebe weiter untersuchen möchten. Uns interessiert vor allem, wie sich der PD-L1-Status unter der Vortherapie mit Immuntherapie ändert, also die Veränderung bei Anti-HER2-Therapie plus/minus Immuntherapie.
PD-L1 wird dynamisch exprimiert. Uns interessiert, ob sich die Hinweise auf eine gestärkte Immunantwort innerhalb des Tumors in Abhängigkeit von der Therapie nach sechs Wochen ändern. Außerdem wollen wir wissen, inwiefern es Unterschiede im PD-L1-Status in Abhängigkeit von der Vortherapie mit Atezolizumab gibt.
Muss dadurch auch die Dynamik innerhalb eines Therapiezyklus überdacht werden?
G. Rinnerthaler: Es gibt immer mehr Hinweise darauf, dass wir durch dynamische Biomarker das Therapieansprechen besser abschätzen können. Bisher wurden Parameter herangezogen, die zum Zeitpunkt der Diagnose vorhanden waren. Mittlerweile weiß man aber, dass bestimmte Veränderungen prognostisch für das Therapieansprechen sind, zum Beispiel in der PET-CT oder bei der zirkulierenden Tumor-DNA. Vor allem in klinischen Studien wird es in Zukunft wichtig sein, translationale Projekte mitzudenken, um das Ansprechen besser zu verstehen und Veränderungen, Korrelationen und Assoziationen zu beobachten, die bisher nicht erklärbar sind.
Wie war das Nebenwirkungsprofil der Studie?
G. Rinnerthaler: Da die Studie unser Therapiekonzept nicht mit der Standardtherapie verglichen hat, ist es schwer möglich, zu ermitteln, wie sich die Toxizitäten in der deeskalierten Therapie im Vergleich zur Standardtherapie verhalten. Aber grundsätzlich war das Nebenwirkungsprofil moderat und vor allem durch die Chemotherapie getrieben. Insgesamt war es überschaubar: Wir hatten wenige Nebenwirkungen ≥ Grad 3. Neutropenien, Infusionsreaktionen und Alopezie haben eine gewisse Rolle gespielt. Günstig war die Lage bei der Gesamtverträglichkeit, bei Übelkeit, Erbrechen, immunvermittelten Nebenwirkungen und kardialen Toxizitäten. Wir haben auch keine Nebenwirkungen beobachtet, die noch nicht bekannt waren. Für die Zukunft hoffen wir, dass Deeskalationskonzepte die Nebenwirkungsprofile verbessern: vergleichbare Effektivität bei weniger Toxizität.
Hat die Studie Auswirkungen auf die klinische Praxis?
G. Rinnerthaler: Die Ergebnisse dieser Studie haben keinen Einfluss auf die klinische Praxis. Um den Standard zu ändern, braucht es Phase-III-Studien. Phase-II-Studien sind vor allem ein wichtiger Baustein im Erkenntnisgewinn in der Tumorbiologie und auf der Suche nach neuen Therapieansätzen. Wir versuchen, mit anderen Gruppen zusammenzuarbeiten, die ebenfalls Immuntherapie beim HER2-positiven Mammakarzinom untersucht haben, um die potenzielle Patient:innenpopulation, die für solche Therapiestrategien infrage kommt, besser identifizieren zu können.
Wäre auf lange Sicht eine Phase-III-Studie geplant?
G. Rinnerthaler: Den Wunsch und die Hoffnung gibt es auf jeden Fall. Es treten dabei aber ein paar Probleme auf.
Zunächst gibt es gerade einen starken Fokus auf die Antikörper-Wirkstoff-Konjugate, also ein Abwenden von der klassischen Chemotherapie. Auch dass noch nicht geklärt ist, ob die Zugabe der Immuntherapie nicht doch zu mehr Toxizität führen kann, ist eine Hürde. Außerdem wird vor allem bei Atezolizumab die Weiterentwicklung im Bereich der Brustkrebsbehandlung eigentlich nicht mehr verfolgt.
Aber auch wenn es aktuell nicht ganz en vogue ist, bin ich zuversichtlich, dass wir bei den HER2-positiven Mammakarzinomen in Bezug auf die Immuntherapie noch ein Revival erleben können.
Gibt es andere Immuntherapiekombinationen, auf die Sie setzen würden?
G. Rinnerthaler: Vor Kurzem gab es neue Daten einer anderen randomisierten Phase-II-Studie, in der mit einer reduzierten Chemotherapie mit Docetaxel in Kombination mit Pertuzumab/Trastuzumab plus/minus Pembrolizumab größere Effekte gezeigt werden konnten. Es scheint diesen additiven Effekt also sowohl bei Anthrazyklinen als auch bei Taxanen zu geben.
Es ist interessant, dass wir diesen Effekt vor allem dann sehen, wenn die Chemotherapie deeskaliert wird, und nicht bei der Hinzugabe zur Standardtherapie. Auch das spricht für die weitere Identifizierung dieser Deeskalationspopulationen. Der nächste Schritt Richtung Deeskalation, bei dem ich sehr viel Potenzial sehe, sind die schon erwähnten dynamischen Biomarker. In kommenden Studien können wir zum Beispiel mit einer experimentellen Therapie starten und je nachdem, wie das Ansprechen ist, die Therapie intensivieren, deeskalieren, um dann stratifizieren. So können wir Patient:innen zielgerichteter behandeln. Wir müssen aktiv und dynamisch auf Veränderungen des Tumors reagieren.
Die Substanzen, die dafür eingesetzt werden können, sind vielfältig. Das Ausmaß der Entwicklung antitumoraler Wirkstoffe ist enorm.
Wie ordnen Sie die Studie im internationalen Kontext ein?
G. Rinnerthaler: Ich finde es sehr toll, dass wir über die ABCSG in Österreich die Möglichkeit haben, uns zunehmend auf Deeskalationsstudien zu fokussieren. Deeskalation ist nämlich deutlich schwerer umzusetzen als Eskalation. Eskalation ist statistisch einfacher und macht es auch leichter, Kooperationspartner zu finden. Das sind Hürden, die die Entwicklung solcher Deeskalationsstudien bremsen. Die ABCSG hat sich dennoch auf die Fahnen geheftet, in Österreich diese neuen Therapiekonzepte zu entwickeln. Zwei weitere Studien zur Reduktion von Chemotherapie starten gerade. Österreich liegt international vorne in der Entwicklung solcher Therapiestrategien.
Literatur:
Rinnerthaler G et al.: Neoadjuvant atezolizumab in combination with dual HER2 blockade plus epirubicin in women with early HER2-positive breast cancer: the randomized phase 2 ABCSG-52/ATHENE trial. Nat Cancer 2025; 6(1): 41-50
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...