Diagnostik und Therapie genitaler Präkanzerosen der Frau
Autorin:
Prof. Dr. Julia Gallwas
Klinik für Gynäkologie und Geburtshilfe
Universitätsmedizin Göttingen
Standardisierte Untersuchungs- und Behandlungsalgorithmen, technische Neuerungen, methodische Entwicklungen sowie das zunehmende Wissen um die Zusammenhänge zwischen Infektionen mit humanen Papillomviren (HPV) und Tumorentstehung haben in den letzten beiden Jahrzehnten die Diagnostik und Therapie genitaler Präkanzerosen maßgeblich beeinflusst und in hohem Maße verbessert.
Keypoints
-
Mögliche Alternativen zur zytologischen Krebsvorsorge sind die primäre HPV-Testung mit Zytologie-Triage, die primäre HPV-Testung mit „High risk“-HPV-Genotypisierung sowie das Co-Testing.
-
Die Inzidenz von Adenokarzinomen der Zervix hat deutlich zugenommen. Ein AIS kann leicht übersehen werden, da die zytologische Befundung und die kolposkopische Diagnosestellung erschwert sind.
-
75–85% der schweren Dysplasien der Vulva sind HPV-assoziiert, die übrigen mit chronischer Entzündung.
-
65–80% aller Vulvakarzinome entstehen infolge einer dVIN, 20–35% in Zusammenhang mit HPV. Das 10-Jahres-Risiko für die Entstehung eines Karzinoms aus einer Vorstufe beträgt ca. 10%, für eine HSIL 9% und für eine dVIN 50%.
-
Die Behandlung vulvärer Dysplasien zielt darauf ab, die Entstehung eines invasiven Karzinoms zu vermeiden, Symptome zu beseitigen und Anatomie und Funktion der Vulva zu erhalten.
Zervikale intraepitheliale Dysplasien (CIN)
Seit den 1960er-Jahren wird der zytologische Abstrich zur Erkennung zervikaler Dysplasien im Rahmen nationaler Vorsorgeprogramme angewandt. In vielen Ländern zeigte sich in der Folge ein Abfall der Zervixkarzinominzidenz um mehr als 70%, und man kann mit Recht sagen, dass die Einführung des zytologischen Screenings eine der erfolgreichsten präventivmedizinischen Maßnahmen in der Medizin darstellt. Jedoch haben der Nachweis des Zusammenhangs von HPV-Infektion und Dysplasie, die Möglichkeit der HPV-Testung, neue Entwicklungen auf dem Gebiet der Immunzytochemie und nicht zuletzt die HPV-Impfung in vielen Ländern zu einem Paradigmenwechsel geführt. Es stellt sich zunehmend die Frage, welche Rolle die HPV-Testung in der Zukunft spielen und in welchem Maße sie das zytologische Screening ergänzen oder ersetzen wird. Für weniger entwickelte Länder, in denen flächendeckende zytologische Untersuchungen nicht möglich sind, stellt die HPV-Testung einen Hoffnungsschimmer dar. 85% der Frauen weltweit haben keinen Zugang zu regelmäßigen Vorsorgeuntersuchungen und 80% der Frauen, die an einem Zervixkarzinom erkranken, stammen aus diesen Regionen.
Aber auch in Ländern mit funktionierendem Gesundheitssystem wird die primäre HPV-Testung als Alternative oder Ergänzung zum zytologischen Screening implementiert oder zumindest diskutiert. Diesem Paradigmenwechsel zugrunde liegen die Ergebnisse großer multizentrischer Studien, die belegen konnten, dass bei einem negativen HPV-Test das Risiko, eine schwere Dysplasie zu entwickeln, auch über einen längeren Beobachtungszeitraum sehr gering ist, also die HPV-Testung mit anderen Worten einen langfristig hohen negativen prädiktiven Wert aufweist.
Die Qualität eines Screening-Verfahrens wird primär dadurch bestimmt, inwieweit höhergradige Dysplasien erkannt und unnötige Kolposkopien vermieden werden. Auch sollten die Screening-Intervalle möglichst lang sein. Die wesentlichen Parameter für diese Ziele sind der negative und positive prädiktive Wert. Dabei ist der langfristige negative prädiktive Wert der bestimmende Faktor für die Festlegung sicherer Screening-Intervalle, während der positive prädiktive Wert einen Faktor darstellt, der das Ausmaß unnötiger Untersuchungen widerspiegelt.
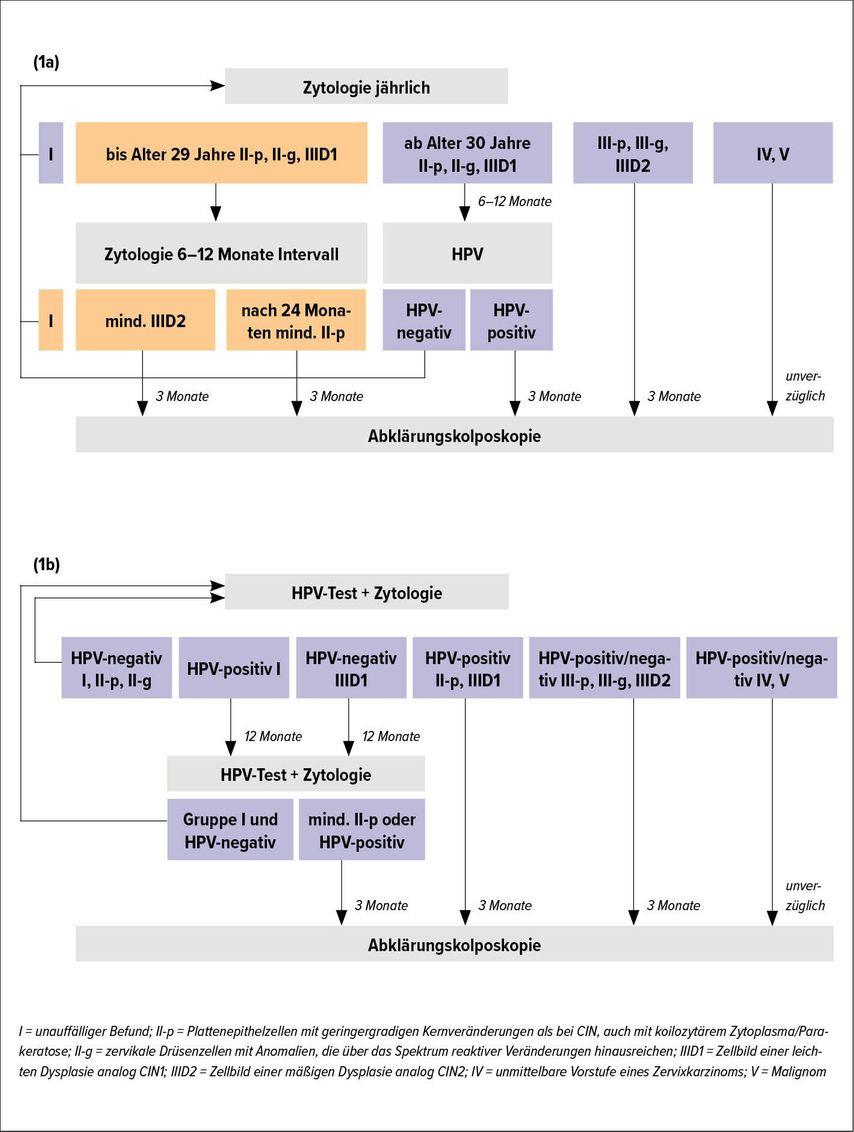
Inzwischen wurden in einigen Ländern HPV-basierte Screening-Algorithmen wie die primäre HPV-Testung mit Zytologie- Triage oder die primäre HPV-Testung mit „High risk“-HPV-Genotypisierung implementiert. In Deutschland entschied man sich nach mehrjährigen Diskussionen im Wesentlichen für die Beibehaltung des zytologischen Screenings mit der wesentlichen Änderung eines Zytologie/HPV-Co-Testings für Frauen über 35 Jahre. Der seit Jänner 2020 gültige deutsche Abklärungsalgorithmus ist in Abbildung 1 dargestellt. Bei Frauen bis zum 30. Lebensjahr erfolgt wie bisher eine rein zytologische Abklärung, zwischen dem 30. und 34. Lebensjahr wird zusätzlich die HPV-Testung als Triage-Untersuchung eingesetzt, und ab dem 35. Lebensjahr erfolgt dann, wie bereits erwähnt, ein Co-Testing.
Abb. 1a/b: Der seit Januar 2020 gültige deutsche Abklärungsalgorithmus. Bei Frauen bis zum 30. Lebensjahr erfolgt wie bisher eine rein zytologische Abklärung (a), zwischen dem 30. und 34.Lebensjahr wird zusätzlich die HPV- Testung als Triage-Untersuchung eingesetzt (a), und ab dem 35. Lebensjahr erfolgt ein Co-Testing
Im Vergleich zum invasiven Plattenepithelkarzinom der Zervix hat die Inzidenz von Adenokarzinomen in den letzten Jahrzehnten deutlich zugenommen. Lag der Anteil in den 1970er-Jahren noch bei rund 10%, stieg er bis heute auf etwa 20 bis 25%. Der überwiegende Teil der Adenokarzinome ist HPV-assoziiert, eine Reihe seltenerer histologischer Typen lässt diesen Bezug jedoch nicht erkennen. Es handelt sich um eine Neoplasie des jungen Alters, gleichzeitige epitheliale Veränderungen bestehen immerhin in 50% der Fälle. Bei der Erkennung von Präkanzerosen ergibt sich die Besonderheit, dass die zytologische Befundung atypischer glandulärer Zellen schwierig ist und ein Adenocarcinoma in situ (AIS) leicht übersehen werden kann. Aber auch die Diagnose AIS kolposkopisch zu stellen ist nicht leicht, da oft nur kleinste Veränderungen in der Oberflächenkontur bestehen, die Transformationszone häufig nicht komplett einsehbar ist, und die für plattenepitheliale Dysplasien so typischen Veränderungen wie grobe Punktierung oder grobes Mosaik keine Merkmale einer glandulären Neoplasie darstellen. In Zahlen ausgedrückt beträgt das Verhältnis von AIS zu hochgradigen intraepithelialen Läsionen (HSIL) in der bioptischen Diagnose etwa 2% zu 98%. Wenn man einen Anteil an Adenokarzinomen von 20% annimmt, besteht in der Relation AIS zu Karzinomen ein Missverhältnis von 1:10. Hinzu kommt, dass in 50–70% der Fälle eine Koexistenz von AIS und HSIL besteht. Die regelmäßige Durchführung einer endozervikalen Kürettage als Ergänzung zur Kolposkopie wird kontrovers diskutiert. Nachteilig sind hohe Raten falsch positiver und falsch negativer Befunde und damit ein niedriger positiver prädiktiver Wert. Jedoch besteht Übereinstimmung darin, dass bei allen Patienten mit atypischen glandulären Zellen in der Zytologie eine endozervikale Kürettage zusätzlich zur Kolposkopie erfolgen sollte.
Die Indikation zur Konisation stellt sich bei einer bioptisch nachgewiesenen schweren zervikalen intraepithelialen Dysplasie, also einer CIN 3 bzw. HSIL in der Bethesda-Klassifikation. Die Konisation ist ein therapeutischer Eingriff mit dem Ziel, die schwere Dysplasie komplett zu entfernen. Sie sollte idealerweise in Form einer LEEP („Loop Electrical Excision Procedure“) durchgeführt werden. Ein entscheidender Faktor für das Auftreten eines Rezidivs sind postoperativ positive Absetzungsränder und eine Persistenz von Hochrisiko-HPV-Typen. Eine sofortige Rekonisation ist jedoch meinst nicht gerechtfertigt, insbesondere wenn ein Kinderwunsch besteht. Dieses Vorgehen gilt nicht bei Vorliegen eines AIS.
Aufgrund der vorliegenden Datenlage ist eine HPV-Impfung nach Konisation möglich.
Vulväre interepitheliale Neoplasien (VIN)
Die Vulva stellt den Untersucher oft vor große diagnostische Herausforderungen, da neben gynäkologischen Erkrankungen auch Infektionen und dermatologische Krankheitsbilder eine wichtige Rolle spielen. Eine sorgfältige Anamnese in alle Richtungen stellt einen ganz wesentlichen Teil der Vulvadiagnostik dar. Die bei Weitem häufigsten Symptome sind Juckreiz und Schmerzen. Oft besteht eine Diskrepanz zwischen Beschwerden und objektivem Befund, andererseits müssen trotz Pathologie nicht zwingend Symptome vorhanden sein. 40–50% der Patientinnen mit einem Vulvakarzinom oder seinen Präkanzerosen sind asymptomatisch, also rund die Hälfte aller Vulvakarzinome oder Vorstufen wird erst im Rahmen einer Routineuntersuchung entdeckt. Pauschal kann man sagen, dass jüngere Patientinnen eher eine kurze Anamnese und eine akute Symptomatik zeigen und bei älteren Patientinnen chronische Verläufe im Vordergrund stehen. Der isolierte zytologische Abstrich der Vulva ist in der Regel unspezifisch und sollte nicht routinemäßig durchgeführt werden. Eine HPV-Testung ist dann sinnvoll, wenn der Verdacht auf eine HPV-induzierte Läsion besteht. Zentraler Bestandteil einer jeden Abklärung vulvärer Läsionen ist die Vulvoskopie. Prinzipiell erfolgt sie wie eine Kolposkopie der Zervix, zunächst beginnend mit einer geringen Vergrößerung zur Orientierung. Kleinere Läsionen können anschließend, wenn erforderlich, mit höherer Vergrößerung beurteilt werden. Die Indikation zur Biopsie sollte bei allen suspekten Läsionen großzügig gestellt werden, insbesondere bei denen, die auf eine Behandlung nicht ansprechen.
Die in der Rio-Klassifikation zusammengefasste kolposkopische Nomenklatur der Vulva ist überwiegend deskriptiv und soll einheitlich für verschiedene Fachgebiete – Gynäkologie, Dermatologie, Proktologie und Pathologie – gelten. In ihr werden pathologische Befunde wie Ekzem, Erosion oder Ulkus klar definiert und sollten in der Dokumentation Verwendung finden.
Für vulväre Präkanzerosen existieren zwei unterschiedliche Entstehungsmechanismen, die auch in der WHO-Klassifikation Berücksichtigung finden. In über 90% der Fälle sind die Veränderungen HPV-assoziiert, es handelt sich um eine sogenannte „usual type“ VIN (uVIN). Unterschieden wird in der neuesten Klassifikation von 2014 zwischen niedriggradigen intraepithelialen Läsionen (LSIL) und HSIL. Die Ausbreitung ist multifokal und multizentrisch, häufig bestehen zusätzlich eine CIN, eine vaginale oder anale Dysplasie. Von der „usual type“ VIN unterschieden wird ein HPV-unabhängiger differenzierter Typ, die sogenannte dVIN, die in der Regel auf der Basis chronischer Läsionen wie dem Lichen sclerosus entsteht. 75–85% aller schweren Dysplasien sind HPV-assoziert, 15–25% entsprechen einer dVIN. Im Gegensatz dazu entstehen jedoch 65–80% aller Vulvakarzinome auf dem Boden einer dVIN bzw. eines Lichen sclerosus, aber nur 20–35% als Folge einer HPV-Infektion. Das Erkrankungsalter liegt bei den HPV-assoziierten Karzinomen auch deutlich niedriger, ähnlich dem der Zervixkarzinome, während das nicht HPV-assoziierte Karzinom eher eine Erkrankung des hohen Alters ist. Das kumulative 10-Jahres-Risiko für die Entstehung eines Karzinoms aus einer Vorstufe beträgt insgesamt etwa 10%, für eine HSIL 9% und für eine dVIN 50%.
Die Behandlung vulvärer Dysplasien hat zum Ziel die Entstehung eines invasiven Karzinoms zu vermeiden, Symptome zu beseitigen und die Anatomie und Funktion der Vulva zu erhalten. Dabei berücksichtigt werden müssen die individuelle Lebenssituation und Wünsche der Patientin sowie Histologie und Ausdehnung der Läsion. Anders als die einfache Vulvektomie, die heute nur noch sehr selten durchgeführt wird, stehen als Therapieoptionen die lokale Exzision, die Laserablation und topische Therapien bzw. Kombinationen der genannten Optionen im Vordergrund. Der große Vorteil der lokalen Exzision besteht in der Möglichkeit einer vollständigen histologischen Aufarbeitung. Die CO2-Laserablation bietet sich an bei multifokalem Geschehen oder Befunden, die nahe an der Klitoris, perianal, anal oder vaginal gelegen sind. Die lokale topische Therapie mit Imiquimod stellt inzwischen durchaus eine Alternative zu ablativen Verfahren dar. Die Datenlage hat sich in den letzten Jahren deutlich verbessert, und die Ergebnisse mit Remissionsraten um die 50% sind vielversprechend.
Vaginale intraepitheliale Dysplasien (VaIN)
Vaginale intraepitheliale Dysplasien sind mit einer Inzidenz von 0,2–0,3/ 100000 Einwohner/Jahr sehr selten. Der Altersgipfel liegt zwischen dem 40. und 60. Lebensjahr. In 70% der Fälle sind sie assoziiert mit einer CIN. Als Risikofaktoren gelten eine HPV-Infektion, eine vorausgegangene CIN, Strahlentherapie und Immunsuppression. Die VaIN ist meist asymptomatisch, Patientinnen berichten unter Umständen über postkoitales Spotting oder vaginales Missempfinden. Die Veränderungen sind meist im oberen Drittel der Vagina lokalisiert, 2–5% der Vorstufen entwickeln sich zu einem Vaginalkarzinom. Niedriggradige Dysplasien werden beobachtet, höhergradige Veränderungen können durch CO2-Laserung, Exzision, topische Therapie oder Strahlentherapie behandelt werden. Angenommen wird eine Rezidivrate von 20–30%.
Literatur:
• Koliopoulos G et al.: Cytology versus HPV testing for cervical cancer screening in the general population. Cochrane Database Syst Rev 2017; 8(8): CD008587 • Petry KU et al.: 2017 update of the European Federation for Colposcopy (EFC) performance standards for the practice of colposcopy. Eur J Obstet Gynecol Reprod Biol 2018; 224: 137-41 • Preti M et al.: Vulvar intraepithelial neoplasia. Best Pract Res Clin Obstet Gynaecol 2014; 28(7): 1051-62 • Singh N, Gilks CB: Vulval squamous cell carcinoma and its precursors. Histopathology 2020; 76(1): 128-38 •Teoh D et al.: Diagnosis and management of adenocarcinoma in situ: a Society of Gynecologic Oncology evidence-based review and recommendations. Obstet Gynecol 2020; 135(4): 869-78
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...