Diagnose Lymphom/Leukämie bei Schwangeren: Wie therapieren?
Bericht: Jasmin Gerstmayr, MSc
Welche Medikamente kann ich einer Schwangeren, die an einer hämatologischen Neoplasie leidet, verabreichen? Mit dieser heiklen Frage beschäftigt sich Prof. Dr. Georg Maschmeyer vom Klinikum Ernst von Bergmann in Potsdam. Im Folgenden eine Zusammenfassung seines Vortrages auf der Jahrestagung 2021 der DGHO, OeGHO, SGMO und SGH.
Das International Network on Cancer, Infertility and Pregnancy (INCIP) untersuchte, welche Arten maligner Erkrankungen zwischen 1996 und 2016 bei schwangeren Frauen erstdiagnostiziert wurden. 10% aller Erstdiagnosen waren dabei Lymphome, 6% Leukämien. 58% bzw. 34% dieser Patientinnen erhielten eine Chemotherapie.1 Diese recht niedrigen Raten sind laut Prof. Maschmeyer das Ergebnis des mittlerweile definitiv überholten Paradigmas, dass eine Chemotherapie bei Schwangeren vermieden werden sollte.
Die Physiologie ist während einer Schwangerschaft beträchtlichen Änderungen unterworfen, diese gilt es im Hinblick auf potenziell geänderte pharmakologische Eigenschaften von Medikamenten im Hinterkopf zu behalten. Genannt werden können etwa ein um 1200 ml höheres Plasmavolumen, ein um 300 ml höheres Erythrozytenvolumen, eine verminderte Albuminkonzentration2, eine erhöhte renale Clearance3 sowie eine raschere hepatische Metabolisierung4. Doch trotz dieser Unterschiede sollte die Dosierung von Krebsmedikamenten so vorgenommen werden wie bei Nichtschwangeren; Chemotherapeutika etwa nach aktuellem Körpergewicht.
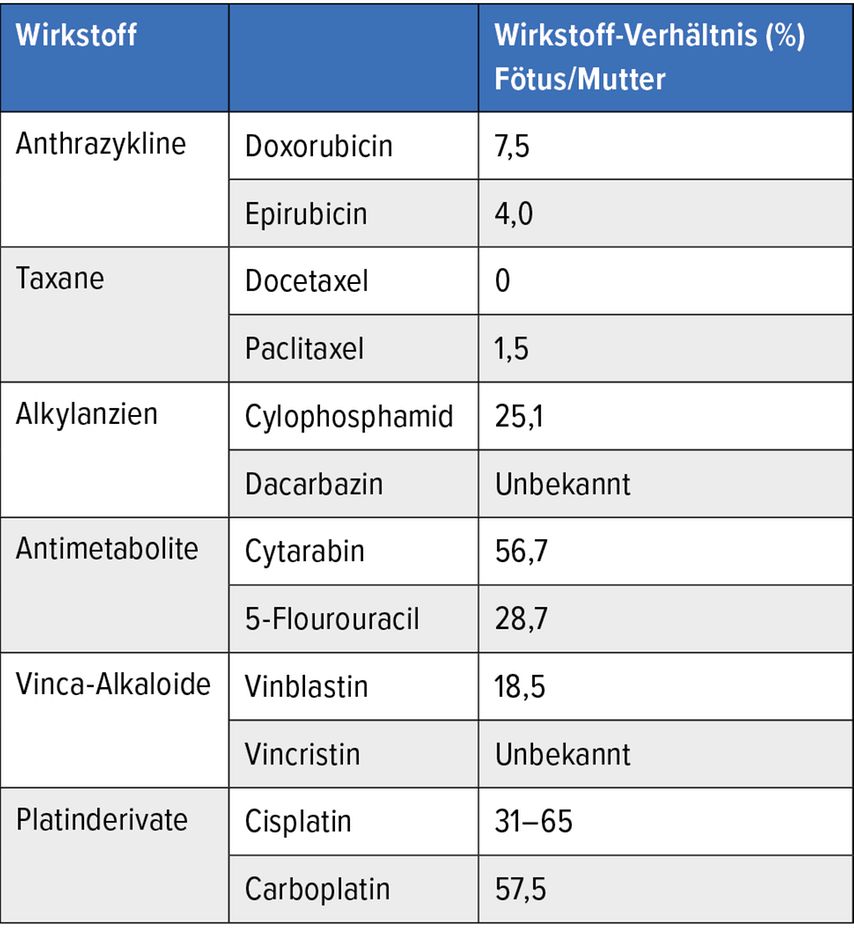
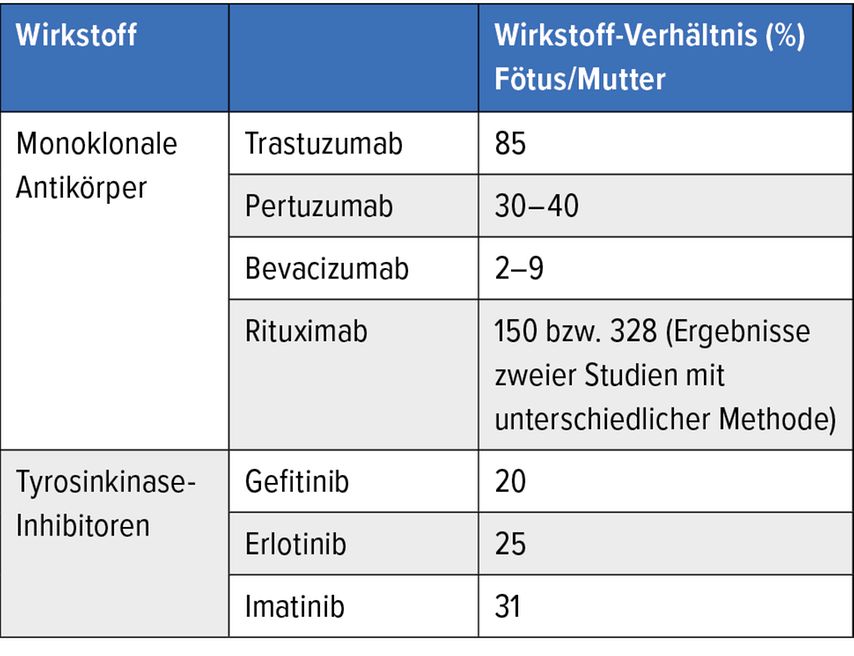
Die meisten Standard-Chemotherapeutika sind plazentagängig, z.B. Cyclophosphamid und Daunorubicin. Die Placentagängigkeit ist jedoch nicht die entscheidende Größe. Viel wichtiger ist: Wie viel vom medikamentösen Wirkstoff geht von der Plazenta in den fetalen Kreislauf über? Die Datenlage zu dieser Frage ist naturgemäß dünn, die meisten Daten stammen aus Versuchen an Affen, Ratten und Mäusen. Von den chemotherapeutischen Wirkstoffen scheinen Taxane und Anthrazykline wie Doxorubicin und Epirubicin tendenziell eher in der Plazenta zu bleiben, während etwa Cytarabin vermutlich zu großen Teilen in den fetalen Kreislauf eintritt (Tab. 1). Bei den ebenso spärlichen Daten zu Biologika ist besonders auffällig, dass sich Rituximab sogar im fetalen Kreislauf zu akkumulieren scheint, also dort in einer weit höheren Konzentration vorliegt als im mütterlichen (Tab.2).5
Tab. 1: Übersicht über den Eintritt gängiger Chemotherapeutika in den fötalen Kreislauf. Modifiziert nach Miyamoto S et al.5
Tab. 2: Übersicht über den Eintritt gängiger monoklonaler Antikörper und Tyrosinkinase-Inhibitoren in den fötalen Kreislauf. Modifiziert nach Miyamoto S et al.5
Richtig therapieren in der Schwangerschaft
Lymphome
Prinzipiell gilt: Bei Schwangeren, die an Lymphomen leiden, können die Standards für kurative Therapien weitestgehend 1:1 von denen für Nichtschwangereübernommen werden.6 Bei Notwendigkeit einer Glukokortikoidtherapie sollten Prednisolon und Methylpredinsolon bevorzugt eingesetzt werden, da sie am wenigsten in den fetalen Kreislauf eintreten.7
Die Onkopedia-Leitlinie zum diffusen großzelligen B-Zell-Lymphom (DLBCL) empfiehlt zur Lymphomtherapie in der Schwangerschaft das R-CHOP-Protokoll als Standard. Antimetaboliten, wie etwa Methotrexat, dürfen nicht verwendet werden, da sie fetale ZNS-Schäden verursachen können. Wird ein aggressives Lymphom im ersten Trimenon einer Schwangerschaft diagnostiziert, ist ein Abbruch der Schwangerschaft empfehlenswert. Eine Chemotherapie in diesem Schwangerschaftsabschnitt birgt ein hohes Risiko für Missbildungen. Im zweiten und dritten Trimenon ist dieses Risiko hingegen gering. Wenn das Lymphom erst in der Spätschwangerschaft auftritt und einen wenig aggressiven Verlauf zeigt, kann die Behandlung auch erst zu einem Zeitpunkt nach der Geburt begonnen werden.8
Akute myeloische Leukämie
Die Datenlage zur Therapie von Schwangeren mit akuter myeloischer Leukämie ist sehr dünn. Grundsätzlich scheint die Standardtherapie während der Schwangerschaft sicher und effektiv zu sein. Hochrisikopatientinnen sollten frühzeitig für eine allogene Stammzelltransplantation (allo-SZT) vorgestellt werden.9 Chang A und Patel S konnten in einem Review eine erhöhte Rate von fetalen Toden und Spontanaborten bei Chemotherapiebeginn im ersten Trimenon feststellen, verglichen mit Beginn im zweiten oder dritten Trimenon (37,5 vs. 9,7 vs. 0%). Interessant ist, dass Missbildungen/Tod des Fetus bei Gabe von Cytarabin in Kombination mit Idarubicin verglichen mit der Kombination Cytarabin + Daunorubicin deutlich häufiger auftraten (28,6%/12,5% unter Idarubicin, 8,5%/6,4% unter Daunorubicin). Möglicherweise ist dies eine Folge der höheren Gefäß- und Schleimhauttoxizität von Idarubicin. Daunorubicin ist deshalb bei Schwangeren mit AML klar vorzuziehen.10
Akute Promyelozyten-Leukämie
In der Behandlung von Schwangeren mit akuter Promyelozyten-Leukämie (APL) dürfen keinesfalls Arsenderivate, etwa Arsentrioxid, verwendet werden, da diese stark embryotoxisch sind.11 Laut Onkopedia-Richtlinien bestehen bei Schwangeren mit APL keine Kontraindikationen gegen eine Kombinationsbehandlung mit All-trans-Retinsäure (ATRA) und Anthrazyklinen, solange sich die Schwangere im zweiten oder dritten Trimenon befindet. Jedoch treten Aborte und Frühgeburten häufiger auf, ebenso haben die Neugeborenen ein höheres Risiko für ein niedrigeres Geburtsgewicht. Deshalb kann bei Schwangeren mit APL von niedrigem oder intermediärem Risiko bis nach der Geburt eine ATRA-Monotherapie verabreicht werden. Zählt die Patientin zur Hochrisikogruppe, ist jedoch eine Kombinationstherapie von ATRA und Anthrazyklinen (vorzugsweise Daunorubicin) empfohlen, trotz der genannten Risiken.12
Chronische myeloische Leukämie
Traditionell wird die chronische myeloische Leukämie (CML) mit Tyrosinkinase-Inhibitoren (TKI) behandelt. Aufgrund des hohen teratogenen Risikos dürfen diese Wirkstoffe bei Schwangeren jedoch nicht verwendet werden. Deshalb muss auf ältere Therapieoptionen zurückgegriffen werden, wie z.B. Interferon (IFN) in einer Dosis von 3x3 Mio IE/Woche, welches in der Stillphase jedoch abgesetzt werden sollte. Die Verabreichung von PEG-IFN sollte in der Schwangerschaft, wenn möglich, vermieden werden, da Polyethylenglykol im Körper akkumuliert.13
Supportivtherapie
Zur Supportivtherapie bei Schwangeren hat Prof. Maschmeyer im Rahmen seines Vortrages folgende Punkte hervorgehoben:
-
Von den Antiemetika gelten Metoclopramid und 5-HT3-Antagonisten als sicher in der Schwangerschaft, von Aprepitant wird abgeraten, da noch nicht genügend Daten zur Anwendung in der Schwangerschaft vorhanden sind.14
-
Aus der Gruppe der Antibiotika gilt es Aminoglykoside, Trimethoprim und Tetrazycline zu vermeiden.15, 16
-
Der Einsatz des Granulozyten-Kolonie-stimulierenden Faktors (G-CSF) ist wahrscheinlich unproblematisch.15, 16
-
Niedermolekulare Heparine dürfen prophylaktisch und therapeutisch zum Einsatz kommen.15, 16
-
Für Bisphosphonate gibt es keine klare Empfehlung. Eine Arbeit aus 2008 stellte allerdings bei 51 Frauen, die Bisphosphonate vor oder während der Schwangerschaft erhalten hatten, keine Schäden bei den Neugeborenen fest.17
Wann behandeln?
Allgemein gilt: Bei Auftreten/Diagnose einer hämatologischen Neoplasie im ersten Trimester einer Schwangerschaft wird tendenziell zu einem Schwangerschaftsabbruch geraten, da die Therapie ein hohes Risiko für fetale Missbildungen und Fehlgeburten birgt. Eine medikamentöse Krebstherapie, die im zweiten Trimenon begonnen wird, ist hingegen nur mit einer gering erhöhten Rate von Fehlgeburten, Wachstumsverzögerungen und geistiger und körperlicher Minderentwicklung assoziiert. Bei Therapiebeginn im dritten Trimenon ist der Schwangerschaftsverlauf weitgehend vergleichbar mit einer normalen Schwangerschaft.18, 19
Abschließend bedauert Prof. Maschmeyer: „Die medikamentöse Behandlung maligner Neoplasien in der Schwangerschaft ist in der Hämatologie zu wenig beleuchtet.“ Aus diesem Grund planen er und Kolleg*innen, in naher Zukunft eine Onkopedia-Leitlinie zu diesem Thema zu erstellen, um mehr Klarheit in die klinische Routine zu bringen.
Quelle:
Vortrag „Medikamentöse Therapie hämatologischer Neoplasien bei Schwangeren“ von Prof. Dr. Georg Maschmeyer, 3. Oktober 2021, im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie, 1.–4. Oktober 2021
Literatur:
1 de Haan J et al.: Lancet Oncol 2018 Mar;19(3):337-46 2 Evans SR et al.: Curr Probl Surg 2012; 49: 333-88 3 Lindheimer IA et al.: Semin Nephrol 2001; 21: 173-89 4 Berveiller P et al.: Ann Oncol 2014; 25: 1869-70 5 Miyamoto S et al.: Jpn J Clin Oncol 2016; 46: 795-804 6 Duleay K, McLintock C: Blood 2020; 136: 2118-24 7 Lishner M et al.: J Clin Oncol 2015; 34: 501-8 8 Onkopedia-Leitlinie: 2021. Online unter https://www.onkopedia.com/de/onkopedia/guidelines/diffuses-grosszelliges-b-zell-lymphom/@@guideline/html/index.html . Abgerufen am 20.1.2022 9 Horowitz NA et al.: Leuk Lymphoma 2018; 59: 610-6 10 Chang A, Patel S: Ann Pharmacother 2015; 49: 48-68 11 Sanz MA et al.: Blood 2019; 133: 1630-43 12 Onkopedia-Leitlinie: 2020. Online unter https://www.onkopedia.com/de/onkopedia/guidelines/akute-promyelozyten-leukaemie-apl/@@guideline/html/index.html . Abgerufen am 20.1.2022 13 Onkopedia-Leitlinie: 2018. Online unter https://www.onkopedia.com/de/onkopedia/guidelines/chronische-myeloische-leukaemie-cml/@@guideline/html/index.html . Abgerufen am 20.1.2022 14 Drugs.com: 2021. Online unter https://www.drugs.com/pregnancy/aprepitant.html . Abgerufen am 21.1.2022 15 Lishner M et al.: J Clin Oncol 2015; 34: 501-8 16 Zagouri F et al.: BMC Preg Child 2020; 20: 747 17 Djokanovic N et al.: J obstet Gynaecol Can 2008; 30: 1146-8 18 Karen G et al.: J Obstet Gynaecol Can 2013; 35: 263-79 19 Peccatori FA et al. (ESMO-Leitlinie): Ann Oncol 2014; 24(Suppl 6): vi60-70
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...