Das Zytomegalovirus und die Rezidivinzidenz: die Rolle der KIR-Liganden
Autoren:
OA Univ.-Doz. Dr. Johannes Clausen1
Cand. med. Alexander Nikoloudis1
Assoz. Univ.-Prof.in Mag.aDr.in Helga Wagner2 1
Interne 1 – Hämatologie & Onkologie
Ordensklinikum Linz Elisabethinen
2 Department of Applied Statistics: Medical
Statistics and Biometry, and Competence
Center for Clinical Studies
Johannes Kepler Universität Linz
Korrespondenz:
E-Mail: alexander.nikoloudis@gmail.com
Während das Risiko für Morbidität und Non-Relaps-Mortalität (NRM) im Zusammenhang mit einer frühen Zytomegalievirus-Reaktivierung (CMVR) nach allogener Stammzelltransplantation (SZT) gut dokumentiert ist, gibt es eine anhaltende Debatte darüber, ob eine CMVR das Risiko für ein Rezidiv der primären Erkrankung verringern kann. Über die Wechselwirkung von HLA(Humanes Leukozytenantigen-System)-C-Liganden der inhibitorischen „Killer-cell immunoglobulin-like receptors“ (KIR) mit einer frühen CMVR in dieser Hinsicht ist wenig bekannt.
Keypoints
-
Eine antileukämische Wirkung der frühen CMVR nach SZT für AML/MDS ist strengauf Empfänger beschränkt, die homozygot für HLA-C-KIRL sind.
-
Dies wurde durch eine signifikante nachteilige Wirkung einer frühen CMVR auf akute (a) GVHD und NRM bei homozygoten Empfängeren antagonisiert.
-
Bei heterozygoten HLA-C-KIRL-Empfängern reduzierte eine frühe CMVR das Rezidiv nicht und war ein weniger signifikanter Auslöser für aGVHD und das Risiko für eine NRM.
Hintergrund und Methoden
Trotz der Einführung von präemptiven CMV-Therapien bleibt die CMVR nach allogener SZT mit einem erhöhten Risiko für Morbidität und NRM verbunden.1 Verschiedene Studien haben eine Rezidivsenkung2–4 im Zusammenhang mit einer frühen CMVR gezeigt, während andere Studien dies nicht reproduzieren konnten.1,5,6 Da die CMVR die Rekonstitution nach SZT und das Repertoire der natürlichen Killerzellen (NK-Zellen) beeinflusst,7 haben wir postuliert, dass der HLA-C-KIR-Liganden-Status der EmpfängerInnen einen Einfluss auf die potenzielle antileukämische Wirkung einer frühen CMVR nach der Transplantation hat. Die inhibitorischen KIRauf der Oberfläche von Killerzellen interagieren mit HLA-Klasse-I-Molekülen als Liganden, wie den HLA-C-Molekülen, die durch Charakteristika der Aminosäureabfolge in zwei Gruppen unterteilt werden können. Die HLA-C-KIR-Liganden der Gruppe 1 (C1) interagieren mit den Rezeptoren KIR2DL2 und KIR2DL3 und die HLA-C-KIR-Liganden der Gruppe 2 (C2) interagieren mit dem KIR2DL1-Rezeptor. In Summe hat fast jedes Individuum inhibitorische KIR für beide HLA-C-KIR-Liganden-Gruppen.8
Unter physiologischen Umständen werden gemäß der Lizenzierungshypothese NK-Zellen mit einem inhibitorischen Rezeptor durch den Kontakt mit dem geeigneten HLA-Liganden lizenziert und werden somit potenziell alloreaktiv, während NK-Zellen, die nur inhibitorisches KIR für Nicht-selbst-HLA exprimieren, unter physiologischen Bedingungen hyporesponsiv bleiben. Dieser Mechanismus sichert einerseits die Toleranz von NK-Zellen gegenüber physiologischem „Selbst“ sowie andererseits die Aktivierbarkeit der NK-Zellen, sobald „Selbst“ (nämlich HLA-Klasse-I-Expression) von transformierten oder virusinfizierten Zellen herunterreguliert wird, um einer T-Zell-Antwort zu entgehen.
In dieser Studie wollen wir die Hypothese testen, dass homozygote Träger von KIR-Liganden der HLA-C-Gruppen 1 oder 2 (C1/1 und C2/2), die anfänglich eine geringere Population lizenzierter NK-Zellen aufweisen, einen Vorteil durch eine frühe CMVR im Sinne einer verringerten Rezidivrate haben, während heterozygote (C1/2) Empfänger der HLA-C-KIR-L-Gruppe mit einer höheren Anzahl lizenzierter NK-Zellen nicht von dem durch CMV vermittelten zusätzlichen Entzündungsstimulus profitieren.
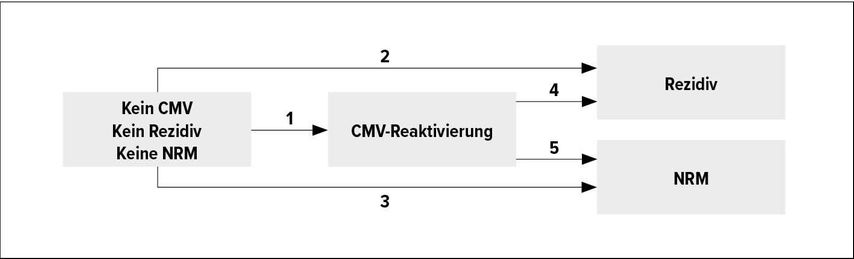
In dieser retrospektiven, bizentrischen Studie wurden 406 verwandte oder unverwandte Transplantationen bei Patienten mit akuter myeloischer Leukämie (AML) oder myelodysplastischem Syndrom (MDS) eingeschlossen. Der Einfluss einer frühen CMVR wurde nach HLA-C-KIRL-Status der Empfänger (homozygot [C1/1 oder C2/2] versus heterozygot [C1/2]) auf die Rezidivinzidenz getrennt und andere wichtige Endpunkte wurden untersucht. Realisiert wurde dies unter Verwendung von univariaten und multivariaten Landmarkanalysen, Cox-Proportional-Hazard-Analysen mit CMVR als zeitabhängiger Variable und schließlich in einem Multistate-Modell (Abb. 1).
Ergebnisse und Zusammenfassung
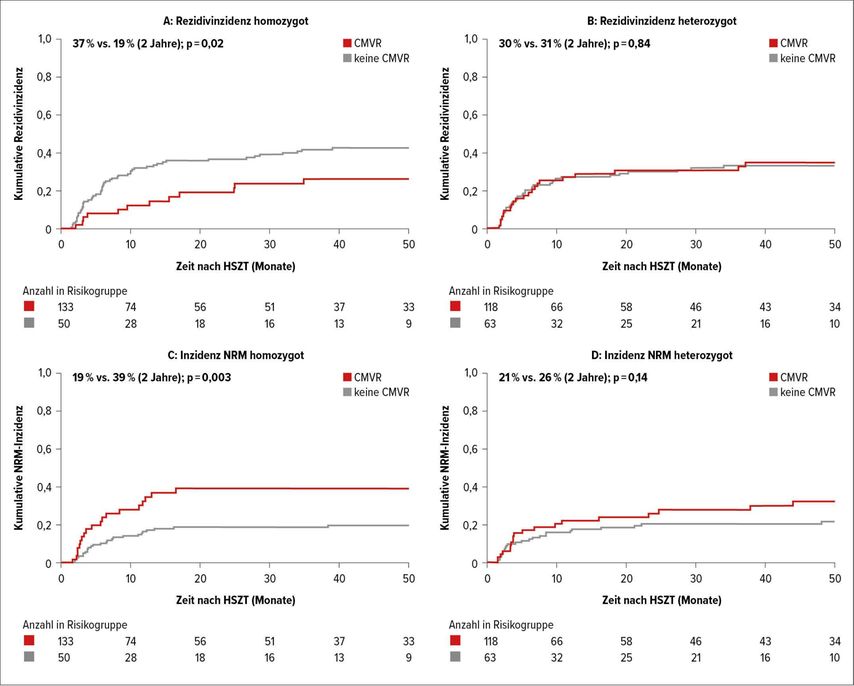
HLA-C-KIRL-homozygote Empfänger (C1/1 oder C2/2), die bis zum 45. Tag nach SZT rezidivfrei blieben und eine CMVR hatten (Landmark Tag 45; Abb. 2A), hatten eine geringere Rezidivinzidenz als solche ohne eine CMVR bis zu diesem Zeitpunkt (Sub-Hazard-Ratio [sHR]: 0,35; p=0,002). Dies stand im Gegensatz zu heterozygoten (C1/2) Empfängern (Abb. 2B), die zu keiner Landmark einen signifikanten Einfluss einer frühen CMVR auf die Rezidivinzidenz zeigen konnten (Landmark Tag 45: sHR 0,88; p=0,63).
Abb. 2: Kumulative Inzidenzkurven zur Landmark Tag 45. CMVR (rot); keine CMVR (grau). Rezidivinzidenz homozygot (A) und heterozygot (B); Inzidenz NRM homozygot (C) und heterozygot (D)
In einem konfirmatorischen univariaten Multistate-Modell führte eine frühe CMVR zu einem signifikant reduzierten Rezidivrisiko bei homozygoten (HR: 0,46; p=0,007), jedoch nicht bei heterozygoten Empfängern (HR: 1,08; p=0,77). Die Inzidenzen der NRM (sHR 3,31; p<0,001) und der GVHD-assoziierten Mortalität (sHR: 3,09; p=0,001) mit einer CMVR (Landmark Tag 45, Abbildung 2C+D) sind signifikant erhöht für homozygote, jedoch nicht heterozygote Empfänger (sHR: 1,23; p =0,53; und sHR: 1,36; p=0,44). Dies lässt sich durch eine erhöhte Inzidenz der akuten Graft-versus-Host-Disease (GVHD) durch eine frühe CMVR, die in beiden Gruppen beobachtet wurde, erklären, jedoch war dies bei den heterozygoten Empfängern wenigerausgeprägt. Frühe CMVR hatten in beiden Kohorten keinen Einfluss auf die chronische GVHD und weder gesamt- noch progressionsfreies Überleben wurden durch eine frühe CMVR signifikantbeeinflusst, unabhängig vom HLA-C- KIRL-Status der Empfänger.
Ein niedrigeres Rezidivrisiko nach SZT für Patienten mit AML oder MDS infolge einer CMVR war streng auf HLA-C-KIRL-homozygote Empfänger beschränkt. Dies wurde durch eine signifikant nachteilige Wirkung der CMVR auf die Inzidenzen von akuter (a) GVHD und NRM antagonisiert. Eine frühe CMVR reduzierte das Rezidivrisiko bei heterozygoten Empfängern nicht und war weniger ein signifikanter Trigger für eine aGVHD und das Risiko für NRM. Zusammenfassend kann festgestellt werden, dasssowohl günstige als auch ungünstige immunmodulierende Effekte einer frühen CMVR nach SZT vom KIR-Liganden-Status der Empfänger abhängen.
Literatur:
1 Teira P et al.: Early cytomegalovirus reactivation remains associated with increased transplant-related mortality in the current era: a CIBMTR analysis. Blood 2016; 127(20): 2427-38 2 Green ML et al.: CMV reactivation after allogeneic HCT and relapse risk: evidence for early protection in acute myeloid leukemia. Blood 2013; 122(7): 1316-24 3 Nakamura R et al.: Influence of donor KIR genotypes on reduced relapse risk in acute myelogenous leukemia after hematopoietic stem cell transplantation in patients with CMV reactivation. LeukRes 2019; 87: 106230 4 NikoloudisA: Einfluss einer frühen Zytomegalievirus(CMV)-Reaktivierung auf das Rezidivrisiko nach allogener Stammzelltransplantation ist beschränkt auf HLA-C killer immunoglobulin-like receptor ligand (KIRL) homozygote Patienten. DGHO-Jahrestagung 2020; Vortrag 377 5 Remberger M, Ringdén O: Survival after bone-marrow transplantation. Lancet 2002; 359(9309): 888 6 Admiraal R et al.: Viral reactivations and associated outcomes in the context of immune reconstitution after pediatric hematopoietic cell transplantation. J Allergy Clin Immunol 2017; 140(6): 1643-1650.e9 7 Foley B, Cooley S et al.: Cytomegalovirus reactivation after allogeneic transplantation promotes a lasting increase in educated NKG2C+ natural killer cells with potent function. Blood 2012; 119(11): 2665-74 8 Cook MA et al.: The impact of donor KIR and patient HLA-C genotypes on outcome following HLA-identical sibling hematopoietic stem cell transplantation for myeloid leukemia. Blood 2004; 103(4): 1521-62
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...