Biomarker beim Mammakarzinom: Welche Analysen sind Standard?
Autorin:
Univ.-Prof. Priv.-Doz. Dr. Florentia Peintinger
Fachärztin für Gynäkologie und Geburtshilfe
Medizinische Universität Graz
Um optimale Therapieentscheidungen beim Mammakarzinom zu gewährleisten, ergänzen standardisierte Biomarkeranalysen die traditionellen histopathologischen Tumorfaktoren wie Tumorgröße, Grading und Nodalstatus.
Prognostische Biomarker dienen nicht nur der Voraussage (krankheitsfreies Überleben [DFS], progressionsfreies Überleben [PFS], Gesamtüberleben [OS]), sondern helfen auch, die Indikation für konkrete therapeutische Optionen zu stellen, zum Beispiel endokrine Therapie, Chemotherapie, Anti-HER2-Therapie und andere gezielte Therapien.
Prädiktive Biomarker dienen der Voraussage des Tumoransprechens auf eine konkrete Therapie.
Einen besonderen Stellenwert hat die Information über den prätherapeutischen Biomarkerstatus für die Planung der optimalen neoadjuvanten Therapie (NAT).
Die Biomarkeranalyse beim Mammakarzinom startete mit der Bestimmung der Hormonrezeptorexpression, eines prognostischen/prädiktiven Biomarkers, der die gezielte endokrine Therapie mit Tamoxifen steuerte. Die anschließende Einführung zielgerichteter Therapien gegen den humanen epidermalen Wachstumsfaktor-Rezeptor 2 (HER2) revolutionierte das Biomarkerfeld und leitete über in den neuen Bereich der molekularen Biomarker mit aufwendiger Technologie zur Bestimmung von molekularen Veränderungen des Mammakarzinoms.
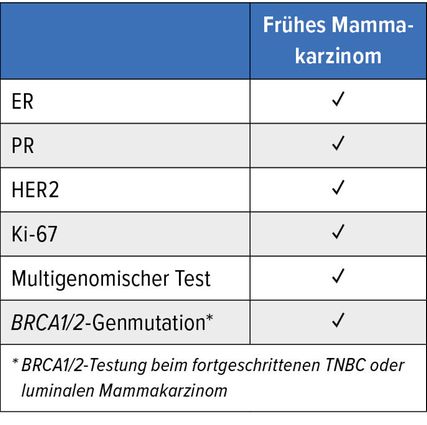
Standard-Biomarker beim frühen Mammakarzinom
Tabelle 1 zeigt die Standard-Biomarker, die beim frühen Mammakarzinom eingesetzt werden.
Hormonrezeptoren, Östrogenrezeptor (ER) alpha und Progesteronrezeptor (PR)
-
70–80% der Mammakarzinome sind ER-positiv, bis zu 60% sind PR-positiv.
-
Der ER ist ein starker prädiktiver Faktor für das Ansprechen auf eine endokrine Therapie und ein günstiger prognostischer Faktor.
-
Cut-off-Wert mindestens 1%
-
HR sollten bei allen neu diagnostizierten Karzinomen sowie bei metastasierten oder rezidivierenden Tumoren bestimmt werden.
Die etablierte Methodik zur Bestimmung der Hormonrezeptorexpression ist die Immunhistochemie (IHC), die den Prozentsatz der positiv gefärbten Kerne der invasiven Tumorkomponente angeben sollte. Färbeintensität wie auch der Prozentsatz positiver Zellen werden dokumentiert, ein kombinierter Score ist der Allred Score (Kombination aus dem geschätzten Anteil positiv gefärbter Tumorzellen [Score 0–5] und der Färbeintensität [0–3]).1 Der Cut-off-Wert, der anzeigt, wer von einer endokrinen Therapie profitiert, liegt bei 1% der Tumorzellkerne mit ER-Färbung. Etwa 10% der Mammakarzinome sind ER-alpha-positiv und PR-negativ. Diese Konstellation ist mit einem höheren Rezidivrisiko im Vergleich mit ER-alpha- und PR-positiven Tumoren assoziiert.2 Die ASCO-CAP-Leitlinien 2025 identifizieren eine „ER-low-positive“-Gruppe von Tumoren mit einer Positivität zwischen 1% und 10%, die sich biologisch ähnlich wie triple-negative Mammakarzinome (TNBC) verhalten.3
HER2
-
Etwa 10–15% der Mammakarzinome sind HER2-positiv.
-
Die HER2-Amplifikation ist ein prädiktiver Faktor für Anti-HER2-Therapien und ein ungünstiger prognostischer Faktor.
-
Der HER2-Status sollte bei allen neu diagnostizierten Karzinomen sowie bei metastasierten oder rezidivierenden Tumoren bestimmt werden.
Der HER2-Status wird routinemäßig mit der Kombination aus IHC zur Bestimmung der Proteinexpression und In-situ-Hybridisierung (ISH) zur Bestimmung des HER2-Genstatus ermittelt.
Ein immunhistochemischer Score von 3+ oder eine Amplifizierung des ERBB2-Gens in der ISH unabhängig vom IHC-Ergebnis ist definiert als ein positiver HER2-Status – die Voraussetzung für eine Anti-HER2-Therapie mit monoklonalen Antikörpern wie Trastuzumab +/– Pertuzumab.
Die HER2-„low“-Kategorie definiert eine Gruppe von Mammakarzinomen mit immunhistochemischem Score 1+ oder 2+ ohne Amplifikation in der ISH. Betroffene Patient:innen profitieren von Trastuzumab-Deruxtecan (T-DXd) als Zweitlinientherapie bei inoperablem oder metastasiertem Mammakarzinom.
Zwischen dem HER2-Status in Stanzbiopsien und Operationspräparaten besteht eine bis zu 99%ige Übereinstimmung. Die aktuellen Empfehlungen von ASCO-CAP schlagen vor, den HER2-Test am Operationspräparat zu wiederholen, wenn Zweifel an der Übereinstimmung mit den histopathologischen Befunden bestehen.4 Bis zu 40% der Mammakarzinome zeigen eine HER2-Heterogenität, welche mit einer schlechteren Prognose und einer geringeren Ansprechrate auf Anti-HER2-Therapien assoziiert ist.
Ki-67
-
Die Reproduzierbarkeit und der Cut-off-Wert der Bestimmung der proliferativen Aktivität des Mammakarzinoms werden kontrovers diskutiert.
-
Prognostischer Biomarker in den Gruppen <5% vs. >30% (niedrige vs. hohe Proliferation)
-
Prädiktiver Biomarker: besonders im Rahmen der neoadjuvanten endokrinen Therapie, zur Deeskalation einer adjuvanten systemischen Therapie (Chemotherapie) und in der ET mit CDK4/6i
Ki-67 ist ein nukleäres Protein, das in allen Phasen des Zellzyklus mit Ausnahme der G0-Phase vorkommt. Die Ki-67-Expression ist ein Biomarker der Zellproliferation, mit einem Highscore, welcher eine hohe Proliferationsrate anzeigt und mit einem aggressiveren Erkrankungsverlauf assoziiert ist. Die immunhistochemische Bestimmung von Ki-67 ist die am häufigsten verwendete Methode zur Bestimmung der Proliferationsaktivität des Mammakarzinoms, allerdings ist die Reproduzierbarkeit der Ergebnisse zwischen verschiedenen Laboren umstritten.5 Genauso umstritten ist die Auswahl des Cut-off-Wertes für die klinische Anwendung. Sehr niedrige (<5%, gering proliferativ) oder sehr hohe (>30%, hoch proliferativ) Werte werden als zuverlässig für die Routine angenommen. Bei Ki-67-Werten zwischen 6% und 29% können möglicherweise Genexpressionstests die Entscheidung bezüglich einer adjuvanten Therapie vereinfachen.6 Rezente Studien zeigen die Bedeutung von Ki-67, besonders bei neoadjuvanter endokriner Therapie, um Patient:innen zu identifizieren, die auf eine intensive Chemotherapie verzichten können.7
BRCA1/2-Genmutationen
Die Eskalation der Systemtherapie mit PARP-Inhibitoren kann das DFS von Patient:innen mit frühem HER2-negativem Mammakarzinom und hohem Rezidivrisiko signifikant verlängern, sofern Keimbahnmutationen in BRCA1 und BRCA2 vorhanden sind. Aufgrund entsprechender Studienergebnisse8 sollte bei Vorliegen der Kriterien für ein hohes Risiko eine genetische Testung durchgeführt werden. Kriterien für ein hohes Risiko sind:
-
Nach Operation: Tumorgröße >2cm oder mindestens ein befallener axillärer Lymphknoten bei TNBC (tripelnegativem Brustkrebs), ≥4 axilläre Lymphknoten bei Hormonrezeptor-positiver Erkrankung
-
Nach neoadjuvanter Therapie: Resttumor bei TNBC, hochgradige Resttumorerkrankung bei HR-positivem Mammakarzinom, definiert durch einen CPS + EG Score ≥3 (CPS + EG: klinisch-pathologischer Zustand + ER-Grad)
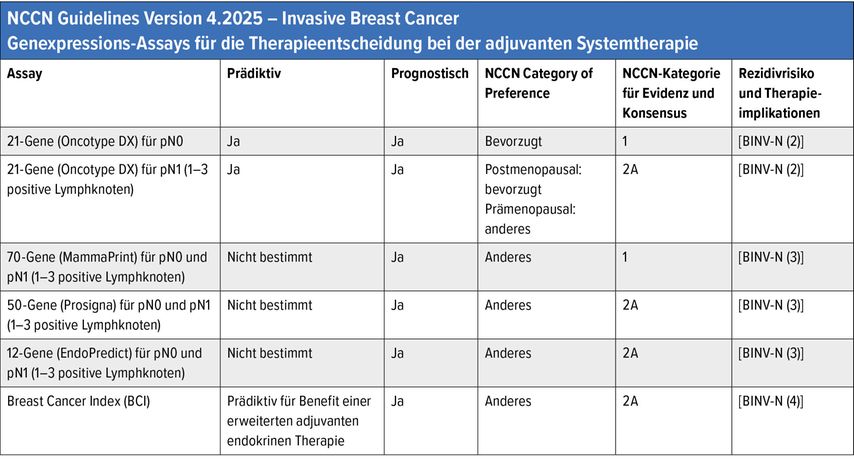
Multigenomische Tests
Multigenomische Tests (Tab.2) können hilfreich sein, um zu entscheiden, ob eine adjuvante Chemotherapie beim frühen Mammakarzinom eingesetzt werden soll. Die aktuellen NCCN-Empfehlungen bewerten den Oncotype-DX®-Test mit dem Evidenzgrad 1A als validierten prognostischen und prädiktiven Test für den Nutzen einer adjuvanten Chemotherapie bei Lymphknoten-negativem, ER-positivem, HER2-negativem frühem Mammakarzinom (prä- oder postmenopausal) sowie bei Lymphknoten-positiven postmenopausalen Fällen.
MammaPrint® besitzt Evidenzgrad 1A zur Prognose bei Lymphknoten-negativem, ER-positivem, HER2-negativem, klinisch hochrisikobehaftetem Brustkrebs und ebenfalls Evidenzgrad 1A zur Prognoseeinschätzung bei Lymphknoten-positiver Erkrankung.
Literatur:
1 Allred DC: Issues and updates: evaluating estrogen receptor-alpha, progesterone receptor, and HER2 in breast cancer. Mod Pathol 2010; 23(Suppl 2): S52-9 2 Prat A et al.: Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically defined luminal A breast cancer. J Clin Oncol 2013; 31(2): 203-9 3 Allison KH et al.: Estrogen and progesterone receptor testing in breast cancer: ASCO/CAP guideline update. JClin Oncol 2020; 38(12): 1346-66 4 Wolff AC et al.: Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update. J Clin Oncol 2018; 36(20): 2105-22 5 Fitzgibbons PL et al.: Template for reporting results of biomarker testing of specimens from patients with carcinoma of the breast. Reston, VA: College of American Pathologists; 2021. https://documents.cap.org/protocols/Breast.Bmk_1.4.1.0. REL_CAPCP.pdf 6 Thomssen C et al.: St. Gallen/Vienna 2021: a brief summary of the consensus discussion on customizing therapies for women with early breast cancer. Breast Care 2021; 16(2): 135-43 7 Kuemmel S et al.: Abstract GS4-03: neoadjuvant nab-paclitaxel weekly versus dose-dense paclitaxel followed by dose-dense EC in high risk HR+/HER2- early BC by: results from the neoadjuvant part of ADAPT HR+/HER2- trial. Cancer Res 2021; 81(4_suppl): GS4-03–GS4-03 8 Tutt ANJ et al.: Adjuvant olaparib for patients with BRCA1- or BRCA2- mutated breast cancer. N Engl J Med 2021; 384(25): 2394-405
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...