Biomarker beim Mammakarzinom: was, wann und woraus?
Autor:
Priv.-Doz. DDr. Christoph Suppan
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
LKH – Univ.-Klinikum Graz
E-Mail:
christoph.suppan@medunigraz.at
Biomarker sind der Grundbaustein für die Therapieplanung bei Patient*innen mit Mammakarzinom. Wir unterscheiden unter anderem diagnostische, prädiktive, prognostische, aber auch Response- oder Monitoring-Biomarker.1,2 Auf Basis technischer Fortschritte wie „Next-generation“-Sequenziermethoden oder Analysen aus dem peripheren Blut mittels zirkulierender Tumor-DNA (ctDNA) im Sinne einer „liquid biopsy“ konnten Therapieziele über die etablierten Standards hinaus wie Hormonrezeptor(HR)- und HER2-Status definiert werden.
Keypoints
-
Durch etablierte molekulare Biomarker und zielgerichtete Therapien nehmen die Behandlungsoptionen beim (metastasierten) Mammakarzinom stetig zu.
-
Durch Biomarker gelenkte Therapieempfehlungen außerhalb der klinischen Routine oder außerhalb evidenzbasierter Empfehlungen sollten nur im Rahmen eines interdisziplinären molekularen Tumorboards diskutiert und beschlossen werden.
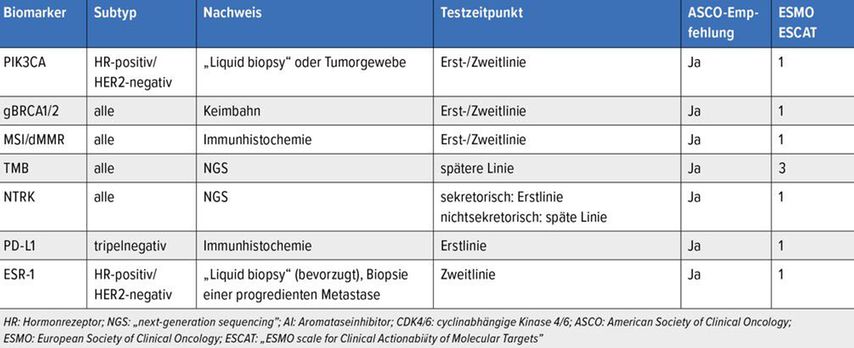
Die Europäische Gesellschaft für medizinische Onkologie (ESMO) hat 2018 Richtlinien publiziert, welche eine Klassifizierung von therapierelevanten Biomarkern ermöglichen. Mittels der „ESMO Scale for Clinical Actionability of Molecular Targets“ (ESCAT) werden prädiktive Biomarker abhängig von der wissenschaftlichen Evidenz in vier Klassen unterteilt.
Während Medikamente der Klasse ESCAT1 bereits eine Lebenszeitverlängerung zeigten, konnten Vertreter der Klasse ESCAT4 lediglich präklinisch Hinweise auf eine Wirksamkeit liefern.3,4 Die American Society of Clinical Oncology (ASCO) hat ebenfalls Empfehlungen zur Biomarkertestung publiziert, welche regelmäßig aktualisiert werden.5 Die wichtigsten Empfehlungen werden in Tabelle 1 zusammengefasst.
Im Folgenden werden relevante genetische Alterationen besprochen.
PIK3CA-Mutation
Die aktivierende PIK3CA-Mutation tritt bei ungefähr 40% aller Patient*innen mit einem HR-positiven, HER-2-negativen Mammakarzinom auf. Mit der Entwicklung des PI3K-Inhibitors Alpelisib konnte in der Phase-III-Studie SOLAR-1 in Kombination mit Fulvestrant eine Verlängerung des progressionsfreien Überlebens gegenüber Fulvestrant als Monotherapie gezeigt werden.6
BRCA1/2-Keimbahnmutation
Keimbahnmutationen im BRCA1/2-Gen stellen die häufigste Ursache für das erbliche Mammakarzinom dar. Durch die Blockierung des Enzyms PARP, das für die Reparatur von Einzelstrangbrüchen verantwortlich ist, wird die Tumorzelle in die Apoptose geführt. Die Entwicklung der beiden PARP-Inhibitoren Olaparib und Talazoparib führte zur Etablierung einer zielgerichteten Behandlung für diese Patient*innenpopulation.7–9
MSI/dMMR
Der Nachweis der Mikrosatelliteninstabilität (MSI) oder des Defekts der homologen DNS-Reparatur (dMMR = „mismatch repair deficiency“) ist ein Beispiel für einen tumoragnostischen Therapieansatz. Als Vorhersageparameter für das Ansprechen auf eine Therapie mit einem Immuncheckpoint-Inhibitor ist die Testung bei unterschiedlichen soliden Tumoren etabliert.10
TMB
Die Tumorlast („tumor mutational burden“, TMB) errechnet sich aus der Anzahl der somatischen Mutationen im kodierenden Bereich des Tumorgenoms und wird üblicherweise in der Einheit „Mutationen pro Megabasen“ angegeben. Neuere Daten legen nahe, dass eine hohe TMB nur bei jenen Tumorentitäten mit einem höheren Therapieansprechen von Immuncheckpoint-Inhibitoren assoziiert ist, bei denen er mit der CD8-T-Lymphozyten-Infiltration korreliert. Beim Mammakarzinom ist dies nicht der Fall, somit ist die Datenlage noch nicht eindeutig.11,12
NTRK-Genfusionen
Hierbei handelt es sich um seltene genetische Alteration, für die ebenfalls eine tumorentitätsübergreifende, zielgerichtete Therapie entwickelt wurde. Das Vorkommen beim Mammakarzinom ist zwar mit <1% sehr selten, stellt aber aufgrund der hohen Effizienz von NTRK-Inhibitoren wie etwa Larotrectinib oder Entrectinib ein wichtiges Therapieziel dar.13–15
PD-L1
Aufgrund der Zulassung zweier Immuncheckpoint-Inhibitoren in Kombination mit Chemotherapie als Erstlinientheapie beim tripelnegativen Mammakarzinom ist die Testung mit den zwei etablierten Assays unmittelbar vor Therapieeinleitung empfohlen.16,17
ESR1
Das Auftreten einer ESR1-Mutation ist unter anderem mit einer endokrinen Resistenz vergesellschaftet und wird häufig bei Vorbehandlung mit einem Aromataseinhibitor (AI) beobachtet.18 Auf Basis der Phase-III-Studie EMERALD wurde in den USA im Jänner 2023 der selektive orale Östrogenrezeptor-Degrader (SERD) Elacestrant für Patient*innen mit einem HR-positiven, HER2-negativen, ESR1-mutierten metastasierten Mammakarzinom zugelassen.19
Aufgrund dessen wurde im Mai 2023 seitens der ASCO ein Update mit der Empfehlung zur ESR1-Testung zum Zeitpunkt des Progresses publiziert. Wegen der höheren Sensitivität sollte eine Flüssigbiopsie bevorzugt werden, alternativ könnte die Testung auch an einer aktuellen Metastasenbiopsie in Erwägung gezogen werden. Das Gewebe aus dem Primärtumor eignet sich hierfür nicht, da die Mutation typischerweise durch den Selektionsdruck während der Tumorbehandlung auftritt.20
Die Studie SAFIR02-BREAST
Hier wurde bei 1462 Patient*innen mit metastasiertem Mammakarzinom ohne HER2-Überexpression eine umfassende Genomsequenzierung durchgeführt. Ziel war es, die Wirksamkeit einer zielgerichteten Therapie mit der einer Erhaltungschemotherapie zu vergleichen. Insgesamt wurden 238 Patient*innen randomisiert.
Durch die zielgerichtete Therapie konnte das PFS in der Subgruppe jener Patient*innen signifikant verlängert werden, die eine zielgerichtete Therapie basierend auf ESCAT-1- oder ESCAT-2-Alterationen erhielten. Patient*innen mit ESCAT-3- oder ESCAT-4-Alterationen hatten keinen signifikanten PFS-Vorteil.21
Literatur:
1 Group F-NBW. BEST (Biomarkers, EndpointS, and other Tools) Resource. Silver Spring (MD) Bethesda (MD): Food and Drug Administration (US), National Institutes of Health (US); 2016 2 Califf RM: Biomarker definitions and their applications. Exp Biol Med (Maywood) 2018; 243(3): 213-21 3 Mateo J et al.: A framework to rank genomic alterations as targets for cancer precision medicine: the ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). Ann Oncol 2018; 29(9): 1895-902 4 Condorelli R et al.: Genomic alterations in breast cancer: level of evidence for actionability according to ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). Ann Oncol 2019; 30(3): 365-73 5 Henry NL et al.: Biomarkers for systemic therapy in metastatic breast cancer: ASCO Guideline Update. J Clin Oncol 2022; 40(27): 3205-21 6 André F et al.: Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med 2019; 380(20): 1929-40 7 Lord CJ, Ashworth A: PARP inhibitors: synthetic lethality in the clinic. Science 2017; 355(6330): 1152-8 8 Robson M et al.: Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med. 2017; 377(6): 523-33 9 Litton JK et al.: Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N Engl J Med 2018; 379(8): 753-63 10 Le DT et al.: PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372(26): 2509-20 11 Marabelle A et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol 2020; 21(10): 1353-65 12 McGrail DJ et al.: High tumor mutation burden fails to predict immune checkpoint blockade response across all cancer types. Ann Oncol 2021; 32(5): 661-72 13 Doebele RC et al.: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21(2): 271-82 14 Hong DS et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 2020; 21(4): 531-40 15 Solomon JP et al.: Identifying patients with NTRK fusion cancer. Ann Oncol 2019; 30(Suppl_8): viii16-viii22 16 Schmid P et al.: Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med 2018; 379(22): 2108-21 17 Cortes J et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265): 1817-28 18 Fribbens C et al.: Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast cancer. J Clin Oncol 2016; 34(25): 2961-8 19 Bidard FC et al.: Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: results from the randomized phase III EMERALD trial. J Clin Oncol 2022; 40(28): 3246-56 20 Burstein HJ et al.: Testing for ESR1 mutations to guide therapy for hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer: ASCO Guideline Rapid Recommendation Update. J Clin Oncol 2023: Jco2300638 21 Andre F et al.: Genomics to select treatment for patients with metastatic breast cancer. Nature 2022; 610(7931): 343-8
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...