Biomarker im Fokus
Bericht: Dr. Corina Ringsell
Die modernen Krebstherapien erlauben ein immer individuelleres Krankheitsmanagement. Voraussetzung dafür ist jedoch, jene Patienten zu identifizieren, die von den Medikamenten profitieren. Daher wird intensiv an Biomarkern geforscht, die ein Therapieansprechen vorhersagen können. Beim virtuellen AACR-Meeting wurden aktuelle Daten dazu vorgestellt.
KEYNOTE-048: Subgruppenanalyse
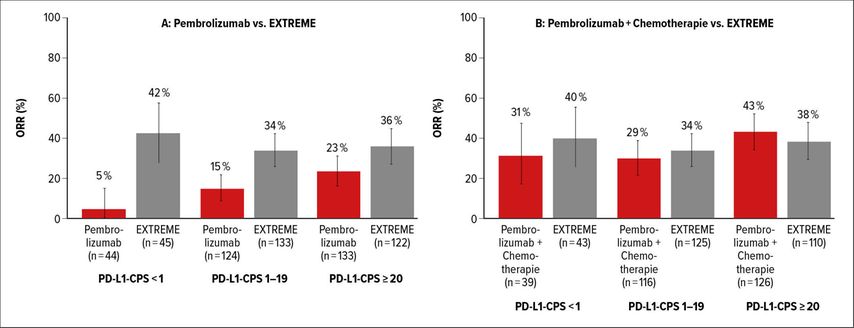
Der kombinierte positive Score (CPS) errechnet sich aus der PD-L1-Expression auf dem Tumor und den T-Zellen. Er ist ein prädiktiver Biomarker für das Ansprechen auf PD-1/PD-L1-Inhibitoren wie Pembrolizumab.1 Die Phase-III-Studie KEYNOTE-048 zeigte, dass Pembrolizumab (Pembro) als Erstlinientherapie bei rezidivierten/metastasierten Kopf-Hals-Tumoren (r/m HNSCC) dem EXTREME-Regime (Chemotherapie+Cetuximab) überlegen ist: Pembro verlängerte im Vergleich zu EXTREME das Gesamtüberleben (OS) bei Patienten mit einem PD-L1-CPS ≥20 und ≥1. In der Gesamtpopulation war es hinsichtlich des OS EXTREME nicht unterlegen, wies aber das günstigere Sicherheitsprofil auf. Die Erstlinientherapie mit Pembro plus Chemotherapie (C) ging im Vergleich zu EXTREME bei allen drei Studienpopulationen mit einem überlegenen OS einher.2
In diesem Jahr wurde die Post-hoc-Analyse der Subgruppen mit CPS <1 und CPS 1–19 im Vergleich zu CPS ≥20 präsentiert. Es wurde deutlich, dass die Wirksamkeit von Pembro und Pembro+C mit steigender PD-L1-Expression zunahm (Abb. 1). In der Subgruppe CPS 1–19 waren die OS-Ergebnisse von Pembro+C konsistent mit dem Therapiebenefit. Die Auswertung der Gruppe mit CPS <1 war wegen der geringen Patientenzahl eingeschränkt. Die Autoren empfahlen weitere Analysen, um Marker zu finden, die HNSCC-Patienten mit geringer PD-L1-Expression identifizieren, die dennoch von dem Checkpoint-Inhibitor profitieren könnten, zum Beispiel die Tumormutationslast (TMB).3
Tumormutationslast beeinflusst Therapieoutcome
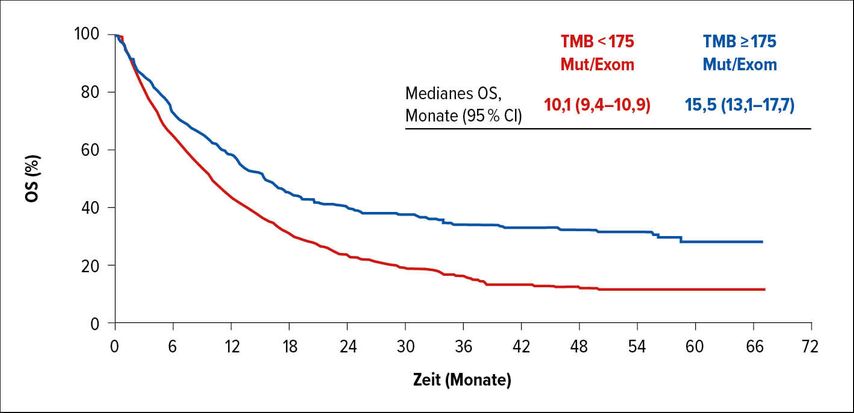
Der Zusammenhang der TMB mit dem Therapieansprechen auf Pembro war Thema der retrospektiven Analyse von Razvan Cristescu und Kollegen. Ausgewertet wurden 12 Studien mit Pembro als Monotherapie bei Patienten mit soliden Tumoren (KEYNOTE-001, 002, 010, 012, 028, 045, 055, 059, 061, 086, 100, 199). Evaluiert wurden objektive Ansprechrate (ORR), Ansprechdauer (DOR), progressionsfreies Überleben (PFS) und Gesamtüberleben (OS). Die TMB wurde mittels „whole-exome sequencing“ (WES) ermittelt. Als TMB-Schwellenwert wurden 175 Mutationen/Exom definiert.4
Insgesamt konnte die TMB bei 2234 Patienten mit 24 Tumortypen bestimmt werden, davon waren 1772 mit Pembro behandelt worden. Von diesen wiesen 433 eine TMB ≥175 Mut/Exom, 1339 eine TMB <175 Mut/Exom auf. Die gepoolten Ergebnisse zeigten eine klinisch relevante höhere Wirksamkeit von Pembro bei TMB ≥175 Mut/Exom, unabhängig vom PD-L1-Status und von der Tumorentität. Die ORR betrug 31,4% (≥175 Mut/Exom) vs. 9,5% (<175 Mut/Exom), p≤0,016. Die mediane DOR wurde bei TMB ≥175 Mut/Exom nicht erreicht (vs. 12,5 Mon.). Eine höhere TMB ging ebenfalls mit einer besseren Wirksamkeit von Pembro hinsichtlich PFS (4,2 vs. 2,1 Mon.; p≤0,005) und OS (15,5 vs. 10,1 Mon.; p≤0,029; Abb. 2) einher.4
Biomarker beim fortgeschrittenen Mammakarzinom
PIK3CA-Mutationen werden für die Resistenz von fortgeschrittenen HER2-positiven Mammakarzinomen gegenüber einer endokrinen Therapie verantwortlich gemacht.5
MONARCH-2
Die Zugabe des CDK-4/6-Inhibitors Abemaciclib zu dem Östrogenantagonisten Fulvestrant konnte in der MONARCH-2-Studie die Resistenz überwinden. Dies resultierte im Vergleich zu Fulvestrant plus Placebo in einem klinisch relevanten und statistisch signifikanten Überlebensvorteil von 9,4 Monaten (p=0,01).6 Auch das PFS war unter der Kombination länger als im Vergleichsarm, unabhängig vom PIK3CA-Mutationsstatus, aber mit einem numerisch größeren Vorteil bei Mutationsträgerinnen.7
In diesem Jahr wurden die Daten zum OS, zum chemotherapiefreien Überleben (CFS) und zur Zeitspanne bis zum Beginn einer Chemotherapie (TTC) bei Patienten mit und ohne PIK3CA-Mutation präsentiert. Der PIK3CA-Status lag bei 238 der 669 Patientinnen der MONARCH-2-Kohorte vor. Abemaciclib plus Fulvestrant erzielten gegenüber Placebo einen vergleichbaren OS-Vorteil bei Patientinnen mit PIK3CA-Mutation und -Wildtyp. TTC und CFS verlängerten sich in beiden Subgruppen ebenfalls durch die Zugabe von Abemaciclib. Ein statistisch signifikanter Unterschied zwischen Patientinnen mit PIK3CA-Mutation und -Wildtyp konnte nicht festgestellt werden, was laut den Autoren an der geringen Patientenzahl liegen könnte. Sie empfehlen daher weitere, ausreichend gepowerte prospektive Studien.8
NeoALTTO
Mattia Rediti und Kollegen untersuchten die Rolle von T- und B-Zell-Rezeptor(TCR, BCR)-Repertoires bei Rezidiven des HER2-positiven Mammakarzinoms. Hintergrund ist, dass viele Patientinnen mit HER2-positiven Mammakarzinomen Rezidive erleiden, nicht nur bei Resterkrankung (RD) nach neoadjuvanter Therapie, sondern auch bei pathologischer Komplettremission (pCR). Für die Wirksamkeit der eingesetzten Medikamente spielt die körpereigene Immunabwehr eine Schlüsselrolle. Die Wissenschaftler analysierten Daten der NeoALTTO-Studie. Hier waren von 254 der 455 Studienteilnehmerinnen Daten der ursprünglichen RNA-Sequenzierung (RNAseq) ihrer Tumorbiopsien vorhanden. 166 dieser Patientinnen erreichten keine pCR, definiert als ypT0/is. Gematchte RNAseq-Daten von RD-Proben lagen von 43 Patientinnen vor. Aus den RNAseq-Daten wurden die TCR/BCR-Repertoires extrahiert.9
Gleichmäßig verteilte BCR waren mit einem kürzeren eventfreien Überleben (EFS) verbunden. Ein Modell, das BCR-Gleichverteilung, stromale tumorinfiltrierende Lymphozyten (sTIL), pCR-/RD-Status und Östrogenrezeptorstatus einbezieht, kann Patientinnen mit guter, intermediärer und schlechter Prognose (5-Jahres-EFS-Raten 95%, 80% bzw. 58%) identifizieren – unabhängig davon, ob sie eine RD oder pCR aufweisen. Die weitere Evaluierung sei empfehlenswert, schließen die Autoren.9
Genexpressionssignatur als prädiktiver Marker bei Melanom
In der Therapie des fortgeschrittenen malignen Melanoms (Stadium III) wird inzwischen routinemäßig im Anschluss an die Tumorresektion eine systemische adjuvante Therapie verabreicht. Es fehlen jedoch Biomarker, um Patienten mit einem hohen Risiko für eine Metastasierung zu identifizieren und allen anderen potenziell irreversible Nebenwirkungen zu ersparen.
Um diese Lücke zu schließen, analysierten britische Wissenschaftler 194-RNA-Sequenzen von Stadium-IIB–IIIC-Melanomen. Sie stammten von Patienten, die an der AVAST-M-Studie teilgenommen hatten. 89 dieser Patienten hatten Fernmetastasen entwickelt, 105 hatten keine Metastasen. Die Forscher fanden Gene, die mit einer Metastasierung assoziiert waren, von diesen wurden 121 extern validiert und zur prädiktiven Gensignatur „Cam_121“ zusammengefasst. Mithilfe verschiedener selbstlernender Modelle wurde der prädiktive Wert der Signatur getestet. Zudem wurde das Melanom-spezifische Überleben (MSS) in einer externen, unabhängigen Kohortenstudie mit 687 Teilnehmern validiert.10
Die Gensignatur konnte Patienten mit und ohne Fernmetastasen mit einer Sensitivität von 0,64, einer Spezifität von 0,79 und einer Genauigkeit von 0,72 unterscheiden. Die Signatur korrelierte zudem mit dem PFS, dem OS und dem MSS. Der mediane Signatur-Expressions-Score korrelierte außerdem positiv mit Messungen von infiltrierenden Immunzellen, wobei ein niedrigerer Score mit einer geringeren Lymphozyteninfiltration und in der Folge mit einer schlechteren Langzeitprognose verbunden war. Cam_121 war anderen derzeit verfügbaren prädiktiven Signaturen überlegen.10
Updates und Post-hoc-Analysen
Zu einigen Studien wurden Updates und Post-hoc-Analysen präsentiert, unter anderem zur Studie CheckMate221, Part1, mit Nivolumab (Nivo) plus Ipilimumab (Ipi) bei fortgeschrittenem nichtkleinzelligem Lungenkarzinom (NSCLC).
CheckMate221, Part 1
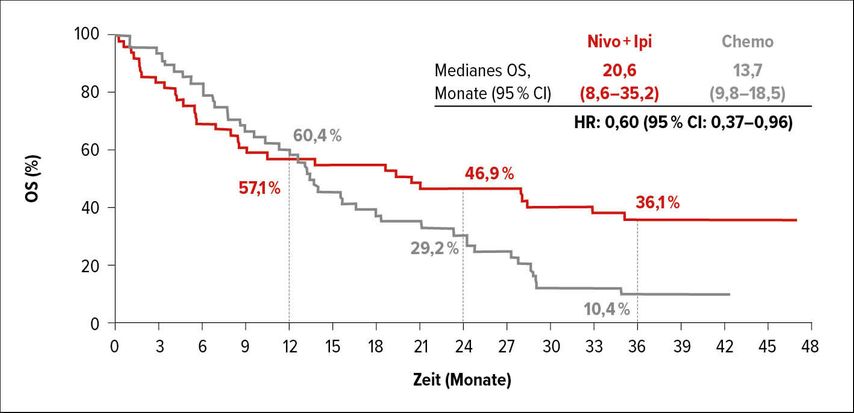
Die Kombination Nivo+Ipi hatte im Vergleich zur Chemotherapie bei Patienten mit einer PD-L1-Expression ≥1% das OS gesteigert, in geringerem Maß auch bei Patienten mit einer PD-L1-Expression <1%.11,12 In diesem Jahr wurde eine Post-hoc-Analyse vorgestellt. Untersucht wurden Wirksamkeit und Sicherheit von Nivo+Ipi bei NSCLC-Patienten mit und ohne Hirnmetastasen zum Zeitpunkt der Diagnose.13Etwa 8% der NSCLC-Patienten haben bei der Diagnosebereits Hirnmetastasen, was ihre Prognoseverschlechtert.14,15
Nivo+Ipi war der Chemotherapie hinsichtlich des OS überlegen, und dies sowohl bei Patienten mit (HR 0,60) wie auch bei jenen ohne Hirnmetastasen (HR 0,77). Besonders profitierten Patienten mit Hirnmetastasen und einer PD-L1-Expression ≥1% von Nivo+Ipi (Abb. 3). Auch PFS, ORR und DOR fielen zugunsten von Nivo+Ipi aus und waren bei Patienten mit und ohne Hirnmetastasen vergleichbar. So lagen die 3-Jahres-OS-Raten in beiden Populationen über 30%. Das Sicherheitsprofil entsprach dabei dem der vorangegangenen Auswertungen.13
Abb. 3: Wirksamkeit von Nivolumab + Ipilimumab vs. Chemotherapie bei NSCLC-Patienten mit Hirnmetastasen13
IMpower 133
Ein Update zum OS und explorative Analysen gab es auch zur Studie IMpower 133. Sie war konzipiert, um den Bedarf für eine wirksame Erstlinientherapie des fortgeschrittenen, metastasierten kleinzelligen Lungenkarzinoms (SCLC) zu decken. Zum Zeitpunkt der Diagnose befindet sich das SCLC in vielen Fällen bereits im fortgeschrittenen Stadium („extensive stage“, ES) mit 5-Jahres-Überlebensraten von unter 7%.16 Der Therapiestandard des ES-SCLC war bislang eine platinbasierte Chemotherapie, die zwar initial hohe Ansprechraten erzielt, aber lediglich zu einem medianen Überleben von 10 Monaten führt.17 In der Studie IMpower 133 war der PD-L1-Inhibitor Atezolizumab (Atezo) in Kombination mit Carboplatin und Etoposid (CP/ET) gegen Placebo+CP/ET bei ES-SCLC getestet worden. Bei einer Nachbeobachtungszeit von fast 14 Monaten hatte die Kombination mit Atezo OS und PFS signifikant verlängert.18 Nun wurde ein Update der OS-Daten nach einem zusätzlichen Follow-up von neun Monaten vorgestellt. Atezo+CP/ET war der Chemotherapie nach wie vor überlegen: Das OS betrug im Atezo-Arm 12,3 Monate (vs. 10,3 Mon.; HR: 0,76). Von den Patienten im Atezo-Arm waren zu Monat 18 rund 13% mehr am Leben als im Vergleichsarm (34 vs. 21%). In einer explorativen Analyse wurde das OS in Verbindung mit der PD-L1-Expression und der TMB untersucht. Dabei zeigte sich, dass beide nicht prädiktiv für den Therapieerfolg sind und daher nicht zur Patientenselektion eingesetzt werden sollten.19
Tumor Treating Fields (TTFields)
TTFields sind antimitotische alternierende elektrische Felder mit niedriger Intensität und mittlerer Frequenz, die in die Zellteilung von Glioblastomen eingreifen. Sie werden mithilfe eines tragbaren Gerätes nichtinvasiv appliziert. In der Phase-III-Studie EF-14 wurden TTFields bei Glioblastompatienten nach Resektion oder Biopsie des Tumors und begleitender Radiochemotherapie als Erhaltungstherapie in Verbindung mit Temozolomid-Chemotherapie eingesetzt und gegen Temozolomid-Monotherapie getestet. Sie verlängerten OS und PFS signifikant: Das OS im TTFields-Arm lag bei 20,9 Monaten (vs. 16 Mon.; p<0,001), das PFS betrug 6,7 vs. 4 Monate (p<0,001).20
Beim AACR wurden die Resultate einer Subgruppenanalyse der EF-14-Studie mit Patienten über 65 Jahre gezeigt. Hintergrund war, dass ältere Patienten in der Regel eine schlechtere Prognose haben und oft nicht die komplette Therapie erhalten können. In die Auswertung eingeschlossen waren alle 134 Patienten der EF-14-Studie über 65 Jahre (65–83 J.). Verglichen wurden die beiden Studienarme wieder hinsichtlich OS, PFS und unerwünschter Wirkungen. Die zusätzliche Anwendung von TTFields verlängerte auch bei dieser Patientengruppe im Vergleich zur Chemotherapie alleine OS und PFS. Das mediane PFS lag in der TTFields-Gruppe bei 6,5 Monaten (vs. 3,9 Mon.; p<0,02), das OS bei 17,4 Monaten (vs. 13,7 Mon.; p<0,02). Es zeigte sich zudem ein Unterschied zwischen Patienten, die TTFields mindestens 18 Stunden täglich anwandten, und solchen, die es weniger als 18 Stunden einsetzten. Patienten mit hoher Compliance erreichten ein medianes OS von 21,3 Monaten (vs. 12,5 Mon.; p=0,007) und ein PFS von 7,8 Monaten (vs. 5,3 Mon.; p=0,07). Die 3-Jahres-OS-Rate war in der Gruppe mit hoher Compliance fast doppelt so hoch wie in der Gruppe mit geringerer Compliance (21,1% vs. 12,3%; p=0,06). Die Autoren schlossen aus diesen Ergebnissen, dass die zusätzliche Anwendung von TTFields eine wirksame und sichere Therapie für ältere Glioblastompatienten ist.21
Quelle:
AACR Virtual Meeting II, 22.–24. Juni 2020
Literatur:
1 Cohen EEW et al.: J Immunother Cancer 2019; 7: 184 2 Burtness B et al.: Lancet 2019; 394:1915-28 3 Burtness B et al.: AACR 2020, Abstr. LB258 4 Cristescu R et al.: AACR 2020, Abstr. LB261 5 Araki K, Miyoshi Y: Breast Cancer 2018; 25: 392-401 6 Sledge GW et al.: JAMA Oncology 2019; 6: 116-24 7 Tolaney SM et al.: Cancer Res 2019; 79(13 Suppl ): Abstr. 4458 8 Tolaney SM et al.: AACR 2020, Abstr. 766 9 Rediti M et al.: AACR 2020, Abstr. 1998 10 Garg M et al.: AACR 2020, Abstr. LB-274 11 Hellmann MD et al.: N Engl J Med 2018; 378: 2093-104 12 Hellmann MD et al.: N Engl J Med 2019; 381: 2020-31 13 Borghaei H et al.: AACR 2020, Abstr. CT221 14 Waqar SN et al.: Am J Clin Oncol 2018; 41: 36-40 15 Sperduto PW et al.: JAMA Oncol 2017; 3: 827-31 16 Bernhardt EB, Jalal SI: Cancer Treat Rep 2016; 170: 301-22 17 Foster NR et al.: J Thorac Oncol 2015; 10: 1099-106 18 Horn L et al.: N Engl J Med 2018; 379: 2220-9 19 Horn L et al.: AACR 2020, Abstr. CT220 20 Stupp R et al.: JAMA 2017; 318: 2306-16 21 Ram Z, Zhu JJ: AACR 2020, Abstr. CT219
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...