Berichte aus den CCC-Tumorboards: Niere, Mamma, Pankreas
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Rahmen einer Kooperation von JATROS Hämatologie & Onkologie mit dem Comprehensive Cancer Center (CCC) Vienna stellen Ihnen Expert:innen in loser Folge interessante Fälle aus den CCC-Tumorboards vor. In dieser Ausgabe geht es um ein Nierenzell-, ein Mamma- und ein Pankreaskarzinom.
Nierenzellkarzinom
Patientin, 70 Jahre bei Diagnosestellung
Onkologische Anamnese
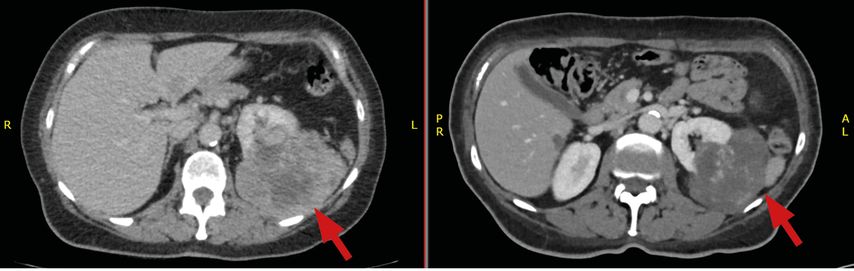
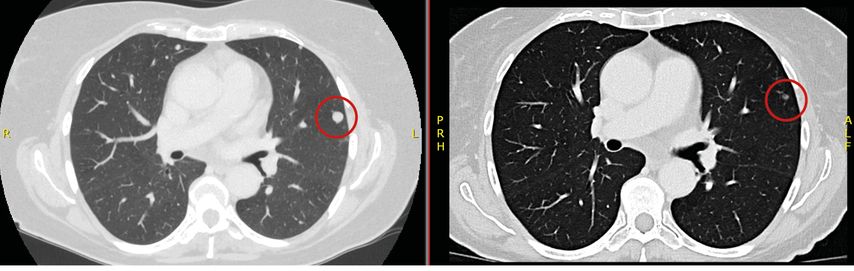
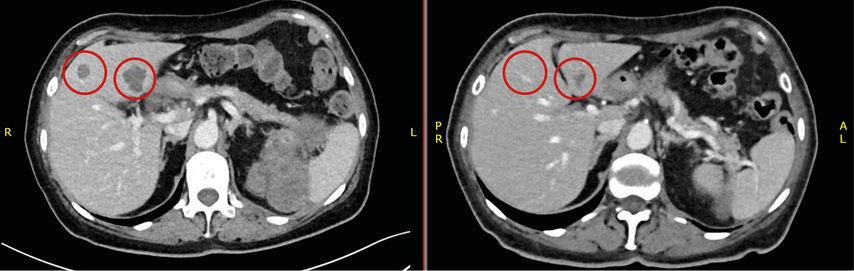
Die Patientin präsentiert sich Mitte März 2023 auf einer chirurgischen Abteilung wegen einer seit acht Wochen bestehenden Übelkeit sowie Gewichtsverlust von 20kg; Schmerzen bestanden zu keinem Zeitpunkt. In einer Computertomografie zeigen sich ein großer Nierentumor links, multiple Rundherde in der Lunge sowie drei Metastasen-verdächtige Läsionen in der Leber (Abb. 1–3, links). Ende März 2023 wird eine Biopsie des Nierentumors vorgenommen.
Die Patientin weist folgende Begleitmorbiditäten auf: medikamentös gut eingestellte arterielle Hypertonie, sonst keine weiteren Vorerkrankungen.
Histologie der Nierenbiopsie
Fragmentiertes Tumorgewebe aus klarzelligen Tumorzellen; zwischen den Tumorformationen zarte Kapillargefäße. „International Society of Urologic Pathology“ (ISUP)-Klassifikation 1. Immunhistochemisch Carboanhydrase IX (CA IX) membranös positiv.
Diagnose
Klarzelliges Nierenzellkarzinom, ISUP 1
Die Patientin wird zur weiteren Behandlung an die Universitätsklinik für Urologie (Nierenzellkarzinom-Ambulanz), Wien überwiesen. In einem nächsten Schritt wird der Risiko-Score nach den Kriterien des International Metastatic RCC Database Consortium (IMDC) erhoben.1 Dieser erlaubt eine Einschätzung über die Prognose im metastasierten Stadium. Der Score umfasst sechs Faktoren: Neutrophilie, Anämie, Thrombozytose, erhöhtes, korrigiertes Kalzium, Intervall zwischen Primum und Metastasen (<1Jahr) und Karnovsky-Performance-Status (KPS, <80).
Die Patientin hat vier Risikofaktoren: synchrone Metastasierung, Thrombozytose, Anämie und KPS<80; sie wird somit als „poor risk“ eingestuft.
Im interdisziplinären Tumorboard (TB) werden folgende Optionen besprochen und beschlossen:
-
Operation des Primärtumors
-
ergänzende Lokaltherapie
-
Art der medikamentösen Therapie
Operation des Primärtumors
Das TB kommt hierbei zu folgender Erkenntnis: Da die Patientin einen ungünstigen IMDC-Risikoscore hat, ist ein primär chirurgisches Vorgehen, also eine zytoreduktive Therapie, als Erstmaßnahme nicht indiziert, zumal vonseiten des Primärtumors keine lokalen Probleme wie Blutung oder erhebliche Schmerzen ausgehen.
Begründung: Die CARMENA-Studie hat sich dieser Frage in einem randomisierten Phase-III-Setting genähert.2 In dieser Studie war bei Patient:innen mit intermediärem oder ungünstigem IMDC-Score eine medikamentöse Therapie ohne Nephrektomie der zytoreduktiven Nephrektomie, gefolgt von medikamentöser Therapie, nicht unterlegen. Seither ist die zytoreduktive Therapie nicht mehr die erste Standardmaßnahme in diesem Setting.
Ergänzende Lokaltherapie
Das TB kommt zu dem Schluss, dass die Patientin bei zwei Metastasen-Lokalisationen mit jeweils multiplen Metastasen keinen Benefit von einer ergänzenden Lokaltherapie (Embolisierung, Radiofrequenzablation, stereotaktische Bestrahlung) hätte. Dies könne bei ausgezeichnetem Ansprechen auf eine systemische Therapie aber eventuell zum Management von „residual disease“ reevaluiert werden.
Systemische Therapie
Das TB beschließt die rasche Einleitung einer medikamentösen Tumortherapie. Bei Patient:innen mit IMDC „poor risk“ stehen vier verschiedene Kombinationen von Immuncheckpoint-Inhibitoren (ICI) zur Verfügung:
-
Nivolumab + der CTLA4-ICI Ipilimumab
-
Pembrolizumab + der Tyrosinkinase-Inhibitor (TKI) Axitinib
-
Pembrolizumab + der TKI Lenvatinib
-
Nivolumab + der TKI Cabozantinib
Rationale für Therapieauswahl
Die duale Immuncheckpoint-Inhibition mit Nivolumab+Ipilimumab ist bei Patient:innen mit Zeichen einer myeloischen Inflammation (Thrombozytose, Neutrophilie, CRP) nicht ideal, da hier durch Interleukin 6 „myeloid-derived suppressor cells“ (MDSCs) getriggert werden, die das Ansprechen auf reine ICI-Therapie erschweren. Hingegen kann die Kombination mit einem TKI günstig sein, da diese Medikamente die Immunogenität des „Tumor-Microenvironments“ verbessern, indem sie MDSC und regulatorische T-Zellen reduzieren und CD8-Zellen aktivieren.3 Eine mögliche Therapievariante ist Pembrolizumab+Axitinib. Jedoch zeigt diese Strategie in einer Phase-III-Studie mit 15% primärer Progressionsrate bei Patient:innen mit intermediärem oder ungünstigem Score ein deutlich höheres Risiko als die anderen beiden Kombinationen. Da die hier beschriebene Patientin eine symptomatische Erkrankung hat, ist eine höhere Verlässlichkeit in Bezug auf sofortige Wirkung gewünscht.
Die hochwirksame Kombination Pembrolizumab+Lenvatinib ist prinzipiell eine gute Option. Die primäre Progressionsrate in der „Intention to treat“-Population liegt bei 5,4%, doch es liegen keine Daten zur Subgruppe der Patient:innen mit „poor risk“ vor. Zudem wird von der Onkologin angemerkt, dass (aus persönlicher klinischer Erfahrung) die Einhaltung einer hohen Lenvatinib-Dosis bei dieser Patientin wegen bereits ausgeprägter Nausea und Vomitus limitierend sein könnte. Zudem gibt es Phase-II-Daten über die Wirksamkeit dieser Kombination nach Versagen einer Erstlinien-Immunkombination.
Die Kombination Nivolumab+Cabozantinib hat bei Patient:innen mit IMDC-„poor risk“-Profil eine hohe Wirksamkeit; die primäre Progression liegt bei nur 6%. Nausea und Vomitus sind im klinischen Alltag seltener. Diarrhö kann limitierend werden, jedoch gibt es zahlreiche prophylaktische Maßnahmen dagegen.
Therapieverlauf
Die Patientin beginnt im April 2023 die Kombinationstherapie mit Nivolumab+Cabozantinib. Darunter verbessern sich innerhalb weniger Wochen der Allgemeinzustand und der Appetit; die Patientin nimmt wieder an Gewicht zu. Nebenwirkungen sind eine Diarrhö Grad 1 und Hypertonie Grad 2. Es kommt zu einer ausgeprägten partiellen Remission der Metastasen (Abb.2–3, rechts), zur Reduktion des Primärtumors (Abb.1, rechts) sowie zur spontanen Normalisierung der Thrombozyten und des Hämoglobins. Nach IMDC-Kriterien ist die Patientin nun nicht mehr als „poor risk“ einzustufen, sondern als „intermediate risk“ mit lediglich einem verbleibenden Faktor (Zeit Primum bis Diagnose Metastasen).
Ausblick und weiterer Verlauf
Mittelfristig ist eine Wiedervorstellung im Tumorboard mit der neuerlichen Fragestellung einer zytoreduktiven Nephrektomie vorgesehen. Der Hintergrund ist, dass bereits in der CARMENA-Studie gezeigt wurde, dass Patient:innen mit einer verzögerten Nephrektomie von allen Subpopulationen das längste Überleben hatten. Das ist natürlich auch eine positive Selektion, da nur „Responder“ einer Operation zugeführt wurden. Die ASCO-Guidelines empfehlen bei nur einem IMDC-Risikofaktor (wie nun hier vorliegend) die zytoreduktive Nephrektomie, wenn damit ein signifikanter Teil des Tumorgeschehens entfernt werden kann (wie bei unserer Patientin in Partialremission).4
Autorin:
Ao. Univ.-Prof. Dr. Manuela Schmidinger
FÄ für Innere Medizin, Onkologie und Intensivmedizin
Universitätsklinik für Urologie
Medizinische Universität Wien
E-Mail:
manuela.schmidinger@meduniwien.ac.at
Literatur:
1 Heng DYC et al.: External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: apopulation-based study. Lancet Oncol 2013; 14(2): 141-8 2 Méjean A et al.: Sunitinib alone or after nephrectomy in metastatic renal-cell carcinoma. N Engl J Med 2018; 379(5): 417-27 3 Draghiciu O et al.: Myeloid derived suppressor cells - an overview of combat strategies to increase immunotherapy efficacy. Oncoimmunology 2015; 4(1): e954829 4 Rathmell WK et al.: Management of metastatic clear cell renal cell carcinoma: ASCO Guideline. J Clin Oncol 2022; 40(25): 2957-95
Hormonrezeptorpositives Mammakarzinom
Patientin, 57 Jahre bei Diagnosestellung
Onkologische Anamnese
Eine 57-jährige postmenopausale Patientin, 166cm groß, Gewicht 82kg, tastete 2020 selbst erstmals eine Verhärtung im Bereich der rechten Mamille. Es erfolgten zweimalig Mammografie und Sonografie mit unauffälligem Befund, zuletzt im Mai 2023 BIRADS 2; aufgrund Persistenz seitens der Patientin wurde letztlich eine Biopsie durch die niedergelassene Dermatologin durchgeführt.
Die rechte Mamille war gerötet und verdickt, Brust und Axilla beidseits sonst palpatorisch unauffällig. Die Biopsie auswärts der Mamma rechts am 11. September 2023 ergab ein invasives NST(„no special type“)-Karzinom (duct.) G?, Östrogenrezeptor (ER) 70%, Progesteronrezeptor (PR) 100%.
An Begleiterkrankungen besteht eine arterielle Hypertonie, die mit Candesartan gut eingestellt ist. Die Familienanamnese ergab, dass eine Tante väterlicherseits mit 80 Jahren ein Mammakarzinom hatte. Eine genetische Beratung wurde nicht empfohlen.
Weitere Abklärung
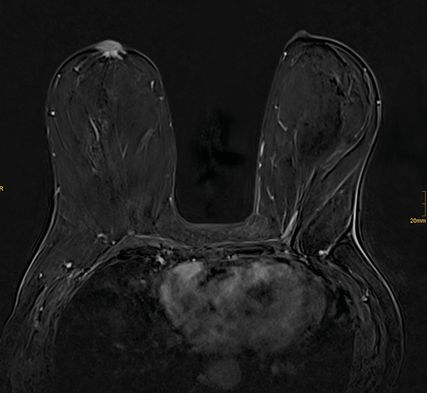
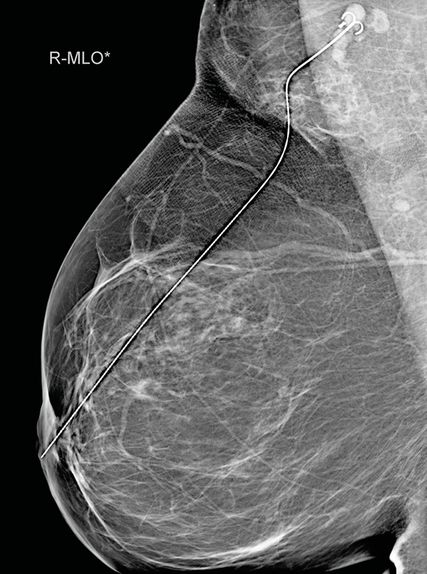
Abb. 1: In der MRT zeigt sich eine neoplastische Infiltration der Mamille
In der MRT vom 10. Oktober 2023 (Abb. 1) zeigte sich eine neoplastische Infiltration der Mamille rechts von 20mm Durchmesser, zudem etwas asymmetrische Lymphknoten (LK) zugunsten Level I rechte Axilla, suspekt, BIRADS 4.
Die sonografisch gezielte Biopsie des LK axillär rechts am 11. Oktober 2023 ergab einen positiven Befund: tumorbesiedelter Lymphknoten bei bekanntem Mammakarzinom, ER: 80%, PR: 30%, HER2+: (1+), Ki67: 30%. Staging-Untersuchungen mit CT von Thorax/Abdomen und GKKS waren unauffällig.
Tumorboard-Empfehlung zur Therapie
Abb. 2: Präoperative Drahtmarkierung des biopsierten und geklippten LK; zentrale Resektion mit TAD rechts
Im interdisziplinären Tumorboard wurde die primäre Operation besprochen mit präoperativer Drahtmarkierung des biopsierten und geklippten Lymphknotens (Abb. 2).
Am 27. Oktober 2023 wurde eine zentrale Resektion mit TAD („targeted axillary dissection“) rechts durchgeführt. Hier wurden der biopsierte und geklippte, markierte LK und die Sentinel-LK sowie alle suspekten, palpablen LK in der Axilla entfernt. Der histologische Befund ergab:
-
ein invasives mäßig differenziertes lobuloduktales Mammakarzinom G2
-
pT2 (2,2cm), N1a (1/4), L0, Pn1, R0 (nächster kranialer und kaudaler Resektionsrand 2mm tumorfrei)
-
Epidermis tumorfrei, ER: 90%, PR: 80%, HER2–, Ki67: 30%
Im Tumorboard vom 9. November 2023 wurde die Durchführung eines Genexpressionstests empfohlen. Der Endopredict-Test zeigte einen molekularen 12-Gen-Score von 9,5, EPclin-Score: 5,0, EPclin-Klasse: hohes Risiko.
Das bedeutet:
-
Wahrscheinlichkeit eines Fernrezidivs innerhalb der Jahre 0 bis 10: 41%
-
Wahrscheinlichkeit eines Fernrezidivs innerhalb der Jahre 5 bis 15: 32%
-
Absoluter Nutzen der Chemotherapie nach 10 Jahren: 20%
Im Tumorboard vom 16. November 2023 wurden in Zusammenschau mit diesem Befund die adjuvante Chemotherapie, Strahlentherapie und endokrine Therapie empfohlen.
Derzeit erhält die Patientin adjuvant Docetaxel/Cyclophosphamid q21d 6x bei guter Verträglichkeit.
Fazit
Die Diagnostik des Mammakarzinoms ist bildgebend nicht immer einfach. Bei Veränderungen der Mamille sollte immer auch an einen Morbus Paget oder ein invasives Mammakarzinom gedacht werden. Alle suspekten Läsionen und Lymphknoten sollten bioptisch verifiziert und markiert werden. So kann bei geringem Lymphknotenbefall in der Axilla eine zielgerichtete axilläre Operation erfolgen und der Patientin/dem Patienten die komplette Axilladissektion erspart werden. Bei unklarem Risiko kann zur Entscheidung für oder gegen eine Chemotherapie die genaue Quantifizierung des Benefits für die Patientin/den Patienten mithilfe eines multigenomischen Tests zusätzlich zur immunhistochemischen Untersuchung des Tumors durchgeführt werden.
Autorin:
Assoc. Prof. PD Dr. Ruth Exner
Universitätsklinik für Allgemeinchirurgie
Klinische Abteilung für Viszeralchirurgie
Medizinische Universität Wien
E-Mail:
ruth.exner@meduniwien.ac.at
Pankreaskarzinom
Patientin, 67 Jahre bei Diagnosestellung
Onkologische Anamnese
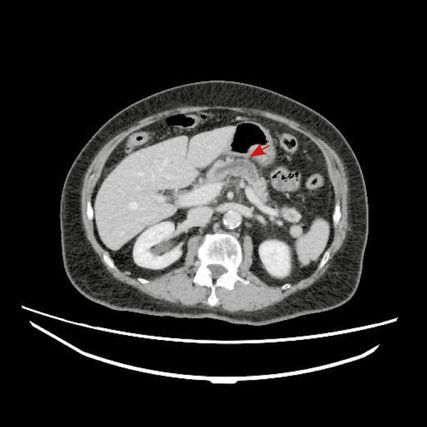
Abb. 1: Kontrastmittel-CT, axial: Der Pfeil zeigt auf die Pankreasveränderungen
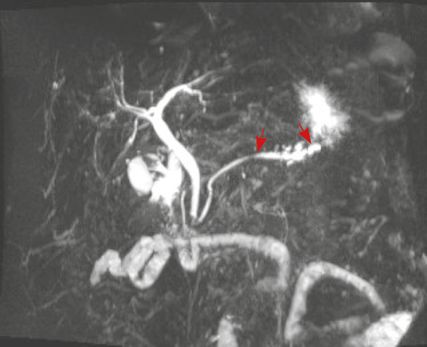
Eine 67-jährige Patientin stellte sich aufgrund von rezidivierenden Pankreatitiden und Cholezystolithiasis vor. Es wurden Kontrastmittel-CT (Abb. 1, 2) des Abdomens und eine Magnetresonanz-Cholangiopankreatikografie (MRCP, Abb. 3) veranlasst. In den Aufnahmen ergab sich ein unklarer Befund im Pankreas mit unregelmäßigem Pankreasgang.
Im Laborbefund zeigte sich ein stark erhöhter Lipasewert von 209U/l (Norm <78U/l); der Tumormarker CA 19-9 lag im Normbereich.
Wegen des unklaren Befunds und des Verdachts auf eine Hauptast-IPMN (intraduktale papillär-muzinöse Neoplasie) empfahl das Tumorboard zur weiteren Abklärung eine Endosonografie mit Biopsie.
Weitere Abklärung
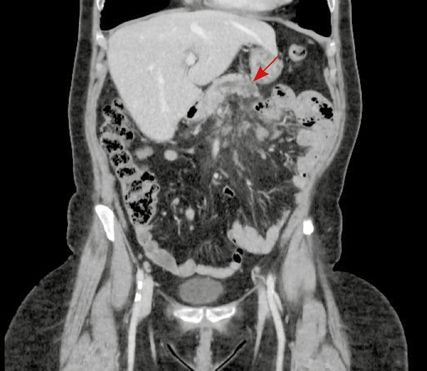
Abb. 2: Kontrastmittel-CT, koronar, mit Pfeil auf verändertes Pankreas
Endosonografisch war eine hochsuspekte Stenose im zentralen Anteil des Ductus pancreaticus im Korpus erkennbar. Während der Untersuchung wurde eine Biopsie für die histologische Untersuchung entnommen.
Im histologischen Befund fand sich freiliegendes Epithel mit hochgradig neoplastischen Veränderungen, aber ohne geweblichen Zusammenhang; dazu reichlich freiliegendes Mucin und Fragmente von chronisch atrophem Pankreasparenchym.
Tumorboard-Empfehlung zur Therapie
Abb. 3: Magnetresonanz-Cholangiopankreatikografie mit Pfeilen auf dem unregelmäßigen Pankreasgang
Wegen des Verdachts auf Hauptast-IPMN empfahl das Tumorboard eine laparoskopische Pankreaslinksresektion mit Splenektomie en bloc und Cholezystektomie.
Histologischer Befund: „mixed-type“ IPMN vom intestinalen Typ, „high-grade“; fokal assoziierte Invasion mit azellulären Mucinseen (kolloidales Adenokarzinom).
Klassifikation: pT1b, pN0 (0/25), V0, L0, PN0, R0
Aufgrund des histologischen Befundes empfahl das Tumorboard, eine adjuvante Chemotherapie vorzunehmen.
Autoren:
Univ.-Prof. Dr. Oliver Strobel
Univ.-Prof. Dr. Martin Schindl
Assoc. Prof. PD Dr. Gerald Prager
Pancreatic Cancer Unit
Comprehensive Cancer Center Vienna
Medizinische Universität Wien
Korrespondenz:
E-Mail:
martin.schindl@meduniwien.ac.at
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...